抑郁模型大鼠不同部位miR-16表达及其与5-羟色胺转运体的关联性研究
2015-06-13宋明芬王玉文董介正施剑飞张永华
宋明芬 王玉文 董介正 章 隆 施剑飞 张永华
抑郁模型大鼠不同部位miR-16表达及其与5-羟色胺转运体的关联性研究
宋明芬 王玉文 董介正 章 隆 施剑飞 张永华
目的 研究miR-16在慢性不可预知温和应激抑郁症模型大鼠神经系统不同部位的表达及其与5-羟色胺(5-HT)转运体的关联性。方法 对照组和慢性不可预知温和应激抑郁模型组大鼠各10只,模型组大鼠接受21天的不可预知温和应激刺激,对照组大鼠正常饲养。两组大鼠麻醉后收集脑脊液,测定miR-16。然后断头处死,分离前额叶皮质、中缝核、海马,测定miR-16和5-HT转运体蛋白。结果 模型组大鼠脑脊液和中缝核的miR-16相对表达量低于对照组,中缝核miR-16与5-HT胺转运体呈负相关;而前额叶皮质和海马中的miR-16、5-HT转运体分别与对照组比较,差异均无统计学意义(P>0.05)。结论 中缝核miR-16可能通过调节5-HT转运体的表达,参与抑郁症的病理过程,脑脊液miR-16亦可能与抑郁症相关。
慢性不可预知温和应激抑郁模型 miR-16 5-HT转运体
世界卫生组织公布,抑郁症已成为世界第4大疾患,预计到2020年,可能成为仅次于冠心病的第2大疾病[1]。抑郁症具有患病率高(终生患病率女性为10%~25%、男性为5%~12%)、复发率高(1年30%,5年70%)、自杀率高(10%~25%)等特点,是全球性公共卫生问题之一,给个人、家庭和社会带来极大的精神损失和巨大的经济负担[2~4]。然而,其病因和发病机制尚未清楚,给该病的诊断和治疗带来极大困难。microRNAs(miRNAs)是近年来表观遗传学研究的热点,是一类进化保守的、18~25个核苷酸的非编码RNA分子,通过与靶基因的mRNA 3′非翻译区(3′-untranslated region, UTR)结合,引起mRNA的降解或者翻译的抑制,从而调节蛋白表达,在生物发育和疾病发生、发展中起重要作用[5, 6]。现有的研究揭示,miR-16可能与抑郁症相关,其参与抑郁症的机制,可能是其在脑组织中以5-羟色胺(5-HT)转运体(serotonin transporter, SERT)基因作为靶基因,参与SERT翻译水平的调控,从而影响脑组织内5-HT神经递质功能发挥[7, 8]。但至今尚未明确神经系统中的哪些部位参与抑郁症的发病。本实验通过建立大鼠慢性不可预知温和应激抑郁模型,比较抑郁模型组和对照组miR-16在不同部位(脑脊液、前额叶皮质、海马、中缝核)的差异,以及分析miR-16与SERT蛋白的相关性,旨在探明miR-16参与抑郁症的作用部位及其机制,为弄清抑郁症的发病机制以及寻找合适的生物学标志物提供参考。
材料与方法
1.实验动物及分组:清洁级雌性SD大鼠20只,购自浙江省医学科学院,实验动物合格证号:SCXK(浙)2008-0033,体重约150g,随机分成对照组(10只)和抑郁模型组(10只)。饲养室温度23±1℃, 相对湿度55%±5%。
2.抑郁模型建立:慢性不可预知温和应激(chronic unpredictable mild stress, CUMS)模型组大鼠每天随机接受以下刺激中的1种:4℃冰水浴5min、禁水24h、昼夜跌倒、悬尾10min、45℃高温5min、禁食48h、鼠笼倾斜24h、潮湿垫料24h、夹尾1min、束缚应激2h,连续3周。对照组大鼠每天12h明亮(8:00~20:00)、12h黑暗(20:00~8:00),自由摄食饮水。
3.抑郁行为评定:采用糖水消耗实验和旷场实验评定抑郁样行为。(1)糖水消耗实验:造模前和造模后各1次,分3天完成,第1天将大鼠单笼饲养,给予2瓶1%的蔗糖水;第2天,将其中1瓶蔗糖水换成自来水,进行蔗糖水偏好训练。第3天,大鼠禁水23h后,给予1瓶1%蔗糖水和1瓶自来水,计算1h内蔗糖水和自来水消耗量,进行糖水偏好率测定。糖水偏好率(%)=糖水消耗量/(糖水消耗量+自来水消耗量)×100%。(2)旷场实验:长宽高分别100cm、100cm和60cm的容器,底部等分为面积相等的25格,内壁为黑色,容器正上方放置一个摄像头,将单只大鼠放入中央,纪录3min内的行走得分与垂直得分(行走得分:大鼠3只爪子进入1个格子计1分;垂直得分:大鼠前爪离地或攀附桶壁1次计1分)。旷场试验固定在18:00~19:00时进行,安静黑暗环境,并每次都清理大鼠排泄物,去除可能留下的味道。每只大鼠造模前与造模后共进行2次旷场试验。
4.脑脊液、前额叶皮质、海马、中缝核组织的取材:抑郁行为学指标测定后,在大鼠麻醉后,头部固定于定向仪上。头颈部剪毛、消毒,用手术刀沿纵轴切一纵行切口(约2cm)用剪刀钝性分离颈部背侧肌肉。为避免出血, 最深层附着在骨上的肌肉用手术刀背刮开,暴露出枕骨大孔,由枕骨大孔进针直接抽取脑脊液。断头处死大鼠,按包新民等的大鼠脑立体定位图谱,在冰上迅速分离前额叶皮质、海马和中缝核[9]。
5.Western blot法测定SERT蛋白:使用真核膜蛋白提取试剂盒Mem-PER Eukaryotic Membrane Protein Extraction Reagent Kit(Thermo Fisher Scientific公司, 美国)提取前额叶皮质、海马、中缝核组织的膜蛋白,并且通过Bradford法对蛋白进行定量。Western blot法测定SERT蛋白的步骤按照Huff等[10]的文章进行。抗SERT一抗 (1∶250稀释),抗β-actin一抗(1∶250稀释)以及辣根过氧化物酶标记的二抗(1∶5000稀释)购自加拿大Santa Cruz公司。使用ChemiDocTM XRS+ (Bio-rad美国)系统自带的软件分析SERT蛋白条带,并用β-actin进行校正。
6.实时荧光定量PCR法测定miR-16:通过miRcute miRNA提取分离试剂盒(北京天根生化科技有限公司)提取脑脊液、前额叶皮质、海马、中缝核总RNA,用nanodrop(美国thermo scientific公司)测定其浓度及纯度;取2μg RNA进行反转录,获得的cDNA用于下一步的实时定量荧光PCR扩增。U6为内参校准基因,引物序列:5′-ACGCAAATTCGTGAAGCGTTCCAT-3′,miR-16引物序列:5′-TAGCAGCACGTAAATTGGCG-3′。下游引物为通用引物[北京天根生化科技有限公司miRcute miRNA荧光定量检测试剂盒(SYBR Green)自带]。实时定量荧光PCR扩增程序为:预变性94℃ 2min;PCR反应:94℃ 20s,60℃ 34s,循环40次,实时PCR仪购自ABI公司stepone plus,使用仪器配套软件自动对数据进行分析得到每个样本的循环阈值(cycle threshold,Ct值),并通过标准曲线法获得每个样本的miR-16含量,所得数据用对应的U6进行校正。
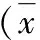
结 果
1.抑郁行为学指标结果:造模前,模型组的糖水消耗率、旷场实验水平得分和垂直得分分别与对照组比较,差异无统计学意义(P值分别为0.872、0.835和0.602);造模后,抑郁模型组大鼠糖水偏好率显著低于对照组(P=0.032),旷场实验水平得分和垂直得分都明显低于对照组(P=0.042和P=0.000,表1)。
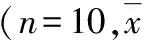
表1 两组大鼠糖水消耗实验以及旷场实验结果 ±s)
2.脑脊液、海马、前额叶皮质、中缝核miR-16测定结果:模型组脑脊液中的miR-16相对表达量比对照组明显降低,差异有统计学意义(t=3.049,P=0.007);海马中miR-16相对量在两组间差异无统计学意义(t=0.169,P=0.868)。前额叶皮质miR-16的相对表达量,模型组与对照组之间的差异亦无统计学意义(t=0.280,P=0.782)。中缝核miR-16的相对表达量,模型组显著低于对照组,差异有统计学意义(t=2.333,P=0.031,表2,图1)。
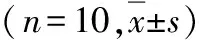
表2 脑组织不同部位miR-16测定结果
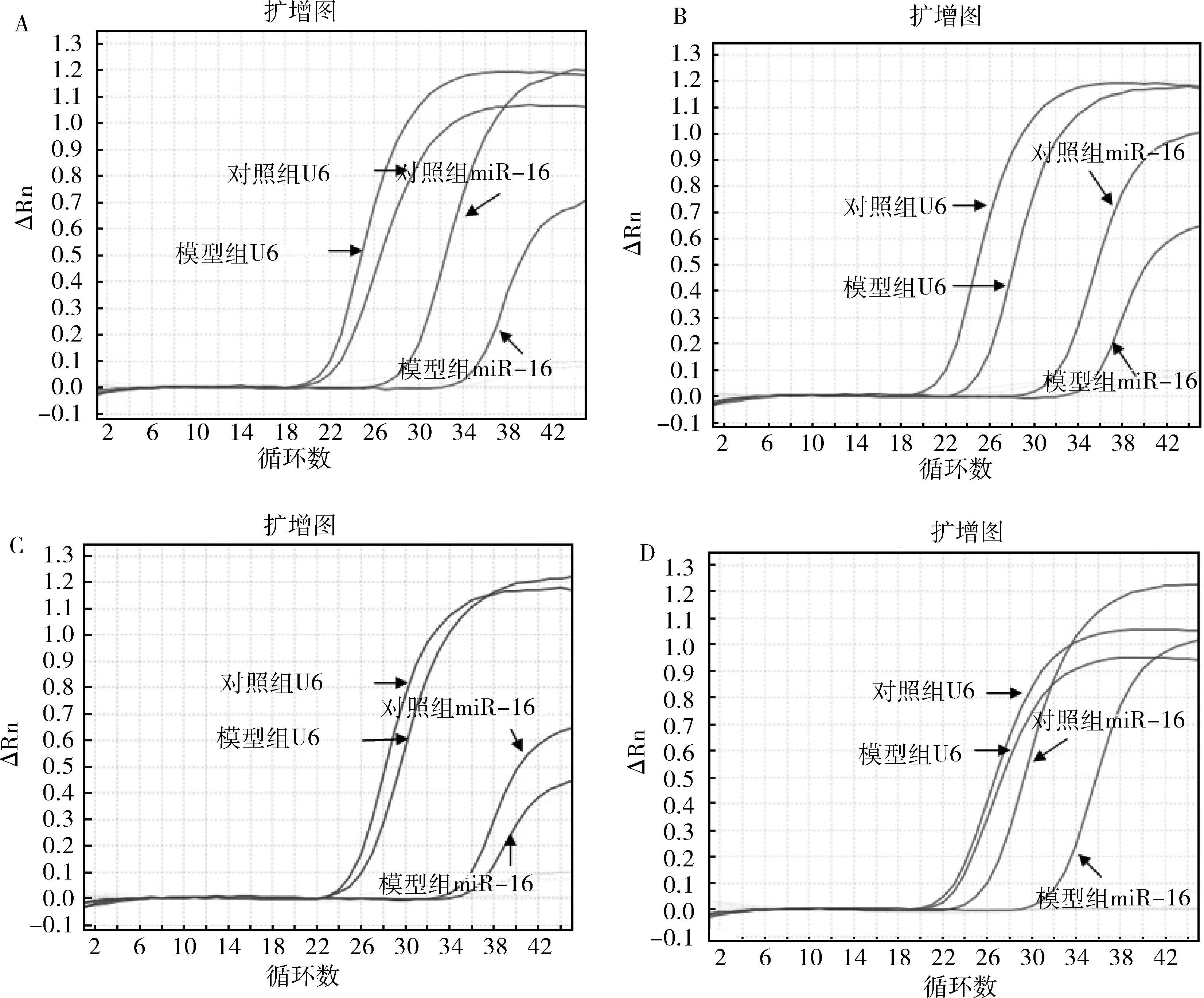
图1 脑脊液和中缝核miR-16荧光定量PCR测定结果A.脑脊液;B.海马;C.前额叶皮质;D.中缝核
3.海马、前额叶皮质、中缝核SERT蛋白测定结果:SERT蛋白的水平,海马组织中,模型组与对照组比较,差异无统计学意义(t=0.243,P=0.811);前额叶皮质中,模型组与对照组之间的差异均无统计学意义(t=0.762,P=0.456)。中缝核中,模型组显著高于对照组,差异有统计学意义(t=3.184,P=0.005,图2和表3)。
4.中缝核miR-16与SERT蛋白表达的关联性:经相关分析,对照组和模型组中缝核miR-16与相应的SERT蛋白之间均存在明显的负相关关系。对照组的相关系数为r=-0.662,P=0.037; 模型组的相关系数为r=-0.701,P=0.024,详见图3。
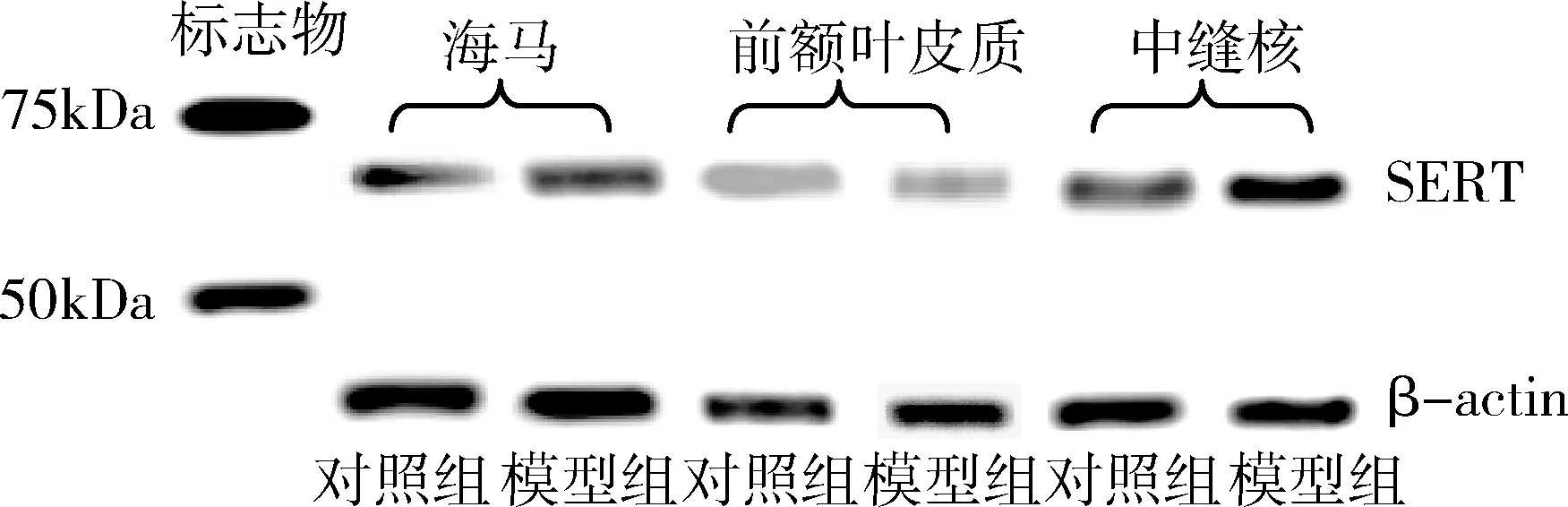
图2 不同脑区SERT蛋白Western blot法检测结果
表3 不同脑区SERT蛋白测定结果
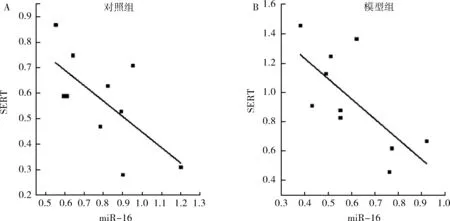
图3 中缝核miR-16与SERT蛋白的相关性A.对照组;B.模型组
讨 论
本实验通过建立慢性不可预知温和应激大鼠抑郁模型,研究大鼠神经系统不同部位miR-16表达及其与SERT的关联性,从而进一步明确miR-16在何部位参与抑郁症的病理生理过程。在脊椎动物体内,脑组织中的miRNAs远比其他组织丰富,提示miRNAs可能在脑功能的发挥中起着重要作用[11, 12]。有研究者发现,脑脊液中的miRNAs可能与精神疾病相关。比如2014年,Muller等[13]的研究表明,阿尔茨海默病患者脑脊液中的miR-146a比健康人低。但是迄今为止,尚未有抑郁症脑脊液miR-16水平的报道。因此本实验采集了抑郁模型大鼠的脑脊液,进行miR-16测定,结果发现其水平比对照组大鼠低。该结果有待进一步证实,以确定脑脊液miR-16作为抑郁症生物学标志物的可行性。
本研究还对脑组织前额叶皮质、海马、中缝核中的miR-16进行了测定。有研究者发现,抑郁症自杀患者前额叶皮质中的某些miRNAs存在异常,如miR-494和miR-335比健康对照低[14]。但是,目前尚未发现抑郁症前额叶皮质miR-16的报道,本次抑郁模型大鼠的前额叶皮质miR-16水平测定结果表明,模型组大鼠前额叶皮质miR-16水平与对照组比较,差异无统计学意义,而且该部位SERT蛋白的表达亦与对照组差异无统计学意义,表明,前额叶皮质miR-16可能不参与抑郁症的病理过程。
近年来,海马miR-16与抑郁症的研究得到了一些研究者的关注。如张逸等[15]在母爱剥夺大鼠抑郁模型中,发现海马miR-16比正常大鼠高,作者认为,海马高miR-16参与了母爱剥夺诱发的大鼠抑郁样行为的病理过程。在另外的一项研究中,抗抑郁药氟西汀能降低小鼠海马组织miR-16,如果使用人工合成的抗miR-16对miR-16进行中和,则抗miR-16表现出抗抑郁样作用[16]。但是在Bai等的研究中,作者采用慢性不可预知温和应激建立抑郁模型,未发现模型大鼠的海马miR-16发生改变。基于海马miR-16在不同抑郁模型结果中的不一致性,以及Bai等[17]未比较海马SERT蛋白的差异,因此本实验在测定模型大鼠海马miR-16的同时,也分析了海马SERT的差异,结果表明,模型大鼠海马miR-16并未升高,该结论与Bai等[17]发表的论文一致,而且该部位SERT蛋白的表达,与对照组比较,亦无统计学差异。以上结果表明,海马miR-16未参与和慢性不可预知温和应激抑郁相关的病理过程,提示不同的应激所诱发的大鼠抑郁行为,其机制可能不同。
中缝核因聚集5-HT能神经元,其主要功能是产生递质5-HT,因而在miR-16与抑郁症的关联性研究中具有重要意义。Baudry 等将氟西汀(1μmol/L、2μl/min)直接缓慢注入中缝核3天,发现该区miR-16升高了2.5倍,SERT的表达降低了2倍;直接在该区注射miR-16(1μl、2μmol/L)也观察到SERT表达的下降;然而,当氟西汀和抗miR-16一起注射的时候,SERT表达未受影响,由此可见,氟西汀是通过miR-16调节SERT蛋白的表达[7]。然而,在抑郁动物模型中,中缝核miR-16与对照的差异却未被报道。本次实验表明,慢性不可预知温和应激抑郁模型大鼠中缝核miR-16低于对照组,其SERT蛋白水平却高于对照组,且两者间存在明显的负相关关系。笔者认为,中缝核低miR-16状态,可导致SERT蛋白过高表达,从而影响5-HT递质系统的功能,从而参与慢性不可预知温和应激造成的抑郁过程。
总之,本实验通过测定神经系统不同部位miR-16水平,探讨miR-16参与抑郁症的可能部位及其机制。结果表明,慢性不可预知温和应激抑郁模型大鼠脑脊液和中缝核miR-16存在异常,中缝核miR-16可能通过调节SERT蛋白表达而参与抑郁症的发病过程。
1 Chapman DP, Perry GS. Depression as a major component of public health for older adults[J]. Prev Chronic Dis, 2008, 5(1): A22
2 沈渔邨. 精神病学 [M]. 北京: 人民卫生出版社, 2010: 503
3 马辉, 杨华, 张宁. 抑郁症康复期心理社会功能恢复特点及持续心理治疗的必要性[J]. 中华行为医学与脑科学杂志, 2011, 20(12): 1145-1146
4 浦梦佳, 张志珺. 抗抑郁剂治疗效应基因组学研究进展[J]. 中华行为医学与脑科学杂志, 2011, 20(1): 93-95
5 Murphy DL, Moya PR. Human serotonin transporter gene (SLC6A4) variants: their contributions to understanding pharmacogenomic and other functional GxG and GxE differences in health and disease[J]. Curr Opin Pharmacol, 2011, 11(1): 3-10
6 Monroe SM, Reid MW. Gene-environment interactions in depression research: genetic polymorphisms and life-stress polyprocedures[J]. Psychol Sci, 2008, 19(10): 947-956
7 Baudry A, Mouillet-Richard S, Schneider B,etal. miR-16 targets the serotonin transporter: a new facet for adaptive responses to antidepressants[J]. Science, 2010, 329(5998): 1537-1541
8 Moya PR, Wendland JR, Salemme J,etal. miR-15a and miR-16 regulate serotonin transporter expression in human placental and rat brain raphe cells[J]. Int J Neuropsychopharmacol, 2013, 16(3): 621-629
9 包新民, 舒斯云. 大鼠脑立体定位图谱[M]. 北京: 人民卫生出版社, 1991
10 Huff C, Bhide N, Schroering A,etal. Effect of repeated exposure to MDMA on the function of the 5-HT transporter as assessed by synaptosomal 5-HT uptake[J]. Brain Res Bull, 2013, 91: 52-57
11 Fineberg SK, Kosik KS, Davidson BL. MicroRNAs potentiate neural development[J]. Neuron, 2009, 64(3): 303-309
12 Lagos-Quintana M, Rauhut R, Yalcin A,etal. Identification of tissue-specific microRNAs from mouse[J]. Curr Biol,2002, 12(9): 735-739
13 Muller M, Kuiperij HB, Claassen JA,etal. MicroRNAs in Alzheimer′s disease: differential expression in hippocampus and cell-free cerebrospinal fluid[J]. Neurobiol Aging, 2014, 35(1): 152-158
14 Smalheiser NR, Lugli G, Rizavi HS,etal. MicroRNA expression is down-regulated and reorganized in prefrontal cortex of depressed suicide subjects[J]. PLoS One, 2012, 7(3): e33201
15 张逸, 朱熊兆, 张晟, 等. 母爱剥夺诱导的抑郁大鼠海马miR-16的表达[J]. 中南大学学报:医学版, 2012, 37(12): 1193-1197
16 Launay JM, Mouillet-Richard S, Baudry A,etal. Raphe-mediated signals control the hippocampal response to SRI antidepressants via miR-16[J]. Transl Psychiatry, 2011, 1: e56
17 Bai M, Zhu X, Zhang Y,etal. Abnormal hippocampal BDNF and miR-16 expression is associated with depression-like behaviors induced by stress during early life[J]. PLoS One, 2012, 7(10): e46921
(修回日期:2015-02-23)
miR-16 Expression and Its Association with Serotonin Transporter in Multi-tissues of Depression Model Rats.
SongMingfen,WangYuwen,DongJiezheng,etal.
DepartmentofMolecularBiologicalLaboratory,HangzhouSeventhPeople′sHospital,Zhejiang310013,China
Objective To explore the expression of miR-16 and its association with serotonin transporter in multi-tissues from the rat model of chronic unpredictable mild stress-induced depression. Methods SD rats were randomly divided into the control group and the depression group. Rats in the depression group experienced unpredictable mild stressors for 3 weeks, while rats in the control group
no treatment. MiR-16 in cerebrospinal fluid, prefrontal cortex, hippocampus, and raphe was detected by real-time PCR. Serotonin transporter protein in prefrontal cortex, hippocampus, and raphe was detected by Western blotting. Results The relative expression levels of miR-16 in cerebrospinal fluid and raphe of the depression group were significantly lower than those of the control group. In raphe, the miR-16 level was negatively associated with expression of serotonin transporter protein. However, there was no significant difference of miR-16 expression in prefrontal cortex and hippocampus between the depression group and the control group. Conclusion MiR-16 in raphe may involve in the pathological process of depression via regulation of serotonin transporter expression. MiR-16 in cerebrospinal fluid may also associate with depression.
chronic unpredictable mild stress model of depression; miR-16; 5-HT serotonin transporter
浙江省自然科学基金资助项目(LQ13H090003);杭州市科技发展计划项目重点专科专病科研攻关专项基金资助项目(20130733Q26,20130733Q27)
310013 杭州市第七人民医院分子生物学实验室(宋明芬、章隆),药剂科(王玉文),精神科(董介正、施剑飞、张永华)
张永华,主任中医师,博士生导师,电子信箱: hzs7lwfb@163.com
R74
A DOI 10.11969/j.issn.1673-548X.2015.10.012
2015-01-28)
