CD40L对单纯疱疹病毒2型DNA疫苗的免疫增强作用研究
2015-06-13胡如西何卓晶
胡如西 陶 薇 傅 婷 何卓晶 贾 岚 洪 艳 陈 勇
CD40L对单纯疱疹病毒2型DNA疫苗的免疫增强作用研究
胡如西 陶 薇 傅 婷 何卓晶 贾 岚 洪 艳 陈 勇
目的 研究重组质粒pcDNA3-Kan/CD40L辅佐HSV-2 DNA疫苗增强小鼠体液免疫和细胞免疫的作用效果,探讨其作为HSV-2 DNA疫苗佐剂的潜力。方法 (1)构建鼠CD40L基因的重组真核表达质粒pcDNA3-Kan/CD40L。(2)体外细胞实验:检测重组质粒pCD40L刺激小鼠外周血淋巴细胞增殖情况和脾细胞分泌IFN-γ的能力。(3)体内动物实验:48只雌性BALB/c小鼠随机分为4个免疫组pK组、pgD组、pcCD40L+pgD组和pK+pgD组。小鼠后腿肌内注射,共免疫2次,间隔3周。末次免疫3周后,每组随机取4只小鼠进行致死剂量攻毒实验验证疫苗的保护作用。 ELISA检测小鼠血清抗HSV-2 IgG抗体水平和趋化因子RANTES;流式细胞术检测全血中CD4+和CD8+T细胞百分率以及分泌IFN-γ和IL-4的T细胞的百分率;MTS法检测小鼠脾脏T细胞的增殖能力。结果 (1)体外实验结果:重组质粒pcDNA3-Kan/CD40L对小鼠外周血淋巴细胞的增殖能力和刺激脾细胞分泌IFN-γ的能力均显著大于空质粒pcDNA3-Kan(P<0.05)。(2)体内实验结果:小鼠血清抗HSV-2 IgG水平、趋化因子RANTES、脾淋巴细胞刺激指数和外周血CD4+T细胞数和分泌IFN-γ的Th1细胞数均高于其他免疫组(P<0.05)。pcDNA3-Kan/CD40L+pgD组预防小鼠感染HSV-2效果好于其他免疫组。结论 (1)重组质粒pcDNA3-Kan/CD40L能够诱导外周血淋巴细胞增殖并刺激脾细胞分泌IFN-γ具有作为疫苗佐剂的潜力。(2)pcDNA3-Kan/CD40L可以辅助HSV-2 DNA疫苗诱导BALB/c小鼠产生特异性抗HSV-2的体液免疫和细胞免疫,具备作为HSV -2 DNA疫苗免疫佐剂的能力。
CD40配体(CD40L) 单纯疱疹病毒2型(HSV-2) 疫苗佐剂
单纯疱疹病毒(HSV)的感染是人类比较常见的感染性疾病之一,包括HSV-1和HSV-2型[1]。目前,市面上还没有能够有效控制HSV的特效药,研制有效的疫苗是控制HSV感染的关键。随着分子生物学技术的发展,多肽疫苗和DNA疫苗的研制成为近年来研究的热点,其中DNA疫苗因具有诱导全面免疫应答的高效性而备受青睐,本研究涉及的HSV-2核酸疫苗是由笔者所在课题组研究开发,动物实验结果显示该疫苗对于小鼠具有很好的免疫原性和保护效力[2]。为了寻求更高的体液免疫和细胞免疫效果,DNA疫苗可以利用各种免疫佐剂与之相配合[3]。
CD40L属于肿瘤坏死因子超家族(TNFSF),是一种39kDa的Ⅱ型膜糖蛋白,主要活化T细胞表面的协同刺激分子,特别是CD4+T细胞,其分布广泛,主要表达于活化T细胞表面,特别是活化CD4+T细胞[4~6]。CD40L在机体免疫应答方面扮演着重要角色,其可直接刺激B细胞和树突状细胞(DCs)以增强T细胞反应和抗体产生;能够增强活化B细胞分化,促进免疫生发中心形成;也能够激活DCs启动细胞毒性CD8+T细胞反应[7];还能够与受体CD40相互作用。这些免疫刺激功能使得CD40L具有作为疫苗佐剂的潜力。
本研究构建了含有鼠CD40L基因的重组真核质粒pCD40L,通过体外细胞实验研究CD40L是否具有核酸疫苗免疫佐剂的潜能,再经体内动物实验研究CD40L辅佐HSV-2 DNA疫苗增强小鼠体液免疫和细胞免疫的能力,考察其作为核酸疫苗免疫佐剂的可能性。
材料与方法
1.质粒、菌种和病毒:质粒载体pK(pcDNA3-kan质粒)由本实验室改建了pcDNA3质粒, 将Kan抗性基因代替了Amp基因,得到了真核表达质粒载体pcDNA3-kan(pK质粒)、重组质粒pgD(含单纯疱疹病毒Ⅱ型糖蛋白gD基因的卡那霉素抗性真核表达质粒pgD,为本实验室构建的HSV-2 DNA疫苗)、HSV-2病毒(LD50=10-1.88/0.1ml)由本实验室培养保存。DH5α感受态细胞购自康为世纪公司。
2.实验动物:清洁级BALB/c 小鼠,体重18~22g,购自浙江省实验动物中心。
3.实验试剂:限制性内切酶EcoR Ⅰ、Xho Ⅰ和T4DNA连接酶购自Thermo公司;Tap PCR Master Mix Kit、UltraSYBR Mixture和Rneasy Mini Kit购自Qiagen公司,第1链cDNA合成试剂盒购自TaKaRa公司;单溶液细胞增殖检测试剂盒(MTS)购自Promega公司;100bp DNA 标志物、DM10000 DNA 标志物、高纯度质粒小提试剂盒、快速琼脂糖凝胶DNA回收试剂盒购自康为世纪公司。离子霉素(iono mycin),佛波酯(phorbol 12-myristatc 13-acetate,PMA),刀豆蛋白A(concanavalin A,Con A)皆购自Sigma公司;红细胞裂解液、流式抗体FITC -CD4、PE -CD8a、FITC-IFN-γ、PE-IL-4和流式固定破膜试剂盒购自美国BD公司;Mouse RANTES (受激活调节正常T细胞表达和分泌因子,Regulated upon activation normal T cell expressed and secreted factor)试剂盒为eBioscience公司产品;小鼠淋巴细胞分离液购自天津灏洋生物公司;胎牛血清FBS、RPMI1640培养基购自GIBCO BRL公司;辣根过氧化物酶(HRP) 酶标羊抗鼠抗体购自鼎国生物生物技术公司;其他试剂为国产或进口分析纯试剂。
4.方法:(1) pCD40L质粒的构建:利用RT-PCR方法从BALB/c 小鼠脾细胞中获得CD40L基因并将其克隆至pK质粒中, 经酶切、测序验证得到pCD40L质粒[8]。(2)细胞实验-SYBR green QPCR:无菌条件下制备小鼠脾细胞悬液,按浓度梯度分别加入空质粒pK和重组质粒pCD40L。37℃,5%CO2条件下培养3天。用Rneasy Mini Kit提取总RNA, 以Oligod(T)n为引物,反转录生成cDNA。本实验选用β-actin作为内参。IFN-γ的上游引物:5′-TCAAGTGGCATAGATGTGGAAGA-3′,下游引物:5′-CTGGCTCTGCAGGATTTTCAT-3′(GeneBank: NC-000076.6);内参β-actin的上游引物:5′-AGAGGGAAATCGTGCGTGAC-3′,下游引物:5′-CAATAGTGATGACCTGGCCGT-3′(GeneBank: NM-007393.3)。取1μl上述反应合成的cDNA为模板进行real-time PCR的扩增。其扩增条件为95℃10min;预变性95℃ 15s,退火60℃ 1min,循环40个周期。所得数据采用Roto-Gene QPCR自带软件进行分析,mRNA相对含量分析采用2-ΔΔCt法[ΔΔCT=(CT,Target- CT,Actin)处理- (CT,Target- CT,Actin)对照]。(3)细胞实验-MTS比色法:无菌条件下采集小鼠眼球静脉血,用小鼠淋巴细胞分离液试剂盒分离淋巴细胞(按试剂盒说明书操作)。然后加入含10%FBS的RPMI1640培养基重悬细胞,按每孔5×105细胞接种于96孔细胞板,按浓度梯度分别加入空质粒pK和重组质粒pCD40L。37℃,5%CO2条件下培养3天,加入40μl MTS溶液,继续培养4h,用酶标仪检测490nm下的吸光度(A)值。细胞增殖率用刺激指数(stimulation index ,SI)表示,SI=(实验组A值-空白组A值)/(阴性对照组A值-空白组A值)。(4)动物实验-动物免疫和攻毒实验:48只雌性BALB/c小鼠随机分为以下4组:①空载体pK组(100微克/只);②空载体pK+重组质粒pgD组[(50微克+100微克)/只];③重组质粒 pgD组+重组质粒p CD40L组[(100微克+50微克)]/只;④重组质粒 pgD组(100微克/只),小鼠后腿肌内注射100微升/只,隔21天加强免疫1次,剂量相同。免疫第42天,每组随机选取4只小鼠进行攻毒实验。腹腔注射200微升/只20×LD50HSV-2病毒悬液,每天观察并记录小鼠死亡数,观察14天。(5)动物实验-免疫小鼠样本的收集:每次免疫后14天收集小鼠尾静脉血200μl分离血清,所有样本于-20℃保存。末次免疫后21天剖杀小鼠,无菌取小鼠脾脏,经200目尼龙纱布网滤过制备单个细胞悬液备用。(6)动物实验-间接ELISA法检测小鼠血清中IgG抗体:采用灭活HSV-2病毒包被酶联反应板,二抗采用羊抗鼠IgG-HRP,按常规ELISA法检测血清中IgG抗体A值。被检血清A450 /阴性对照A450≥2.1 为阳性,否则为阴性。(7)动物实验-流式细胞仪检测外周血中CD4+和CD8+T细胞百分率:经2次加强免疫的4组BALB/c小鼠最后1次免疫的14天后眼眶取血,肝素钠抗凝处理收集的血液,分别与FITC标记的单抗CD4+和PE标记的单抗CD8+避光孵育30min,PBS 洗涤3次后,流式细胞仪分析CD4+和CD8+百分率。实验结果使用Cellquest软件进行分析。(8)动物实验-MTS比色法检测小鼠脾脏T淋巴细胞增殖能力:小鼠加强免疫21天后各组小鼠按常规方法制备脾脏细胞,调节细胞浓度至5×106个/毫升,细胞100微升/孔。将细胞培养板分为3部分:分别为特异性抗原刺激孔-50μg/ml灭活单纯疱疹病毒;非特异性抗原刺激孔-10μg/ml Con A;对照孔-RPMI 1640完全培养液。将细胞培养板置于37℃,5%CO2,细胞培养箱中培养68h,加细胞活力检测试剂40微升/孔继续培养4h,酶标仪测A值。计算刺激指数SI=(实验组A值-空白组A值)/(阴性对照组A值-空白组A值)。(9)动物实验-小鼠血清中趋化因子RANTES的检测:经2次加强免疫的4组BALB/c 小鼠最后1次免疫的14天后眼眶取血,分离血清,样本保存于-20℃。按ELISA 试剂盒说明检测RANTES的含量。(10)动物实验-流式细胞仪检测外周血分泌IFN-γ和IL-4的T的表达水平:加强免疫35天后的小鼠肝素抗凝全血加入RPMI1640完全培养液(含20ng/ml佛波酯、1μmol/L离子霉素和0.7μl/ml莫能霉素)刺激培养4h;100μl培养液加2ml红细胞裂解液室温裂解10min后离心;染色缓冲液洗涤后离心;加固定透化液室温避光孵育20min,BD缓冲液洗涤后离心;加鼠流式抗体IFN-γ和IL-4室温避光染色30min,BD缓冲液洗涤后离心;加PBS500微升/管重悬细胞,流式细胞仪分析IFN-γ、IL-4的表达水平。实验结果使用Cellquest软件进行分析。
结 果
1.pCD40L重组质粒的构建:CD40L片段大小约为723bp,与预期的783bp相符。重组质粒pCD40L经EcoR Ⅰ和Xho Ⅰ双酶切后,显示为5.4 kb和783bp左右的片段(图1)。该质粒经DNA测序后,插入片段与GeneBank BC119225.1的鼠CD40L序列中l~783碱基序列完全相符。结果表明CD40L已成功地克隆到真核表达载体pK质粒中。
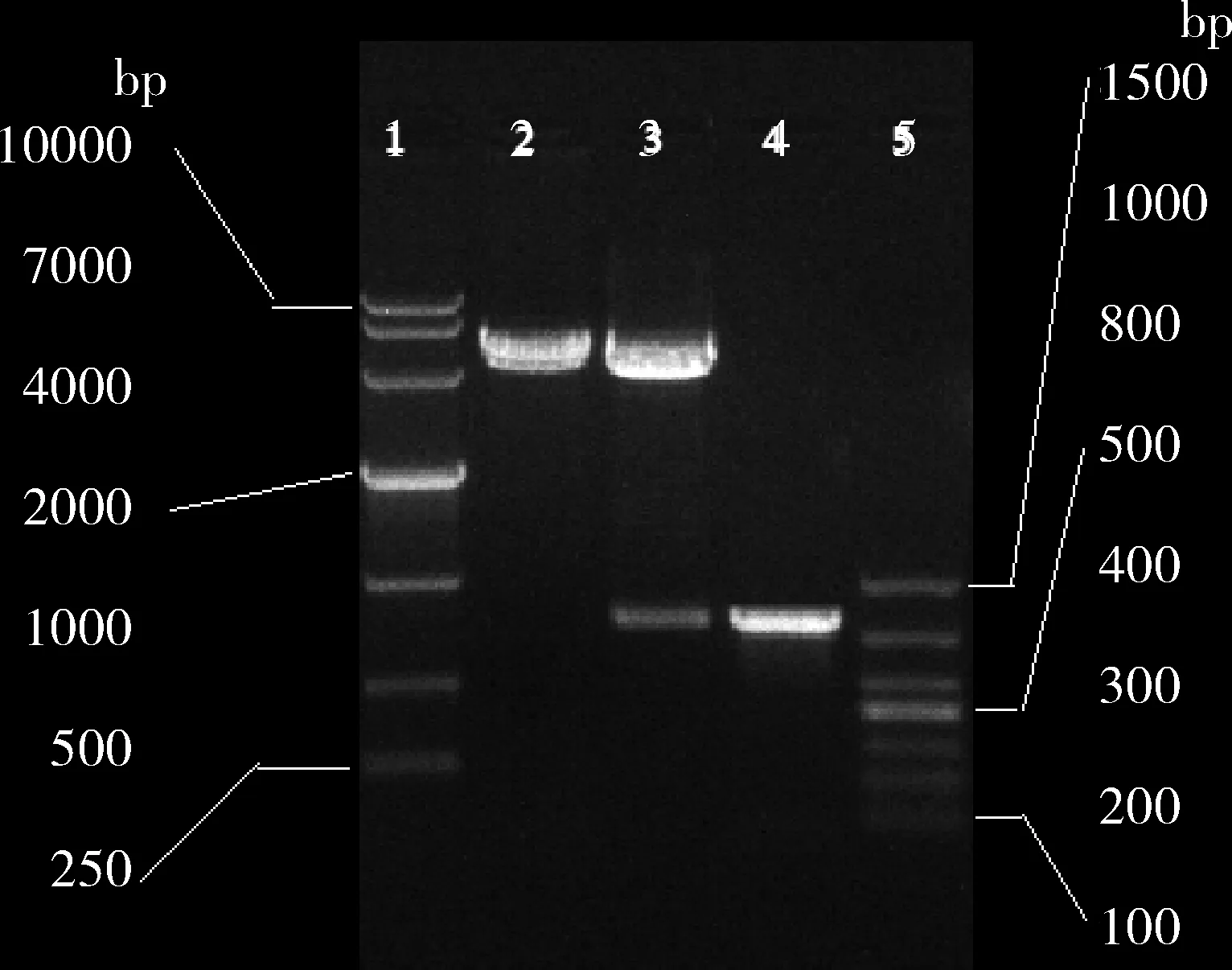
图1 pcDNA3-Kan/CD40L质粒酶切鉴定结果1.DM10 000 DNA标志物;2.pcDNA-Kan经EcoRⅠ和XhoⅠ 双酶切;3.pcDNA3-Kan/CD40L经EcoRⅠ和XhoⅠ双酶切;4.CD40L(约783bp);5.100bp DNA Ladder
2.细胞实验:(1)小鼠脾脏IFN-γ mRNA水平:不同浓度pCD40L(1、5、10、25、50、75和100μg/ml)在诱导脾细胞表达IFN-γ的能力与空质粒相比有统计学意义(P<0.05,图2)。(2)淋巴细胞增殖能力:当重组质粒pCD40L浓度在1、5、10、25μg/ml时,体外诱导大鼠外周,血淋巴细胞增殖能力(SI)与空质粒pK无明显差异。当浓度达到50、75μg/ml时,重组质粒组的SI值显著增加(P<0.05),表明外周血淋巴细胞明显增殖,而空质粒的SI值并无明显变化。当浓度达到100μg/ml时,重组质粒组的SI值显著下降(图3)。此外不同浓度的空质粒体外诱导大鼠外周血淋巴细胞增殖能力差异无统计学意义。
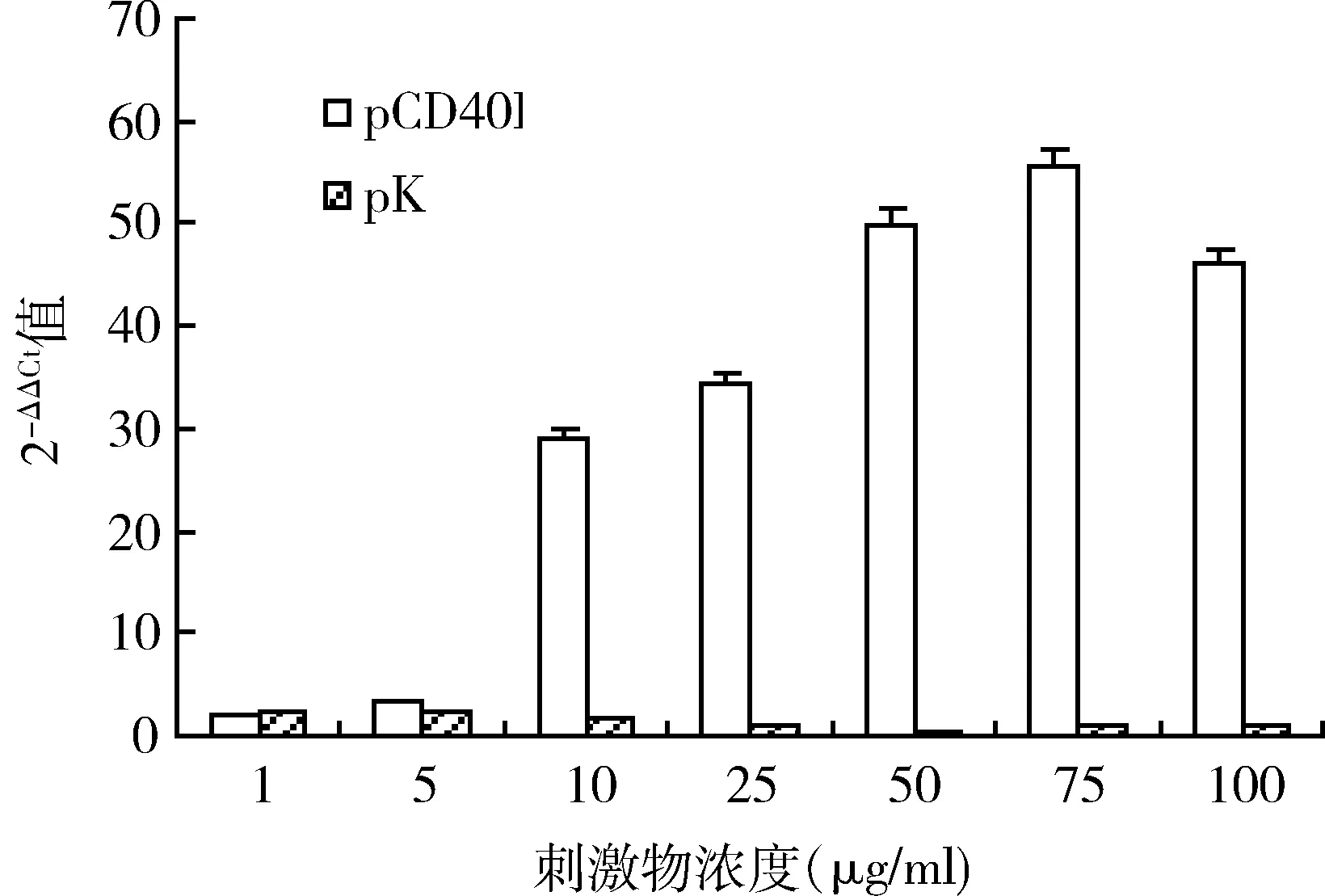
图2 小鼠脾脏IFN-γ mRNA水平

图3 淋巴细胞增殖能力
3.动物实验:(1)小鼠血清中抗HSV-2抗体的ELISA检测结果:初次免疫14天后,pCD40L+pgD组、pK+pgD组和pgD组产生的IgG的水平显著大于pK组(P<0.05),pCD40L+pgD组刺激产生的IgG的水平明显大于其他各组刺激产生的IgG的水平(P<0.05)。35天后除pK组外,其他3组的IgG均有明显的上升,并且各组间差异有统计学意义,特别是pCD40L+pgD组的IgG上升的最为明显(P<0.01),高于初次免疫14天后的特异性IgG A值的2倍之多。初免42天后,各组的IgG与第35天无明显变化,跟第2次接种14天差别不大(表1)。(2)动物实验-小鼠外周血中CD4+和CD8+T细胞百分率:初次免疫42天后的全血刺激培养液的流式检测结果显示,pCD40L+pgD组的CD4+细胞的百分率略高于不加佐剂组,与pK组相比差异有统计学意义(P<0.05),但其他两组间两两t检验,差异无统计学意义;加pCD40L+pgD组的CD8+细胞百分率略高于pK组 (P<0.05);其他3组间两两比较,差异无统计学意义(图4)。(3)小鼠T细胞增殖能力:加pCD40L佐剂组的ConA刺激指数和灭活单纯疱疹病毒刺激指数均高于其他各组,差异有统计学意义(P<0.05);其他3组间两两比较,差异均有统计学意义(图5)。(4)小鼠血清中RANTES含量:ELISA 法分析经2次免疫后小鼠血清中RANTES 的产生。pK组、pK+pgD组、pCD40L+pgD组、pgD组RANTES含量分别为10.034、201.633、676.633和170.204pg/ml。结果显示经2次免疫后,pCD40L+pgD组的RANTES含量最高,含量达到了676.633pg/ml,明显高于其他3组,各组间差异有统计学意义(P<0.05)。(5)小鼠外周血分泌IFN-γ和IL-4 T的表达水平:pCD40L+pgD组的IFN-γ的表达水平显著高于其他各组(P<0.05); 其他3组两两比较,差异均有统计学意义。加pCD40L+pgD组的IL-4 的表达水平均低于其他各组(P<0.05);其他3组两两比较,差异无统计学意义(图6)。(6)疫苗对小鼠的保护性:HSV-2病毒攻毒14天后,空质粒组小鼠全部死亡;pCD40L+pgD组存活3只,保护率为75%;pK+pgD组和pgD组的保护率仅为50%(图7)。
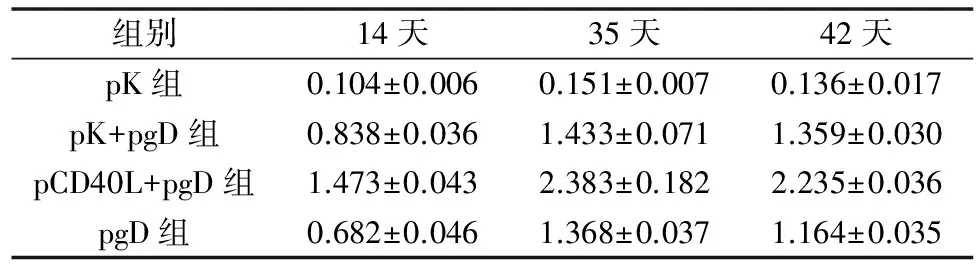
表1 小鼠血清抗HSV-2IgG吸光度值
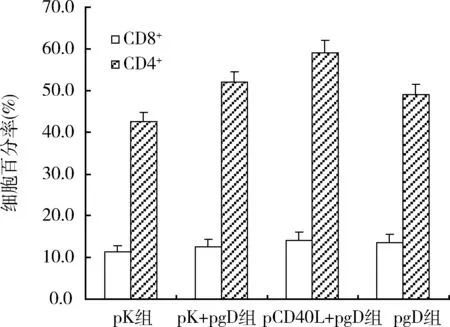
图4 小鼠外周血中CD4+和CD8+T细胞百分率

图5 小鼠T细胞增殖能力

图6 外周血分泌IFN-γ和IL-4 T的表达水平

图7 疫苗对小鼠的保护性
讨 论
CD40L是一种有着良好应用前景的新型免疫刺激剂。最近研究发现, CD40L的重组质粒作为病毒DNA疫苗的免疫佐剂在人类免疫缺陷病毒(HIV)、流感病毒、呼吸道合胞病毒(RSV)等感染的相关临床疾病中均能够增强DNA疫苗细胞免疫或体液免疫应答[9~11]。Sin等[12]做了类似研究,证明CD40L有作为疫苗佐剂的能力。但是,真核表达质粒pcDNA3为Amp抗性质粒,现在有研究发现如果终产品中有残留Amp,可能会对青霉素过敏的接种者不安全。本研究中,笔者采用了本实验室pK质粒。笔者的研究也获得了与其他研究者相似的研究结果。在体外实验中,笔者发现CD40L重组质粒具有诱导细胞免疫的能力。本研究利用CD40L重组质粒直接作用小鼠外周血淋巴细胞和脾脏淋巴细胞。SYBRgreen QPCR实验结果显示重组质粒pCD40L组小鼠脾脏IFN-γ mRNA水平显著增高,这说明CD40L能促进小鼠脾脏T细胞向Th1型细胞分化。在淋巴细胞增殖实验中,重组质粒pCD40L能促进小鼠脾脏淋巴细胞的增殖,说明它对于淋巴细胞的免疫功能具有一定的积极影响。当重组质粒pCD40L浓度为50μg/ml和75μg/ml时,它对外周血淋巴细胞的促分裂作用比低浓度的作用显著增高;当其浓度为100μg/ml时,外周血淋巴细胞增殖能力反而下降,这说明重组质粒pCD40L促外周血淋巴细胞分裂活性在一定的浓度范围内才发挥作用。在本研究中,重组质粒pCD40L刺激外周血淋巴细胞增殖的最佳浓度为75μg/ml。
在动物实验中,重组质粒pCD40L能够辅佐HSV-2 DNA疫苗刺激小鼠产生抗HSV-2的细胞免疫和体液免疫。在第2次免疫后第14天,pCD40L和HSV-2 DNA疫苗组可以诱导机体产生较高A值的IgG抗体,其A值是其他各组的2倍之多(P<0.05),诱导机体产生强烈的体液免疫。流式细胞仪检测结果显示,pCD40L和HSV-2 DNA疫苗组CD4+T细胞和分泌IFN-γ的Th1细胞百分率高于其他组(P<0.05);在小鼠脾脏T淋巴细胞增殖结果显示,pCD40L的特异性抗原和非特异性抗原的刺激指数都显著高于其他3组(P<0.05),以上结果均说明重组质粒pCD40L能够辅佐HSV-2 DNA疫苗刺激小鼠产生抗HSV-2的细胞免疫。此外,pCD40L和HSV-2 DNA疫苗组能刺激产生更高量的趋化因子RANTES。趋化因子RANTES是CD40L调节巨噬细胞和DC细胞表达产生。趋化因子RANTES的高表达,可募集未激活的CD4+记忆T细胞、刺激CD4+T和CD8+T的活化,参与不成熟DCs细胞的募集、促进Th1型细胞因子IFN-γ的产生,趋化炎症细胞到达炎症部位,发挥多种作用参与机体对病毒的免疫[13]。在动物保护性实验中,由于与本实验室曾经所用的病毒效价(LD50)不一样,实验结果不尽相同,但是都说明了HSV-2 DNA疫苗pgD质粒及其佐剂pCD40L质粒对感染单纯疱疹病毒后的小鼠的存活率有一定的提高。
总之,本研究构建的质粒pCD40L能够辅佐HSV-2 DNA疫苗刺激小鼠产生特异性的细胞免疫和体液免疫,特别是其在提高细胞免疫方面的能力,具有作为疫苗佐剂的潜力。在后续研究中,我们将围绕CD40L做进一步的探索,为研发HSV-2 的治疗性疫苗提供可靠的依据。
1 Vlahava VM, Eliopoulos AG, Sourvinos G.CD40 ligand exhibits a direct antiviral effect on herpes simplex virus type-1 infection via a PI3K-dependent, autophagy-independent mechanism[J].Cell Signal, 2015,27(6):1253-1263
2 洪艳,杨连华,陈勇,等.HSV-2DNA疫苗诱导小鼠免疫应答研究[J]. 浙江省医学科学院学报,2005,16(2):121-123
3 Volmar CH, Ait-Ghezala G, Frieling J,etal.CD40/CD40L interaction induces Abeta production and increases gamma-secretase activity independently of tumor necrosis factor recertor associated factor (TRAF) signaling[J].Exp cell Res, 2009, 315(13):2265-2274
4 Eliopoulos AG,Young LS.The role of the CD40 pathway in the pathogenesis and treatment of cancer[J]. Curr Opin Pharmacol, 2004, 4 (4):360-367
5 Léveillé C, Bouillon M, Guo W,etal.CD40 ligand binds to alpha5beta1 integrin and triggers cell signaling[J]. J Biol Chem, 2007, 282(8):5143-5151
6 Auten MW, Huang W, Dai G,etal.CD40 ligand enhances immunogenicity of vector-based vaccines in immunocompetent and CD4+T cell deficient individuals [J]. Vaccine, 2012,30(17):2768-27777 Parameswaran S, Khalil M, Ahmed KA,etal. Enhanced protective immunity derived from dendritic cells with phagocytosis of CD40 ligand transgene-engineered apoptotic tumor cells via increased dendritic cell maturation[J]. Tumori, 2015,Epub ahead of Print
8 钱莉,王骞,龚卫娟,等.小鼠CD40L基因的克隆与真核细胞表达研究[J]. 实用临床医药杂志,2007,11(6):1-4
9 Miller EA, Gopal R, Valdes V,etal. Soluble CD40 ligand contributes to dendritic cell-mediated T-cell dysfunction in HIV-1 infection[J]. AIDS,2015,29(11):1287-1296
10 Kwa S, Lai L, Gangadhara S,etal。 CD40L-adjuvanted DNA/MVA SIV239 vaccine enhances SIV-specific humoral and cellular immunity, and improves protection against a heterologous SIVE660 mucosal challenge[J]. J Virol, 2014, 88(17):9579-9589
11 Harcourt JL, Brown MP, Anderson LJ,etal. CD40 ligand(CD154) improves the durability of respiratory syncytial virus DNA vaccination in BALB/c mice[J].Vaccine, 2003, 20(21-22):2964-2979
12 Sin JI, Kim JJ, Zhang D, Weiner DB. Modulation of cellular responses by plasmid CD40L: CD40L plasmid vectors enhance antigen-specific helper T cell type 1 CD4+T cell-mediated protective immunity against herpes simplex virus type 2 in vivo[J]. Hum Gene Ther, 2001,12(9):1091-1102
13 Ma K, Xu W. Shao XN,etal. Coimmunization with RANTES plasmid polarized Thl immune response against hepatitis B virus envelope via recruitment of dendritic cells[J].Antiviral Research, 2007, 76(2): 140-149
(修回日期:2015-07-21)
Plasmid CD40L Enhances Immune Response of HSV-2 DNA Vaccine.
HuRuxi,TaoWei,FuTing,etal.
WenzhouMedicalUniversitySchoolofLaboratoryMedicineandLifeScience,Zhejiang325035,China
Objective To detect HSV-2-specific humoral immunological response and cellular immunological response in BALB/c mice which were induced by plasmid CD40L-adjuvanted HSV-2 DNA vaccine. Methods ①The murine CD40L gene transcript was inserted into the pcDNA3 vector to obtain the recombinant plasmid pcDNA3-Kan/CD40L. ②In vitro study: MTS colorimetric method was employed in the detection of the rat peripheral blood lymphocytes proliferation and SYBRgreen qPCR assay was used to test the IFN-γ secretion ability of spleen cells. ③In vivo study: Forty eight female BALB/c mice were randomly divided into four groups: pKan, pgD, pCD40L+pgD and pKan+pgD, and inoculated through intramuscular immunization at the weeks 0 and 3. After 6 weeks the protection given to the mice was assayed by a fatal dose of HSV-2. The humoral immunological response and the cellular immunological response were detected by enzyme linked immunosorbent assay (ELISA), MTS colorimetric assay and flow cytometry (FCM). Results ①The ability of stimulation lymphocytes proliferation of rat PBMC and IFN-γ level in spleen cells of cDNA3-Kan/CD40L group were significantly better than that of pK group (P<0.05).②The level of anti-HSV-2 IgG, RANTES, stimulation index (SI), CD4+and IFN-γ in pCD40L+pgD group were significantly higher than anther groups. Furthermore,mice of pCD40L+pgD group were prophylactically protected from challenge with a high dose of HSV-2. Conclusion ①The potential of pcDNA3-Kan/CD40L could be used as an adjuvant in vaccines.②The potential of pCD40L-adjuvantd HSV-2 DNA vaccine could induce systemic humoral immune responses and cellular immune responses intramuscular vaccinated mice.
CD40 ligand (CD40L); Herpes simplex virus type 2 (HSV-2); Vaccine adjuvant
浙江省自然科学基金资助项目(LY12H19009)
325035 温州医科大学检验医学院生命科学学院(胡如西、陈勇);310013 杭州,浙江省医学科学院(陶薇、傅婷、何卓晶、贾岚、洪艳)
洪艳,陈勇,电子信箱: hongy1008@163.com
R3
A DOI 10.11969/j.issn.1673-548X.2015.10.009
2015-07-07)
