SOCSs在慢加急性肝衰竭大鼠肝组织中的表达变化及意义
2015-06-13王柯尹杨乃彬倪顺兰谢新生卢明芹
王柯尹 杨乃彬 倪顺兰 谢新生 余 晓 卢明芹
SOCSs在慢加急性肝衰竭大鼠肝组织中的表达变化及意义
王柯尹 杨乃彬 倪顺兰 谢新生 余 晓 卢明芹
目的 探讨细胞因子信号转导抑制因子(suppressors of eytokine signaling,SOCSs)在慢加急性肝衰竭(acute on chronic liver failure,ACLF)大鼠肝组织中的表达及其在ACLF发生中的作用。方法 健康SD大鼠随机分组,ACLF组大鼠腹腔注射1.5ml/kg的50%四氯化碳花生油溶液,每3天1次,10次后改为2ml/kg,每3天1次,9次后给予250mg/kg D-氨基半乳糖(D-GalN)联合50μg/kg脂多糖(LPS)急性攻击,给药后0、6、12、24h 留取大鼠血及肝组织。血生化检测ALT、AST水平和ELISA法检测TNF-α、IL-6水平。HE染色下观察肝脏病理学变化。RT-PCR检测大鼠肝组织SOCS-1、SOCS-3mRNA表达。结果 大鼠慢加急性肝衰竭模型复制成功,ACLF组血清ALT和AST水平逐渐上升,在12h升高最明显,血清TNF-α、IL-6水平在造模后0h 即明显高于对照组,至6h达峰值(P<0.05),肝组织SOCS-1、SOCS-3mRNA水平于造模后0h开始升高,12h升高最为显著,之后逐渐下降,与正常对照组相比,各时间点差异有统计学意义(P<0.05)。结论 SOCSs在慢加急性肝衰竭过程中升高,其变化与TNF-α、IL-6改变相关,提示SOCSs可能参与慢加急性肝衰竭中的炎症及免疫调节过程。
慢加急性肝衰竭 细胞因子 细胞因子信号转导抑制因子
慢加急性肝衰竭(acute on chronic liver failure,ACLF)是在慢性肝病基础及急性损伤因素作用下出现的肝功能急剧恶化,表现为黄疸、腹腔积液、凝血功能障碍、肝性脑病等,预后差,病死率高[1]。其发病机制十分复杂,涉及感染、炎性反应、免疫损伤、器官衰竭等,其中TNF-α、IL-6等细胞因子在肝脏免疫和炎性反应中起重要作用,可直接参与引起肝细胞的坏死,加重肝衰竭病变过程[2]。研究发现,Janus激酶/信号转导因子和转录激活因子(janus kinase/sigal transduction and activators of transcription,JAK/STAT)通路是细胞因子发挥生物学效应的信号转导通路之一,参与机体炎性反应,免疫调节及细胞损伤、凋亡等过程[3]。SOCSs是一种细胞因子信号转导抑制因子,对JAK-STA途径进行负反馈抑制,在维持机体内稳态等起着重要作用,近年研究表明,SOCSs表达上调可能与肝细胞损伤炎性过程相关。本研究通过检测慢加急性肝衰竭大鼠各时间点肝组织SOCS-l、SOCS-3mRNA和血清TNF-α、IL-6表达的动态变化,探讨SOCSs在ACLF临床转归中的作用。
材料与方法
1.试验动物:清洁级SD大鼠30只,雄性,体重180~200g,由中国科学院上海实验动物中心提供。试验前1周领取动物,分笼饲养,自由进食、饮水,室温约23℃,间隔12h照明。
2.试剂:四氯化碳购自天津博迪股份有限公司;D-GalN购自南通通吕生物制品有限公司;LPS购自上海闪晶生物技术有限公司;RNA提取试剂、RT-PCR试剂盒由大连宝生物公司提供;TNF-α、IL-6试剂盒购自美国Genzyme公司。
3.方法:(1)动物模型建立与分组:清洁级雄性SD大鼠30只,实验前1日下午禁食,饮水不限,随机分为:慢加急性肝衰竭组(ACLF组,n=24): 腹腔注射1.5ml/kg的50%四氯化碳花生油溶液,每3天1次,注射10次后改为2ml/kg,每3天1次,共9次。D-GalN溶于无菌生理盐水,配成10%的溶液,用1mol/L的NaOH调节pH值至7.0,给予250mg/kg D-GaIN联合50μg/kg LPS急性攻击,分别于给药后0、6、12、24h 4个时间点处死大鼠,每次处死6只。正常对照组(n=6):腹腔注射同等剂量花生油。(2)取标本:以10%水合氯醛麻醉,采集大鼠门静脉血,离心10min后留取上清液,存放-80℃冰箱供检测使用。(3)肝组织病理检查:肝组织标本用100ml/L甲醛固定,逐级乙醇脱水,石蜡包埋,制备切片,经HE染色光镜下观察病理变化。(4)肝功能检测:采用全自动生化分析仪检测ALT、AST水平。(5)血清TNF-α、IL-6测定:按试剂盒说明书采用ElISA法检测。(6)RT-PCR法检测肝组织SOCS-1、SOCS-3mRNA表达:肝组织匀浆,Trizol法提取肝组织总RNA,用紫外线分光光度仪测定吸光度后计算样本A260/A280比值,介于1.8~2.0的用于反转录,取样本PCR产物5μl和溴酚蓝缓冲液1μl混匀,取标志物2.5μl作相对分子质量标准,进行琼脂糖凝胶稳压电泳(100V 27min),采用凝胶图像系统,用Gel-Pro3.1软件对电泳条带进行密度扫描,以SOCS-1、SOCS-3与β-actin吸光度比值作为目的基因mRNA的相对表达量,引物由上海捷瑞公司合成。SOCS-1 PCR反应条件:95℃ 5min,95℃ 30s,63℃ 30s,72℃ 17s,35个循环;4℃ 3min。内参β-actin PCR反应条件: 95℃ 5min,95℃ 30s,58.4℃ 30s,72℃ 6s,35个循环;4℃ 5min。SOCS-3 PCR反应条件:95℃ 5min,95℃ 30s,61℃ 30s,72℃ 27s,35个循环;4℃ 3min。内参β-actin PCR反应条件: 95℃ 5min,95℃ 30s,58.4℃ 30s,72℃ 6s,35个循环;4℃ 5min。序列见表1。
结 果
1. 一般情况:对照组大鼠反应灵敏,摄食饮水量多,模型组0h开始活动、进食减少,6h精神萎靡,动作迟缓,对刺激反应减弱,12h后逐渐出现呼吸气促、肢体发抖、口鼻出血。
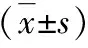
表1 PCR引物序列
2.血清学变化:ACLF组血清ALT和AST在造模后很快上升,12h达高峰,与正常对照组相比,差异有统计学意义(ALT:F=71.937,286.218,456.977,297.659,P<0.05;AST:F=68.050,195.495,440.675,664.438,P<0.05,表2)。ACLF组大鼠血清TNF-α、IL-6均在造模后0h即有所上升,至6h达峰值,之后逐渐下降,与对照组相比,差异有统计学意义(TNF-α:F=367.468,463.177,874.417,283.401,P<0.05;IL-6:F=757.885,803.649,698.713,477.883,(P<0.05),详见表2。
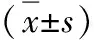
表2 各组大鼠血清ALT、AST、TNF-α、IL-6检测结果
与正常对照组比较,P<0.05
3.肝脏形态、病理学变化:正常对照组大鼠肝脏呈鲜红色,形态正常,表面光滑,病理显示肝小叶结构完整,未见肝细胞变性、坏死。实验组肝脏体积缩小,表明呈细颗粒或结节状,病理示显示纤维组织增生,同时存在坏死、凋亡及再生肝细胞,再生肝细胞排列紊乱,形成肝内假小叶,伴有肝细胞再生结节,存在炎性细胞浸润。6h时可见大量肝细胞坏死,炎性浸润及出血明显,肝窦或间质内见出血灶。12h后显示肝细胞大片坏死、凋亡,坏死区及汇管区有大量炎性细胞浸润,肝窦明显扩张充血,残存肝细胞可见水肿、嗜酸性变(图1)。
4.肝组织SOCS-1、SOCS-3mRNA表达:正常大鼠肝组织中存在少量SOCS-1、SOCS-3mRNA表达,ACLF组SOCS-1、SOCS-3mRNA表达均于造模后立即开始逐渐增加,12h达到高峰,24h开始下降,与正常对照组(0.718±0.102) 各时间点相比,差异有统计学意义(SOCS-1:F=28.734,80.533,409.701,220.445,P<0.05;SOCS-3:F=40.433,101.544,319.141,191.229,P<0.05,图2,表3)。

图1 大鼠肝组织HE染色(×200)A.正常对照组;B.ACLF组0h;C.ACLF组6h;D.ACLF组12h
讨 论
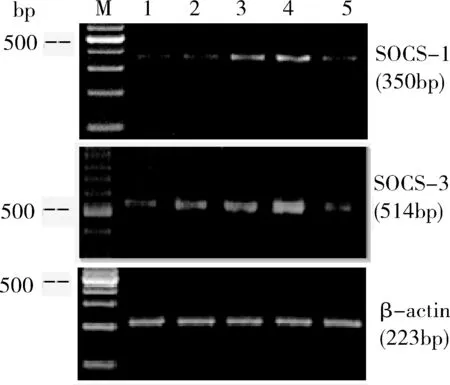
图2 RT-PCR法检测肝组织SOCS-1、SOCS-3 mRNA表达水平1.正常对照组;2.0h;3.6h;4.12h;5.24h;M.标志物;β-actin.β-肌动蛋白
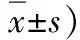
表3 各组肝组织SOCS-1、SOCS-3 mRNA表达(与β-actin灰度比值,
与正常对照组比较,*P<0.05
慢加急性肝衰竭是一种病因复杂、治疗困难的疾病,目前认为免疫系统过度激活介导局部炎性反应,诱发细胞因子的大量分泌是造成其病理损害的中心环节。肝衰竭时循环中高水平的内毒素可激活库普弗细胞释放TNF-α、IL-6等多种炎性介质, 细胞因子网络失衡,启动一系列级联反应,造成组织缺血缺氧甚至多器官衰竭。Mao等[4]发现ACLF患者肝内TNF-α表达较慢乙肝患者明显升高。Elsing等[5]在慢加急性肝衰竭中大鼠肝组织中检测到高浓度的TNF-α、IL-6浸润,提示TNF-α、IL-6等促炎因子可能导致肝细胞坏死或凋亡,抑制肝细胞再生,参与肝脏炎性损伤。本实验结果显示,慢加急性肝衰竭大鼠血清TNF-α、IL-6水平显著升高,提示TNF-α、IL-6等细胞因子可能通过引发多种化学介质释放,创建一个促炎性的周围环境,加重组织损伤,促进肝衰竭的发生、发展。
研究表明,当细胞因子作用于靶细胞表面受体,需要信号转导通路的活化,才能启动靶细胞发挥相应的生理效应,其中JAK/STAT信号转导途径是一条重要途径,它通过TNF-α与细胞膜上的INFAR-I绑定形成二聚体,激活细胞质中Jak-1和Tyk2,使STAT1和STAT2磷酸化,参与细胞凋亡、致炎因子信号转导及调控等多种生物学过程[6,7]。SOCS-1、SOCS-3属于SOCS家族,目前已经被认为是强有力的细胞因子信号转导抑制因子,可介导SH2和KIR功能区与JAKs直接结合抑制其酪氨酸激酶活性,对JAK/STAT信号通路进行负调控[8,9]。有报道显示SOCS蛋白参与T细胞的分化和调控,在天然免疫和获得性免疫中扮演重要角色,与炎症和免疫反应密切相关[10]。研究证实,JAK/STAT信号通路在肝脏炎性反应中发挥着重要作用,TNF-α、IL-6等细胞因子可有效刺激STAT活化,诱导目的基因表达[11~13]。另一方面,SOCSs可对STAT信号进行负调控,抑制上述细胞因子的信号转导过程,推测SOCSs参与了对肝细胞炎性反应的特异性调控,与慢加急性肝衰竭的发生、发展之间存在着某些联系,但具体联系到目前为止尚不十分明确[14]。
本实验结果显示,ACLF组大鼠血清血清TNF-α、IL-6水平在造模后0h开始升高,6h达高峰,与对照组比较差异有统计学意义(P<0.05),ACLF组SOCS-1、SOCS-3 mRNA于造模后即高于对照组,12h达峰值,之后逐渐下降,与对照组比较差异有统计学意义(P<0.05),这提示SOCSsmRNA的表达水平随着肝脏损伤程度加重而增加,肝损害越明显,SOCSs表达越多,但略晚于TNF-α、IL-6表达,考虑发生肝衰竭时,大量肝细胞损伤,TNF-α、IL-6等炎性因子释放,与相应的受体结合导致JAKs 的激活,激活的JAKs将受体上特定的酪氨酸残基磷酸化,诱导STATs活化,进一步刺激SOCSs mRNA表达上调。笔者的研究结果显示,造模12h后肝组织TNF-α和IL-6表达水平下降,可能与SOCSs 通过阻止访问信号传感器、抑制STAT受体结合位点转录等方式对细胞内信号转导途径进行负反馈环调节有关[15]。据此推测,在慢加急性肝衰竭发生、发展中,SOCSs表达水平的改变与TNF-α、IL-6等细胞因子的变化密切相关,影响慢加急性肝衰竭整个病理生理过程,但目前国内外关于SOCSs在慢加急性肝衰竭发病机制中的影响报道较少,因此,仍有待于通过更深一步研究两者之间的具体关系,从而减轻甚至阻止各种因素对肝脏造成的破坏,为发现慢加急性肝衰竭治疗手段开拓新的领域。
1 Sarin SK,Kumar A,Almeida JA,etal. Acute-on-chronic liver failure:consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL) [J]. Hepatol Int,2009,3(1): 269-282
2 Jalan R,Gines P,Olson JC,etal.Acute-on chronic liver failure[J]. Hepatol,2012,57(6):1336-1348
3 Harrison DA.The JAK/STAT pathway[J].Cold Spring Harb Perspect Biol,2012,4(3):1-3
4 Mao W L,Chen Y,Chen YM,etal.Changes ofserum cytokine levels in patients with acute on chro-nic liver failure treated by plasma exchange[J].J Clin Gastroenterol,2011,45(6):551-555
5 Elsing C,Harenberg S,Stremmel W,etal.Serum levels of soluble Fas,nitric oxide and cytokines in acute decompensated cirrhotic hepatic patients[J]. World J Gastroenterol,2007,13(3):421-425
6 Pan J,Ju J.Current perspectives on the JAK/STAT signa-ling pathway and its activating factors in liver fibrosis[J].J Clin Hepatol,2013,29 (5):393-396
7 Radaeva S,Jaruga B,Hong F,etal. Interferon-alpha activates multiple STAT signals and down-regulates c-Met in primary human hepatocytes[J].Gastroenterology,2002,122(4):1020-1034
8 Giordanetto F,Kroemer RT.A three-dimensional modle of supperessor of cytokine signalling -1(SOCS-1)[J].Prptein Eng,2003,16(2):115-124
9 Qiu X,Guo G, Chen K,etal. A requirement for SOCS-1 and SOCS-3 phosphorylation in Bcr-Abl-induced tumorigenesis[J]. Neoplasia,2012,14(6):547-558
10 Tamiya T,Kashiwagi I.Suppressom of cytokine signaling(SOCS)proteins and JAK/STAT pathways:regulation of T cell inflammation by SOCS1 and SOCS3[J].Arterioscler Thromb Vase Biol,2011,31(5):980-985
11 Kamiya A,Kinoshita T, Ito Y,etal. Fetal liver development requires a paracrine action of oncostatin M through the gp130 signal transducer[J]. EMBO J,1999,18(8):2127-2136
12 Dill MT,Makowska Z,Trincucci G,etal.Pegylated IFN-α regulates hepatic gene expression through transient Jak/STAT activation[J]. J Clin Invest,2014,124(4):1568-1581
13 Cressman DE,DeAngelis RA,Ciliberto G,etal. Liver failure and defective hepatocyte regeneration in interleukin-6- deficient mice[J]. Science,1996,274(5291):1379-1383
14 Hong F,Jaruga B,Kim WH,etal.Opposing roles of STAT1 and STAT3 in T cell-mediated hepatitis: regulation by SOCS[J]. J Clin Invest, 2002,110(10):1503-1513
15 Krebs DL,Hilton DJ.SOCS proteins: negative regulators of cytokine signaling[J].Stem Cells, 2001,19(5):378-387
(修回日期:2015-02-12)
Expression of SOCSs in Rats with Acute-on-chronic Liver Failure and Its Significance.
WangKeyin,YangNaibin,NiShunlan,etal.
DepartmentofInfectionDisease,TheFirstHospitalofJiaxing,Zhejiang314000,China
Objective To investigate the expression of SOCSs in liver tissues of rats with acute on chronic liver failure(ACLF) and the function of SOCSs in ACLF. Methods The SD male rats were randomly divided into two groups. Rats in ACLF group were intraperitoneally injected with: 1.5ml/kg of 50% carbon tetrachloride peanut oil solution, every 3 days for the first month; 2ml/kg of 50% carbon tetrachloride peanut oil solution, every 3 days for another two months; then 250mg/kg D-GalN and 50μg/kg LPS at once. Rats in normal group were intraperitoneally injected with 0.9% NaCl solution. Liver tissue and blood were collected on 0,6,12,24hours after the final injection. The level of ALT、AST were detected by automatic biochemical analyzer and TNF-α,IL-6 were determined by ELISA. The liver pathologic changes were observed with HE staining by microscope. SOCS-1,SOCS-3mRNA of liver tissues were determined by RT-PCR. Results ACLF model of rats were successfully built. The level of ALT and AST in model group peaked at 12 hours. The level of TNF-α,IL-6 were obviously higher than those in control group and peaked at 6h(P<0.05). SOCS-1,SOCS-3mRNA began to rise after modeling,peaked at 12h and decreased gradually. Compared with the normal group, difference in all time point were statistically significant(P<0.05). Conclusion The level of SOCSs in ACLF group were upregulated and the upregulation was associated with IFN-α,IL-6, suggesting that SOCSs may participate in the process of inflammation and immune regulation in ACLF.
Acute-on-chronic liver failure;Cytokines;Suppressors of cytokine signalings
314000 嘉兴市第一医院感染科(王柯尹、谢新生、余晓);325000 温州医科大学附属第一医院感染科(杨乃彬、倪顺兰、卢明芹)
卢明芹,电子信箱:LMQ0906@163.com
R575
A DOI 10.11969/j.issn.1673-548X.2015.10.030
2015-01-21)
