RRM1蛋白表达与体外药敏实验检测对指导非小细胞肺癌化疗的价值
2015-06-12黄娟刘浩邓冲
黄 娟 刘 浩 邓 冲
·短篇论著·
RRM1蛋白表达与体外药敏实验检测对指导非小细胞肺癌化疗的价值
黄 娟1刘 浩2邓 冲3
肺癌,非小细胞; 核苷酸还原酶亚单位MI; 吉西他滨; 药敏实验; 个体化治疗
非小细胞肺癌(non-small cell lung cancer, NSCLC)是目前威胁人类健康与生命最大的恶性肿瘤之一。即使可切除的NSCLC患者5年生存率仍令人失望,改善术后NSCLC患者局部控制率及远期生存率一直是临床关注的焦点,个体化化疗是21世纪胸外科临床发展的方向和理想治疗模式[1]。本研究采用免疫组织化学检测40例NSCLC患者手术切除的新鲜组织标本中核苷酸还原酶M1亚基(ribonucleotide reductase subunit M1, RRM1)蛋白表达水平,同时进行体外原代培养,MTT药敏试验,检测临床常用非小细胞肺癌一线化疗药物吉西他滨(Gemcitabine)的敏感性,比较分析RRM1表达与吉西他滨耐药的相关性。旨在探讨其在NSCLC个体化治疗中疗效的意义,为敏感药物的选择提供参考。
材料与方法
一、 实验材料
1. 肺癌细胞: 收集2012年3月至2013年9月我科NSCLC患者手术切除的新鲜组织标本40例。患者年龄38~68岁,平均年龄53岁,其中,男29例,女11例,均为Ⅰ-ⅢA期,肺腺癌23例、肺鳞癌15例,大细胞癌2例。
2. 化疗药物: 吉西他滨规格为200 mg/支,产地江苏豪森药业,试验药物浓度按文献[1]配制,用无菌生理盐水配成母液,按照实验药物浓度的0.5倍、1.0倍、2倍的剂量进行配制,保存于-20 ℃。
3. 主要试剂: RRM1多克隆抗体(美国PROTEINTECH公司);免疫组化(SP)试剂盒(美国DACO公司);DAB显色试剂盒(美国DACO公司);RPMI-1640(美国Gibco公司);胰蛋白酶(美国Amresco公司);淋巴细胞分离液:(天津市秀鹏生物技术开发有限公司);小牛血清:(杭州四季青生物工程材料有限公司);MTT(四甲基氮唑蓝):(美国Amresco公司);DMSO: 二甲基亚砜。
4. 实验仪器: 分析纯(美国Sigma公司);离心机(Anke TGL-16B, 上海安亭科学仪器厂);超低温冰箱(Revco Value Series, thermo fisher scientific LLC);电子天平(AUY220, SHMADZU);CO2培养箱(HARRIS-301T, HARRIS);倒置光学显微镜(南京江南永新光学有限公司);96孔细胞培养板(Costar公司);酶联免疫检测仪((Freedom Evolyzer-2,TeCan);电子恒温三用水箱(达佳,广东省汕头市医用设备厂有限公司);蠕动泵(MILLPORE公司);微量振荡器(MH-1型,江苏海门市其林贝尔仪器制造有限公司)
二、研究方法
1. MTT法吉西他滨体外药敏检测: 单细胞悬液按文献[1]制备,取手术切除的新鲜癌组织约1.0 cm3大小,选取无坏死部分,立即浸入无菌培养瓶中,10 min内转运至实验室。在超净台上,用无菌PBS液冲洗2次,切除组织包膜,结缔组织与坏死组织,剪成尽可能小的组织碎块,大小约1 mm3。将组织小块置于0.25%胰酶40 ml中,装入培养瓶,置于37 ℃水浴箱中30 min,并不时摇动,使其充分消化,期间在镜下观察,当细胞变圆接近脱壁时,弃消化液,用10 ml完全-1640终止消化。用200目筛网将消化后的细胞悬液过滤收集,用无菌PBS液洗涤2次(离心半径 8 cm,1500 r/min,离心 20 min),悬于20 ml完全-1640中,镜下观察细胞。于无菌离心管中依次轻轻加入100%及60%的淋巴细胞分离液各10 ml,其上再沿管壁轻轻加入细胞悬液(离心半径 8 cm,2000 r/min,离心20 min),收集60%分离液界面上的细胞,加5倍无菌PBS液(离心半径 8 cm,2000 r/min,离心20 min),去上清,加15ml无菌PBS液,离心前进行细胞计数,再次离心,(离心半径 8 cm 2000 r/min,离心20 min)去上清,调整细胞浓度为(1×105~2×105/ml)。种96孔板,分别设加药孔,阴性对照孔,空白孔,并设3复孔。在7 ℃、5%CO2培养箱中培养24 h后,加药孔加入吉西他滨,阴性对照孔与空白孔均加完全-1640,继续培养48 h,MTT法进行药敏检测,参照《细胞培养》[2]计算活性抑制率,当加药组血浆高峰浓度水平时的抑制率大于50%时,即为高敏,小于30%为耐药,介于2者之间为中敏。
2. SP法RRM1蛋白表达水平检测: 手术切除的新鲜组织标本40例,用10%中性福尔马林固定,石蜡包埋,链霉素抗生物素蛋白-过氧化物酶连接法(SP 法)进行免疫组化检测其RRM1蛋白,实验步骤按SP试剂盒说明书进行。
三、统计学方法
采用SPSS13.0软件对数据进行χ2检验,组间比较用四格表的确切概率法,P<0.05为差异有统计学意义。
结 果
40例新鲜组织标本体外药敏实验对吉西他滨敏感者22例,耐药18例。40例石蜡包埋标本RRM1高表达17例,低表达23例。17例RRM1高表达组,对吉西他滨敏感7例,敏感率41.2%,而23例RRM1低表达组,对吉西他滨敏感17例,敏感率73.9%,见表1。对同时满足RRM1低表达组中MTT药敏提示对吉西他滨敏感者选用GP(顺铂+吉西它滨)方案化疗4个疗程,其余选用可接受的二线方案(顺铂+多西他赛)化疗4个疗程。对照组40例以国际公认标准方案或经验用药为主,包括顺铂+长春瑞滨,顺铂+紫杉醇,顺铂+长春花碱,顺铂+吉西它滨,顺铂+多西他赛等化疗方案。随访6个月~2年,实验组与对照组完全缓解(CR)+部分缓解(PR)即有效率分别为44.5%和42.4%、疾病稳定(SD)分别为32.5%和28.1%、疾病进展(PD)分别为25.3%和28.5%,差异均无统计学意义。而中位生存时间(MST)分别为19.3个月和14.8个月(P<0.05),中位无进展生存(PFS)为6.7个月和6.5个月(P>0.05),见表2。
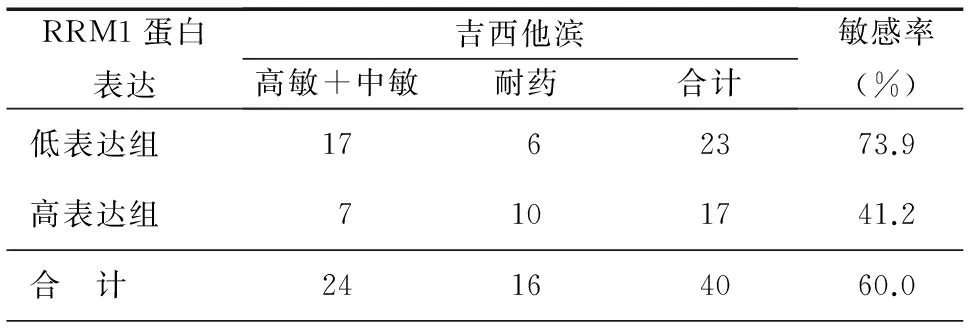
表1 RRM1蛋白表达与吉西他滨体外药敏实验的相关性

表2 两组化疗效果比较
注:CR:完全缓解;PR:部分缓解;SD:疾病稳定;PD:部分缓解;MST:中位生存时间;PFS:中位无进展生存
讨 论
肺癌是目前最常见的恶性肿瘤之一,恶性程度很高,其发病率及病死率均居首位[2]。其中80%的肺癌是NSCLC,手术已成为早期NSCLC的标准治疗。但约1/3甚至近1/2的NSCLC就诊时已属晚期,可手术切除的患者5年生存率仅为30%~40%[3],故化疗在术后局部控制及提高远期生存方面起着重要作用。但选择对NSCLC有效的化疗药物,一直是临床肿瘤化疗关注的问题。
针对NSCLC术后化疗药物的选择,国内外多采用耐药蛋白的测定,药敏实验或经验用药等提高疗效,但术后10%~15%的患者经历复发,15%~60%的患者发生远处转移[4]。究其原因,NSCLC不同患者对同一种化疗药物敏感性可能不同,并与肺癌细胞的生物学特性、患者个体差异、化疗药物的毒性反应等多因素相关。目前,各级医院采用同一个化疗方案治疗不同的NSCLC患者,带有一定的盲目性。患者因病理类型及个体差异的原因对化疗药物的敏感性有较大差异,因此越来越多的耐药蛋白的检测以及不同的体外药敏试验方法应用于临床,作为选择敏感化疗方案,实行个体化治疗的手段。
吉西他滨作为NSCLC化疗的一线药物,具有一定优势得到普遍认可[5-6]。但耐药的发生减弱了吉西他滨在NSCLC治疗中的疗效。RRM1是核苷酸还原酶(ribonucleotide reductase, RR)的一个亚单位,RR使核糖核酸转变成的脱氧核苷酸是DNA合成和修复所必需的物质。RRMl定位于染色体11ql5.5区域,以上特性决定了 RRMl可能与NSCSL患者的化疗耐药与预后相关[7-8]。Rosell等[9]研究认为RRMl是吉西他滨的分子作用靶点,多项研究显示吉西他滨耐药与RRM1蛋白表达相关,但临床治疗NSCLC可选择的药物有很多种,进行单一生物学标志物RRM1的检测其预测能力是不足的。故本实验加入了更精细的细胞培养技术与体外药敏试验技术相结合的方法进行联合检测,期望达到更精确的个体化治疗[10-16]。
我们将80例患者随机分为2组,患者均在自愿接受不同治疗方案前签署知情同意书,我们用免疫组织化学方法检测40例NSCLC手术切除的新鲜组织标本的核苷酸还原酶M1亚基(RRM1)蛋白表达水平,RRM1低表达23例,同时对新鲜肿瘤组织进行体外原代培养,并作了MTT药敏试验,其中17例对吉西他滨敏感,RRM1高表达17例,其中7例对吉西他滨敏感,差异具有统计学意义。结果显示RRM1低表达多数对吉西他滨敏感,RRM1高表达多数对吉西他滨耐药,针对低表达组中对吉西他滨敏感的患者我们选用标准一线化疗方案吉西他滨+顺铂,而其余患者选用二线方案多西他赛+顺铂。另外40例对照患者在经验用药方案下接受治疗,结果显示实验组有效率分为44.5%,对照组为42.4%、实验组SD为32.5%,对照组为28.1%、实验组PD为25.3%,对照组PD为28.5%,实验组PFS为6.7个月,对照组为6.5个月,4组数据进行统计学分析,差异均无统计学意义,而实验组MST为19.3个月,对照组为14.8个月,P<0.05。表明将RRM1蛋白的表达与吉西他滨体外药敏实验相结合的治疗方法可使患者获得更长的生存期。
本研究结果显示:将RRM1蛋白表达与吉西他滨体外药敏实验相结合,可作为NSCLC个体化治疗的选择之一。将该方法应用于临床,建立肺癌药敏检测系统,可使患者获得更长的生存期,在肺癌的综合治疗中具有一定的临床实用价值。本研究中涉及的免疫组化方法,肺癌细胞原代培养及MTT试验均为常见试验技术,该方法重复性好、操作简便、利于推广。
但本研究也有不足之处:试验病例较少,前述结论需在以后的病例收集中进一步验证。实验组选用多西他赛+顺铂方案未做耐药蛋白检测及体外药敏试验,部分患者也可能耐药。该方法中的难点在于肺癌细胞的原代培养,尤其是满足药敏试验的肺癌细胞数是关键,若要推广还需进一步简化试验流程,才能使该方法更加成熟。
1 刘 浩, 洪志鹏, 尹小川, 等. 人非小细胞肺癌细胞的原代培养及个体化药敏实验研究[J/CD]. 中华肺部疾病杂志:电子版, 2011, 4(2): 94-97.
2 Alberg AJ, Ford JG, Samet JM, et al. Epidemiology of lung cancer:ACCP evidence-based clinical practice guidelines(2nd edition)[J]. Chest, 2007, 132(3 suppl): 29S-55S.
3 Jemal A, Siegel R, Xu J, et al. Cancer Statistic, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
4 Roth JA, Cox JD, Hong WK. 主编. 张兰军, 张 力, 龙 浩, 等主译. 肺癌[M]. 第3版. 北京:世界图书出版公司, 2011: 222.
5 Le Chevalier T, Scagliotti G, Natale R, et al. Efficacy of gemcitabine plus platinum chemotherapy compared with other platinum containing regimens in advanced non-small cell lung cancer:a meta-analysis of survival outcomes[J]. Lung Cancer, 2005, 47(1): 69-80.
6 Grossi F, Aita M, Dcffcrrari C, et al. Impact of third-generation drugs on the activity of first-line chemotherapy in advanced non-small cell lung cancer:a meta-analytical approach[J]. Oncologist, 2009, 14(5):497-510.
7 Torrents E, Aloy P, Gibert I, et al. Ribonucleotide reductases:diverngeng evolution of an ancient enzyme[J]. J Mol Evol, 2002, 55(2): 138-152.
8 Bepler G. Using translational research to tailor the use of chemotherapy in the treatment of NSCLC[J]. Lung Cancer, 2005, 50(Suppl 1): S13-14.
9 Rosell R, Cobo M, Isla D, et al. Pharmacogenomics and gemcitabine [J]. Ann Oncol, 2006, 17(s5): v13-16.
10 Goan YG, Zhou B, Hu E, et al. Overexpression of ribonucleotide reductase as a mechanism of resistance to 2, 2-difluorodeoxy-cytidine in the human KB cancer cell line[J]. Cancer Res, 1999, 59(17): 4204.
11 Dumontet C, Fabianowska-Majewsda K, Mantincic D, et al. Common resistance mechanisms to deoxynucleoside analogues in variants of the human erythroleuk- aemic line K562[J]. Br J Haematol, 1999, 106(1): 78.
12 Davidson JD, M aL, Flagela M, et al. An increase in the expression ofribonucleo-tide reductase large subunit1 is associated with gemcitabine resistance in non-small cell lung cancer cell lines[J]. Cancer Res, 2004, 64(11): 3761.
13 Boukovinas I, Papadaki C, Mendez P, et al. Tumor RRCA1, RRMl and RRM2 mRNA expression levels and clinical response to first-line gemcitabine plus docetaxel in non-small-cell lung cancer patients[J]. PLoS One, 2008, 3(11): e3695.
14 Simon G, Sharma A, Li X, et al. Feasibility and efficacy of molecular analysis-directed individualized therapy in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2007, 25(19): 2741-2746.
15 Bepler G, Sharma H, Greenherg A, at al. Prospective evaluation of RRMl as a predictor of response to gemcitabine/carboplatin in non-small cell lung cancer[J]. J Clin OncoL, 2006, 24(18s Partl):377s.
16 Bepler G, Kusmartseva I, Sharma S, et al. RRM1 modulated in vitro and in vivo efficacy of Gemcitabine and Platinum in non-small-cell lung cancer[J]. J Clin Oncol, 2006, 24(29): 4731-4737.
(本文编辑:黄红稷)
黄 娟,刘 浩,邓 冲. RRM1蛋白表达与体外药敏实验检测对指导非小细胞肺癌化疗的价值[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(1): 76-78.
·医学动态·
科学家最新发现:注射细菌杀灭癌细胞
近日,在好莱坞举办的年度临床介入肿瘤学研讨会上,来自Anderson癌症研究中心的研究人员通过研究揭示了,利用细菌或许可以帮助治疗癌症。研究人员将一种名为诺维氏芽孢杆菌-NT(Clostridium novyi-NT)的细菌的孢子注射入6位病人机体的肿瘤中,随后细菌就可以在肿瘤中生长并且杀灭癌细胞。
在将诺维氏芽孢杆菌-NT注射入癌症病人机体之前,研究人员首先通过移除该细菌的危险毒素来降低细菌的危险性;研究结果显示6位病人均存活下来了,但其中有一位病人在细菌注射后因一些非相关的原因发生了死亡。研究者Ravi Murthy表示,当肿瘤生长达到一定尺寸后,其中一部分肿瘤组织就不再需要氧气了,其就会对常规的癌症疗法产生耐受性,比如对放疗和化疗产生耐受等;而诺维氏芽孢杆菌-NT则可以在无氧状态下生存从而在不影响正常组织的情况下破坏肿瘤细胞,同时该细菌也会诱发机体对癌症产生免疫反应。
从本质上来讲,诺维氏芽孢杆菌-NT在肿瘤组织中可以引发潜在的杀灭癌细胞的感染过程,本文研究对于后期开发新型的抗癌疗法提供了新的研究思路和依据。
10.3877/cma.j.issn.1674-6902.2015.01.020
四川省泸州市科技局基金资助(2012-177)
646000 四川,泸州医学院附属医院病理科1646000 四川,泸州医学院附属中医医院胸外科2、 中心实验室3
刘 浩, Email: liuhaoer@sina.com
R563,R734.2
B
2014-06-22)
