吉非替尼敏感性不同的非小细胞肺癌中miRNA-7表达的差异及临床意义
2015-06-12刘思文曹海霞吴建中井昶雯冯继锋
刘思文, 曹海霞, 吴建中, 马 蓉, 井昶雯, 王 卓, 冯继锋
论 著
吉非替尼敏感性不同的非小细胞肺癌中miRNA-7表达的差异及临床意义
刘思文, 曹海霞, 吴建中, 马 蓉, 井昶雯, 王 卓, 冯继锋
目的 检测吉非替尼敏感性不同的非小细胞肺癌中miR-7的表达差异,并探讨其临床意义。方法 采用吉非替尼(Gefitinib)药物大剂量冲击法诱导H827,建立耐吉非替尼肺癌细胞亚系H827-7/GR,有限稀释法将H827-7/GR细胞单克隆化,CCK-8法检测耐药前后细胞株及各单克隆细胞对吉非替尼的敏感性;RT-PCR方法检测H827、H827-7/GR和耐药单克隆细胞株以及其他对吉非替尼敏感性不同的肺癌细胞株A549、H358、H1299、H1650和H1975中miR-7的表达差异。结果 H827/GR耐药指数大于100;获得的6株耐药单克隆细胞株对吉非替尼的半生长抑制浓度(the half growth inhibition concentration, IC50)值不同;和吉非替尼敏感株H827相比,诱导的耐药细胞株H827/GR、耐药单克隆细胞株和吉非替尼耐药株A549、H358、H1299、H1650和H1975中miR-7的相对表达水平均降低(P<0.05)。结论 在非小细胞肺癌中,耐药细胞中miR-7的相对表达水平均较敏感细胞系降低,提示miR-7的低表达可能与非小细胞肺癌耐药性相关,其可能是潜在的肺癌药物敏感性预测分子标志物。
吉非替尼; 敏感性; microRNA-7; 非小细胞肺癌
肺癌是全球死亡率最高的恶性肿瘤之一,在女性癌症死因中肺癌占26%,男性癌症死因中占28%[1]。其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占所有肺癌的80%以上,肺腺癌又是NSCLC的主要病理类型。近年来以表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)为代表的靶向药物已作为晚期NSCLC患者(存在EGFR敏感突变)的一线治疗药物,但大部分治疗有效的肺癌患者1年左右会出现EGFR-TKI继发耐药。
微小RNAs(microRNAs, miRNAs)是一类长度为20~24个核苷酸的小的单链的非编码调控RNA,通过识别特定的靶mRNA,导致mRNA的降解和(或)翻译抑制,从而发挥负调控基因表达的作用,其不仅参与细胞增殖、分化、代谢及凋亡等一系列重要生物学进程[2],而且miRNA还可以通过调节关键的癌基因或抑癌基因参与肿瘤的发生、发展,甚至对肿瘤的化疗耐药也具有调控作用。本研究用实时荧光定量PCR技术检测NSCLC细胞株H827、H827/GR和耐药单克隆细胞株以及其他对EGFR-TKI敏感性不同的肺癌细胞株A549、H358、H1299、H1650和H1975中miR-7的表达差异。
1 材料与方法
1.1 主要材料和试剂
人肺腺癌细胞系购自中国科学院上海生命科学研究院细胞资源中心;细胞培养基购自Gibco;胰蛋白酶购自凯基科技生物发展有限公司;吉非替尼(粉剂)购自阿斯利康公司;CCK-8购自日本同仁;高速冷冻离心机; NanoDropND-1000紫外分光度计(NanoDrop);7300Real-time PCR System(Applied Biosystems公司)、9700 Thermocycler反应仪;Recover All Total Nucleic Acid Isolation Kit(Applied Biosystems公司);has-miRNA-7-5p引物、内参RNU6B引物(RiboBio公司);Real-time逆转录试剂盒( RR037A)(TakaRa公司);SYBR®Select Master Mix试剂盒(Applied Biosystems公司)。
1.2 方法
1.2.1 耐药细胞株的建立 H827细胞株置于含10%胎牛血清(Gibco)、100U/ml青霉素和100U/ml链霉素的RPMI-1640培养基中培养,0.25%胰蛋白酶消化传代,取对数生长期的细胞进行实验。采用大剂量间断冲击法[3](吉非替尼浓度为0.08~0.2 uM)诱导建立人NSCLC吉非替尼耐药细胞株,5个月后,细胞可在含10-7uM吉非替尼的培养液中稳定生长增殖,将该细胞亚系命名为H827-7/GR。实验前2周撤去药物,以正常的RPMI-1640培养液培养,用于实验以及后续的检测。
1.2.2 单克隆细胞株的建立与鉴定 有限稀释法筛选出耐药细胞HCC827-7/GR单克隆细胞株,稳定传2代后收集单克隆细胞株的DNA,命名为H827-7-n(n为细胞先后克隆出的序号),基因测序法检测各单克隆细胞株有无继发基因突变,扩增细胞并冻存各单克隆细胞株。
1.2.3 CCK8法检测药物对耐药细胞单克隆细胞株增殖抑制率 取生长良好的对数期细胞按5 000个/孔接种于96孔板:单药吉非替尼组终浓度分别是20 μM、10 μM、5 μM、2.5 μM、1.25 μM,一组空白对照,每组设3个平行孔。培养48h后,按照CCK-8试剂盒说明书操作,计算半生长抑制浓度值(the half growth inhibition concentration, IC50)及耐药指数(RI=耐药细胞株的IC50/敏感细胞株的IC50)。以上实验重复3次。
1.2.4 Real time-PCR检测各肺癌细胞株miR-7表达变化 取各细胞株对数生长期的细胞消化,制备单细胞悬液,接种于6孔板中(2 ml/孔),贴壁后更换培养液,培养48 h后收集贴壁细胞,Trizol试剂提取细胞总RNA,将RNA逆转录合成cDNA;RNU6B为内参基因,以cDNA作为模板进行SYBR-Green实时荧光定量PCR检测,反应体系:SYBR®Green Realtime PCR Master Mix 10 μl,上游引物(5 μM)0.8 μl,下游引物(5 μM)0.8 μl, cDNA 2 μl,加DEPC水至20 μl。将反应管置7300 Real-time PCR反应仪(Applied Biosystem)中,反应条件为95℃预变性10min后,按下述条件扩增40个循环:95 ℃ 15 s, 60 ℃ 1 min。实验重复3次。数据采用 2-△△Ct法进行分析,制作标准曲线。以上实验重复3次。
1.3 统计学方法
2 结果
2.1 耐药细胞株的诱导与鉴定,单克隆细胞株的建立与鉴定
大剂量间断冲击法诱导建立耐药细胞株H827-7GR,有限稀释法筛选出6株H827-7GR耐药单克隆细胞株,根据挑出的时间先后分别命名为H827-7-1、H827-7-2、H827-7-3、H827-7-4、H827-7-6、H827-7-7,且均无继发型基因突变。
2.2 CCK8法检测药物耐药细胞单克隆细胞株增殖抑制率
H827对吉非替尼48 h IC50值为(0.308±0.03) μM,肺癌A549、H358、H1299、H1650和H1975均为吉非替尼耐药株。不同浓度(1.25 μM、2.5 μM、5 μM、10 μM、20 μM)的吉非替尼分别处理耐药细胞株H827-7及各单克隆细胞株48h后,细胞存活率均降低,其中H827-7/GR耐药指数(RI)大于100,各单克隆细胞株对吉非替尼的IC50值不同,除H827-7-3为(6.396 ± 0.33)μM外,其余克隆株均大于10 μM(见表1、图1)。
2.3 吉非替尼敏感性不同的细胞间miR-7的表达差异
经qRT-PCR检测,设定miR-7在吉非替尼敏感细胞株H827中的表达水平为1,结果发现,对吉非替尼原发耐药的肺癌细胞(A549、H358、H1299、H1650和H1975)之间,miR-7的表达有差异,均较H827细胞降低,差异有统计学意义(A549、H358、H1650vsH827,P<0.05; H1299、H1975vsH827,P<0.01)(图2);吉非替尼继发耐药细胞及其单克隆细胞间miR-7的表达较吉非替尼敏感细胞H827降低,差异有统计学意义(vsH827,P<0.05)(图3)。
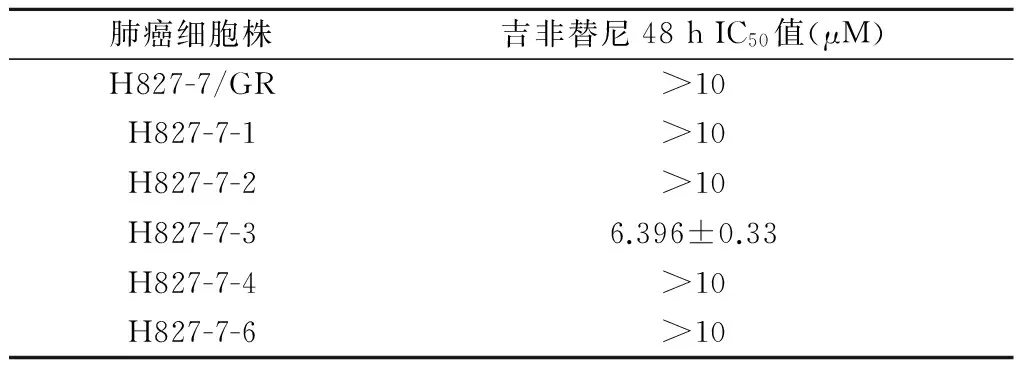
表1 肺腺癌耐药细胞株H827-7/GR及其单克隆细胞株对吉非替尼的IC50值
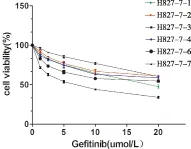
图1 各单克隆细胞株对吉非替尼的敏感性
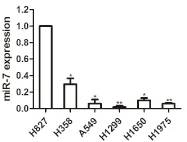
图2 MiR-7在吉非替尼原发耐药与继发耐药细胞株中的表达量,vsH827,*P<0.05,**P<0.01。

图3 MiR-7在吉非替尼继发耐药及其单克隆细胞中的表达量,vsH827,*P<0.05,**P<0.01。
3 讨论
肺癌是全球最常见的恶性肿瘤之一,每年因肺癌死亡人数达560 000,其中一半来自中国[6]。因起病隐匿,早期症状不明显,多数肺癌患者确诊时已达晚期,错过了最佳手术治疗机会。近年来,随着治疗方案的不断优化,尤以靶向药物的应用使得肺癌的治疗向前迈进了一大步。然而在用药过程中出现吉非替尼继发性耐药使得肺癌治疗再次陷入困境。在临床肿瘤治疗中,绝大多数是属于获得性耐药,即起初对治疗敏感,但用药治疗几周期后,肿瘤开始对药物耐受并出现复发或转移现象。采用大剂量药物间断冲击法诱导产生的耐药细胞株,与临床肿瘤患者出现耐药的机制相似,故本研究采用此方法,历时5个月,成功诱导建立人非小细胞肺癌吉非替尼耐药细胞系H827-7/GR,通过CCK-8法证实该耐药细胞系的耐药指数大于100。
miRNAs是一类内源性的非编码单链小分子RNA,广泛存在于真核生物中。它的生物合成需要复杂的蛋白系统,包括Argonaute 家族成员、RNA 聚合酶Ⅱ以及属于RNA聚合酶Ⅲ家族的Drosha和Dicer。在细胞核内,长链pri-miRNA在Drosha/DGCR8作用下剪去7-甲基鸟苷酸帽及多聚(A)尾,形成约70个核苷酸长度的发夹结构miRNA前体(pre-miRNA)[7],后者转运至细胞质内,Dicer/TRBP特异性PZA域识别Drosha剪切产物末端,在此将pre-miRNA剪切为约22nt的双链miRNA(miRNA-miRNA),其中一条miRNA结合到RNA诱导沉默复合物(RNA-induced silencing complex,RISC),然后通过碱基互补作用结合到靶基因mRNA上,从而调控基因表达[8]。miRNA具有组织特异性,与肺组织相关的包括let-7a、miR-21、miR-31、miR-34、miR-143等40余种[9],它们在肺癌组织表达的降低或升高,以癌基因或抑癌基因样作用,调节转录翻译,促进或抑制肿瘤的发生发展。文献[10]报道,miR-7的靶基因多为原癌基因,包括IRS1、IRS2、EGFR和PAK1(p21/CDC42/RAC1-活化激酶1),在多个肿瘤中发挥抑癌基因的作用。2008年有研究[11]报道miR-7的基因序列与EGFR基因3’-UTR区存在至少3个区域的不完全互补,这种广泛性的序列互补将成为胶质瘤等特定基因靶向治疗的候选之一。次年有研究[12]发现在肺癌、乳腺癌等细胞中miR-7均有下调EGFR mRNA及蛋白表达的作用,同时miR-7减弱蛋白激酶B(protein kinase B,PKB)及细胞外信号调节激酶1/2(extracellular regulated protein kinases1/2,ERK1/2)的活性,后两者是EGFR信号的关键效应因子。进一步证实在一些与EGFR有关的肿瘤中上调miR-7的表达可以抑制肿瘤的生长。那么我们推测在吉非替尼继发耐药的肺癌细胞中miR-7的表达也会相应降低。
本研究选取6种EGFR突变状态不一的对吉非替尼敏感性不同的人NSCLC细胞株:A549、H358、H1299(EGFR野生型,吉非替尼耐药)、H827(EGFR E746-A750缺失突变,吉非替尼敏感)、H1650(EGFR E746-A750缺失突变,吉非替尼耐药)、H1975(EGFR L858R、T790M突变,吉非替尼耐药),同时对诱导建立的继发耐药细胞株H827-7/GR单克隆化,采用RT-PCR方法对上述肺癌细胞中miR-7表达量的差异性进行分析,结果提示各原发吉非替尼耐药肺癌细胞株(A549、H358、H1299、H1650、H1975)miR-7的表达水平较吉非替尼敏感细胞株(H827)低,差异有统计学意义(P<0.05),吉非替尼敏感细胞株H827诱导耐药后miR-7的表达水平较耐药前显著降低,差异有统计学意义(P<0.05)。结果提示,对于人NSCLC,无论是吉非替尼原发耐药还是继发耐药,肺癌细胞中miR-7的表达较敏感细胞均降低,从另一面间接证实了若在与EGFR有关的肺癌中上调miR-7的表达可以抑制肿瘤的生长。
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA: a cancer journal for clinicians, 2014, 64(1): 9-29.
[2] Jeong Y, Xie Y, Lee W, et al. Research resource: Diagnostic and therapeutic potential of nuclear receptor expression in lung cancer [J]. Mol Endocrinal, 2012, 26(8): 1443-1454.
[3] 潘晶晶, 冯继锋. 非小细胞肺癌 EGFR 酪氨酸激酶抑制剂的耐药机制及逆转[J]. 中国肿瘤外科杂志, 2012, 4(3): 164-168.
[4] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. Cell, 2004, 116(2): 281-297.
[5] Di Leva G, Garofalo M, Croce CM. MicroRNAs in cancer [J]. Annu Rev Pathol, 2014, 9: 287-314.
[6] Rho JK, Choi YJ, Lee JK, et al. Epithelial to mesenchymal transition derived from repeated exposure to gefitinib determines the sensitivity to EGFR inhibitors in A549, a non-small cell lung cancer cell line[J]. Lung Cancer, 2009, 63(2): 219-226.
[7] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative CT method [J]. Nat Protoc, 2008, 3(6): 1101-1108.
[8] Zhang Z, Wang J, He J, et al. Genetic variants in MUC4 gene are associated with lung cancer risk in a Chinese population [J]. PloS One, 2013, 8(10): e77723.
[9] Lee Y, Ahn C, Han J, et al. The nuclear RNase III Drosha initiates microRNA processing [J]. Nature, 2003, 425(6956): 415-419.
[10] O’Day E, Lal A. MicroRNAs and their target gene networks in breast cancer [J]. Breast Cancer Res, 2010, 12(2): 201-211.
[11] Negrini M, Ferracin M, Sabbioni S, et al. MicroRNAs in human cancer: from research to therapy [J]. J Cell Sci, 2007, 120(Pt 11): 1833-1840.
[12] Jiang L, Liu X, Chen Z, et al. MicroRNA-7 targets IGF1R (insulin-like growth factor 1 receptor) in tongue squamous cell carcinoma cells [J]. Biochem J, 2010, 432(1): 199-205.
[13] Kefas B, Godlewski J, Comeau L, et al. MicroRNA-7 inhibits the epidermal growth factor receptor and the Akt pathway and is down-regulated in glioblastoma[J]. Cancer Res, 2008, 68(10): 3566-3572.
[14] Webster RJ, Giles KM, Price KJ, et al. Regulation of epidermal growth factor receptor signaling in human cancer cells by microRNA-7[J]. J Biol Chem, 2009, 284(9): 5731-5741.
[15] 孙俊杰, 吴建中, 陆建伟, 等. 人非小细胞肺癌细胞 EGFR 基因启动子甲基化与吉非替尼敏感性之间的相关性研究[J]. 临床肿瘤学杂志, 2012, 17(9): 769-774.
Difference of miRNA-7 expression in the non-small cell lung cancer with different sensitivity to gefitinib and their clinical significance
LIUSiwen,CAOHaixia,WUJianzhong,MARong,JINGChangwen,WANGZuo,FENGJifeng.
(DepartmentofMedicalOncology,JiangsuCancerHospital,Nanjing210009,China)
FENGJifeng,E-mail:fjif@vip.sina.com
Objective To detect the difference of miRNA-7 expression in the non-small cell lung cancer with different sensitivity to gefitinib and explore their clinical significance.Methods The gefitinib resistant lung cancer cell line H827-7/GR was established from H827 by a method of repeated treatment with high dose of gefitinib for a short period. The H827-7/GR cells were monocloned through the method of limiting dilution. CCK-8 was used to test the sensitivity of H827, H827-7/GR and the monoclonal cells to gefitinib. RT-PCR was used to detect the difference of miRNA-7 expression in H827, H827-7/GR and the monoclonal cells, and other lung cancer cell lines with different sensitivity to gefitinib, such as A549, H358, H1299, H1650 and H1975.Results The drug resistance index of H827/GR was larger than 100. The half growth inhibition concentrations (IC50) of the six resistant monoclonal cell lines were different. The miRNA-7 expression of H827/GR, resistant monoclonal cell lines, and gefitinib resistant cell lines such as A549, H358, H1299, H1650 and H1975 were all lower than that of the gefitinib sensitive cell line H827 (P<0.05). Conclusions The miRNA-7 expression of gefitinib resistant cell lines is lower than that of gefitinib sensitive cell lines in the non small cell lung cancer. This suggests that the drug resistance of the non small cell lung cancer may be associated with the low expression of miRNA-7 and it may be a potential molecular marker of the sensitivity of lung cancer to the drugs.
gefitinib; sensitivity; miRNA-7; non-small cell lung cancer
国家自然科学基金(81372396),江苏省自然科学基金(BK20141016)
210009 江苏 南京,南京医科大学附属江苏省肿瘤医院 肿瘤内科
刘思文,女,硕士研究生,研究方向:肿瘤内科治疗及分子靶向治疗,E-mail:siwenliu1989@126.com
冯继锋,男,主任医师,教授,博士生导师,研究方向:肿瘤内科治疗及分子靶向治疗, E-mail:fjif@vip.sina.com
10.3969/j.issn.1674-4136.2015.02.002
1674-4136(2015)02-00074-05
2015-01-13][本文编辑:李筱蕾]
