门静脉高压症病人部分脾栓塞术后并发脾脓肿的危险因素及治疗
2015-06-10李路豪党晓卫李林李素新李海徐韶凯许培钦
李路豪 党晓卫 李林 李素新 李海 徐韶凯 许培钦
·论 著·(脾脏外科专题)
门静脉高压症病人部分脾栓塞术后并发脾脓肿的危险因素及治疗
李路豪 党晓卫 李林 李素新 李海 徐韶凯 许培钦
目的 探讨门静脉高压症病人行部分脾栓塞术(partial splenic embolization,PSE)后并发脾脓肿的治疗措施,并分析其危险因素。方法 回顾性分析2007年1月至2015年6月收治的12例经PSE治疗后并发脾脓肿的门静脉高压症病人的临床资料(脾脓肿组),讨论其治疗措施和效果。另选取同期收治的72例PSE后未并发脾脓肿的病人作为对照(非脾脓肿组)。分析两组病人的性别、年龄、白细胞、血红蛋白、血小板、白蛋白、胆红素、凝血酶原时间、腹水、Child-Pugh评分、门静脉宽度、糖尿病史、脾栓塞面积、脾栓塞次数及脾静脉流速下降水平,采用单因素分析及非条件Logistic回归模型筛选门静脉高压症PSE后并发脾脓肿的危险因素。结果 12例脾脓肿病人中8例直接行手术治疗(脾脏切除或脓肿切开引流),2例在穿刺引流无效后行手术切除脾脏,另2例行穿刺引流治疗。除1例在脾脓肿切开引流后死于败血症外,余病人恢复良好。单因素分析显示脾脓肿组的白蛋白(31.00±4.81) g/L低于非脾脓肿组(34.33±5.12) g/L,Child-Pugh评分分别为7.83±1.11和6.44±1.44、脾栓塞面积(73±8)%和(69±11)%、术后脾静脉流速下降水平(3.67±0.91) cm/s高于非脾脓肿组(3.06±0.82) cm/s,差异有统计学意义(P<0.05)。非条件Logistic回归分析显示脾栓塞面积、Child-Pugh评分、脾静脉流速下降水平是门静脉高压症PSE后并发脾脓肿的独立危险因素(OR=4027.845、2.203、2.517,P=0.032、0.006、0.043)。结论 对门静脉高压症PSE后并发脾脓肿的病人应及时行手术切除脾脏或脓肿引流。脾栓塞面积较大、Child-Pugh评分较高、脾静脉流速下降水平较高的病人术后更易并发脾脓肿。
门静脉高压症;部分脾栓塞;脾脓肿;治疗;危险因素
门静脉高压症是肝炎后肝硬化的常见并发症,包括脾大、腹水、食管胃底静脉曲张等一系列表现,严重时可危及生命。目前,部分脾栓塞术(partial splenic embolization,PSE)已经成为治疗门静脉高压症所致严重脾功能亢进及上消化道出血的一种手段,临床证实安全、有效,可视为外科切脾的替代疗法[1-2]。但是,尽管部分脾栓塞相较于全脾栓塞的安全性更高,但病人术后仍有发生脾脓肿的危险。作为PSE最为严重的局部并发症,脾脓肿的总病死率可达40%~50%[3]。本文回顾性分析了我院收治的经PSE治疗后并发脾脓肿的门静脉高压症病人的临床资料,并对脾脓肿的治疗措施及危险因素进行分析,以更好的防治该并发症。
资料与方法
一、一般资料
本组为郑州大学第一附属医院2007年1月至2015年6月收治的病人。纳入标准:①有明确的乙型肝炎肝硬化或丙型肝炎肝硬化病史;②存在不同程度门静脉高压症的临床表现;③曾行一次或多次PSE治疗。排除标准:①门静脉海绵样变、肝小静脉闭塞病、布-加综合征等所致的门静脉高压症;②存在心瓣膜病、血液系统疾病、脾外伤、脾肿瘤、毗邻脏器感染等易致脾脓肿的潜在因素;③既往曾行分流术、断流术、胃冠状静脉栓塞术等治疗。脾脓肿诊断标准:①PSE术后1个月以内;②存在典型临床表现(发热、寒战、左上腹痛等)及CT表现(平扫呈低密度,内可见气体或液平,增强扫描脓肿壁强化但脓肿内容物不强化)。据此,查阅到我院实施PSE治疗的107例病人中有6例(5.6%)发生脾脓肿,与转至我院诊治的另6例符合条件的脾脓肿病人共同作为脾脓肿组(共12例),另将资料完善的72例未并发脾脓肿病人作为非脾脓肿组。
本研究中,脾脓肿组病人12例,其中男性5例,女性7例,年龄35~60岁,平均(48.2±7.5)岁,行PSE一次10例、两次2例,合并糖尿病3例。非脾脓肿组病人72例,其中男性33例,女性39例,年龄23~83岁,平均(49.3±12.6)岁,行PSE一次68例、两次4例,合并糖尿病9例。
二、脾脓肿病人的治疗
根据病人的一般情况、脓肿特点及临床症状,分别采取手术或穿刺引流治疗,手术前后均辅以营养支持、维持水电解质平衡,并根据药敏结果应用高效、敏感的抗生素。
1.手术治疗 适用于脓肿范围较大、多发脓肿、脓肿破溃或穿刺引流治疗效果不佳的病人。术中先处理脾蒂,也可逆行脾切除,术后放置脾窝引流管。若脾脏与周围脏器组织粘连严重致使不易切除时,则行脓肿切开引流。
2.穿刺引流 适用于脓液稀薄、单发脓肿及难以耐受手术的病人。在彩超引导下经腹壁行脓肿穿刺引流,术后用生理盐水反复冲洗脓腔。
三、研究资料的收集
1.基本资料 查阅病历,记录病人的性别、年龄、病史、白细胞、血红蛋白、血小板、白蛋白、胆红素、凝血酶原时间、腹水情况、糖尿病史等。血生化指标均于清晨空腹抽取静脉血检测,并根据相关指标计算Child-Pugh评分。
“天子之制,地方千里,公候皆方百里,伯七十里,子男五十里,凡四等。”[15]P786诸侯得到天子封赐的人民和疆土之后,再把土地和人民依次封赐给卿、大夫作采邑。总之,在五等爵制之下,土地和人民都归大小奴隶主贵族所有,奴隶则要世代受压迫。而军功爵制则不像西周五等爵制那样的“授民授疆土”的内容。诸侯根据其臣下军功的高低,赐予不同的封爵.封爵低的可以免去徭殺,减少税赋,或授予其相应数量的土地。功劳高的可封君食邑,在政治和经济上享有诸多特权,但也只是象征性食邑税收的而已,封地内的疆土和人口所有权并不完全归其领主所有。
2.PSE治疗 在DSA下将导管选择性插入脾动脉造影,确定导管置入脾动脉的位置及深度,使用明胶海绵微粒栓塞脾动脉的中下极分支,再次造影观察栓塞情况并估算栓塞面积。
3.彩超检查 PSE术前行彩超检查测量门静脉宽度及脾静脉流速,术后2~3周复查彩超测量脾静脉流速。以手术前后脾静脉流速的差值得出脾静脉流速下降水平。
四、数据分析
结 果
一、脾脓肿病人的治疗
12例脾脓肿病人分别采取了手术或穿刺引流治疗。8例直接行手术治疗,其中6例手术切除脾脏,2例因脾脏与周围组织粘连紧密而仅行脓肿切开引流。4例病人行穿刺引流治疗,其中2例因效果不佳改行手术切除脾脏。所有病人中,除1例行脓肿切开引流后死于败血症外,其余病人均恢复良好后出院。
单因素分析结果显示,两组病人在性别、年龄、白细胞、血红蛋白、血小板、胆红素、凝血酶原时间、腹水情况、门静脉宽度、糖尿病史、脾栓塞次数上差异无统计学意义(P>0.05)。脾脓肿组的白蛋白(31.00±4.81) g/L明显低于非脾脓肿组(34.33±5.12) g/L,脾栓塞面积、Child-Pugh评分、脾静脉流速下降水平明显高于非脾脓肿组,差异有统计学意义(P<0.05)。两组病人基本资料见表1。
三、非条件Logistic回归分析结果
将脾脓肿组病人的白蛋白、Child-Pugh评分、脾栓塞面积、脾静脉流速下降水平纳入非条件Logistic回归模型,结果显示脾栓塞面积、Child-Pugh评分、脾静脉流速下降水平是脾脓肿发生的独立危险因素(OR=4027.845、2.203、2.517,P=0.032、0.006、0.043)(表2)。
讨 论
脾脏由于具备抵抗局部感染的免疫能力,因此本身不易发生感染,脾脓肿的发病率极低,仅为0.14%~0.7%[3]。对于肝硬化门静脉高压症病人,虽然国内外多数研究均证实PSE是一种较为有效的治疗手段,可以显著改善脾功能亢进、降低门静脉压力[1,4-5],但病人术后发生脾脓肿的风险却较自然状态显著增加,这除了与PSE阻碍了部分脾实质的血液供应并导致局部梗死有关外,长期的肝硬化病史导致机体抵抗力较差也是重要原因。此外,门静脉高压症病人脾脏的免疫功能本身就处于紊乱状态[6],这很可能也在一定程度上提高了病人PSE后发生脾脓肿的概率。而脾脓肿一旦发生,将对病人的生命安全带来极大威胁,对此,除了及时有效的治疗措施外,正确认识PSE后脾脓肿发生的危险因素也至关重要。
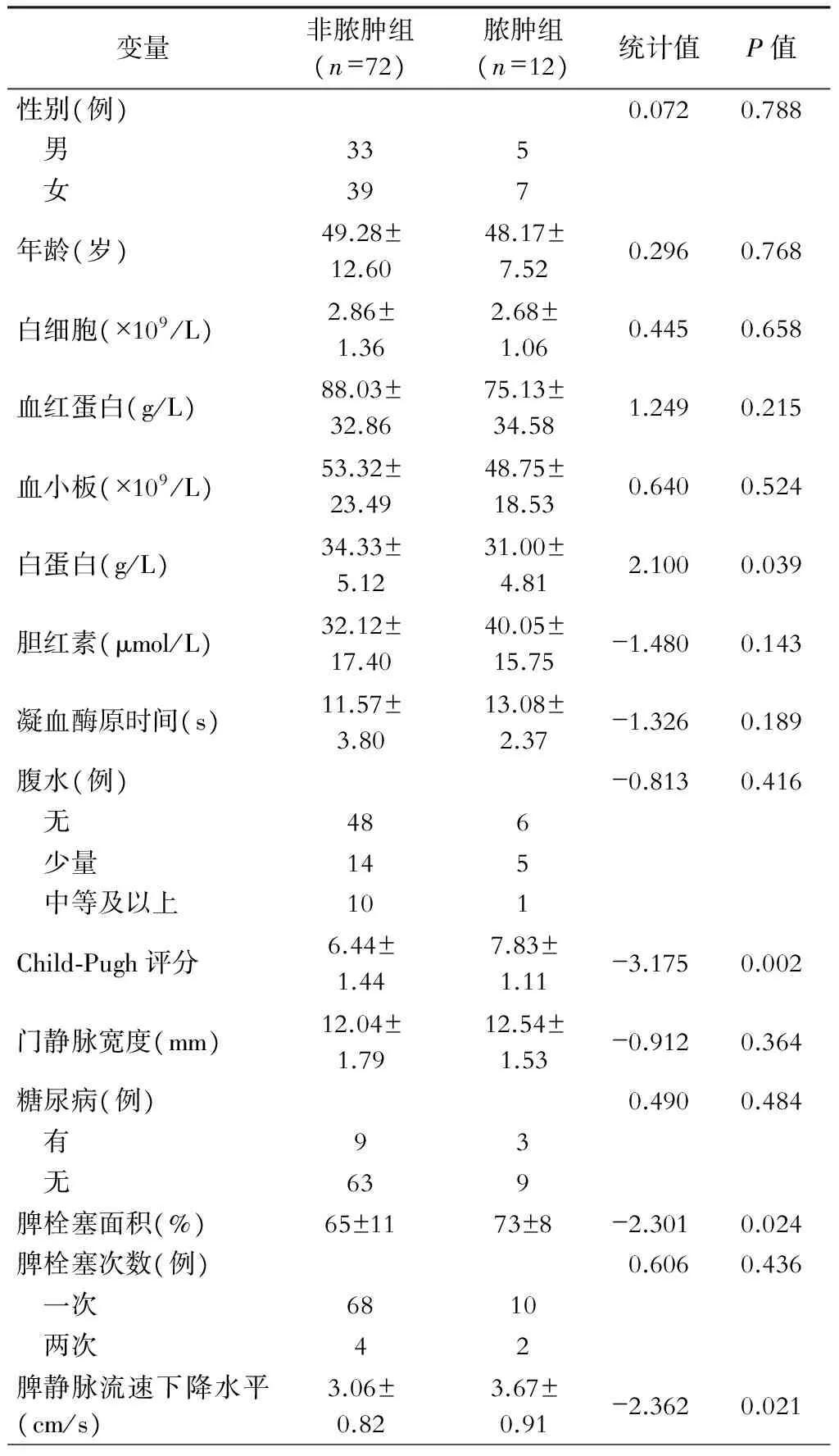
表1 门静脉高压症PSE术后并发脾脓肿与未并发脾脓肿病人一般资料的比较
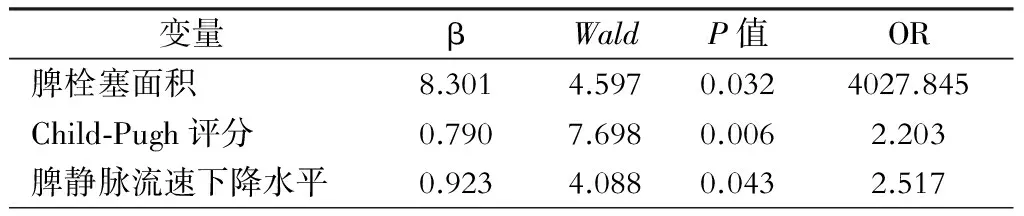
表2 门静脉高压症PSE术后并发脾脓肿的非条件Logistic回归分析结果
目前,不同文献对脾脓肿各种治疗方法的评价并不一致,有学者指出穿刺引流应作为一线治疗措施[7],但也有建议对存在不良预后因素的病人及早行手术治疗[8],Lee等[9]则认为脾脓肿的治疗没有金标准,选择方法应个体化。但对于PSE后并发脾脓肿的门静脉高压症病人,我们主张根据病人的不同情况及早实施手术或脓肿引流,目的在于去除体内的感染源以避免炎症全身播散。如果脾脏脓肿广泛,特别是存在脓肿破溃时,只要条件允许,应及早手术切除脾脏,术中优先处理脾蒂以减少出血,无法辨清脾门结构时可考虑逆行脾切除。但是,当脾脏与周围脏器组织存在广泛粘连时,强行切除脾脏极有可能造成腹腔脏器的严重损伤,此时应切开脓肿充分引流即可。而对于脓腔较小、单发脓肿、脓液稀薄或存在严重心肺功能障碍难以耐受手术的病人,可行经皮脓肿穿刺引流治疗,后经引流管反复使用生理盐水冲洗脓腔。需要注意的是,对于穿刺引流治疗效果不明显的病人,应争取早日手术切除脾脏,切不可因过分追求微创治疗及保留脾脏而错失手术时机。此外,无论采取何种治疗措施,均需配合高效、敏感的抗生素应用及营养支持,以降低感染播散的风险。本研究12例脾脓肿病人中,除2例病人穿刺引流治疗效果较好外,8例病人均直接行手术治疗,2例在穿刺引流效果不佳的情况下再行手术治疗,结果1例病人因术中脾脏粘连严重仅行脓肿切开引流,术后病人死于全身感染,其余病人均恢复良好后出院。
PSE在脾脓肿的形成过程中起了重要的诱导作用,这首先与脾脏的栓塞面积有关。对于门静脉高压症而言,足够的栓塞面积是达到治疗效果的先决条件,过小的栓塞面积无益于病情的改善。Koconis等[10]的研究发现,栓塞程度小于60%时的中远期效果并不理想,且残余脾组织的增生易导致脾功能亢进复发,蔡明岳等[11]认为脾栓塞比例≥68.2%、非梗死脾体积≤211.5 ml是确保PSE疗效的重要因素。然而,过大的栓塞面积则导致栓塞后综合征、胸腔积液、门脾静脉血栓等并发症的发生概率显著增加,栓塞面积也被视为脾脓肿发生的重要因素[12-14]。因此,综合考量治疗效果及术后并发症两方面因素,有研究指出将脾脏栓塞面积控制在50%~70%时可达到满意的总体效果[15]。另外,PSE次数的增加并不会提高脾脓肿的发生率,对于巨脾病人,少量、多次实施PSE既可达到治疗效果,又可避免单次大面积栓塞诱发脾脓肿[11]。周瑶军等[16]的研究指出,对于脾体积≥800 ml的病人应选择分次栓塞以减少术后并发症的发生概率。本研究也发现,脾脓肿组的栓塞面积显著高于非脾脓肿组,而两组病人的脾栓塞次数无明显差异,而且,多因素回归分析也证实,脾栓塞面积是PSE后脾脓肿发生的独立危险因素。除栓塞面积外,PSE对脾脏血流动力学的影响也是导致脾脓肿发生的重要因素,这也是PSE可以有效降低门静脉压力原因所在。研究发现,门静脉高压症病人经PSE治疗后脾静脉的流速明显下降[17],而血流速度的减慢则增加了肠道细菌经脾静脉逆流进入脾脏的概率,因此,在PSE后脾脏存在梗死灶的基础上,细菌入血后逆流进入脾栓塞区在一定程度上促进了脾脓肿的发生。本研究中,我们发现所有病人的脾静脉流速均出现不同程度的下降,且脾脓肿组的下降水平要显著高于非脾脓肿组,多因素分析也证实,脾静脉流速下降水平是脾脓肿发生的独立危险因素,OR值为2.517,提示PSE后脾静脉流速下降水平每增加1 cm/s,脾脓肿的发生概率就增加2.517倍。
本研究中,我们发现几乎所有的病人在PSE治疗后脾脏均会出现大小不一的单发或多发低密度梗死灶,但是,多数病人在对症支持治疗后,梗死灶可以自行吸收而不进展至脾脓肿。然而,另有部分病人在栓塞面积较小的情况下依然发生了脾脓肿,提示除栓塞面积外,也有其他因素共同参与了脓肿的形成。门静脉高压症病人由于长期的肝炎肝硬化病史,加上反复多次的消化道出血,导致肝脏储备功能较差,对全身其他脏器功能也造成了不同程度的影响,使得机体的免疫力及对创伤的抵抗力显著下降。Hayashi等[18]指出,肝功能Child-Pugh C级的肝硬化病人PSE治疗后更容易出现各种并发症。我们的研究也显示,脾脓肿组的术前白蛋白水平更低,而Child-Pugh评分则更高,且Child-Pugh评分是脾脓肿发生的独立危险因素,OR值为2.203,提示Child-Pugh评分每增加1分,脾脓肿的发生概率增加2.203倍,即在肝功能较差的基础上,即便轻度的脾脏栓塞也可导致脾脓肿形成。因此,对于拟行PSE治疗的门静脉高压症病人,术前可通过保肝、利尿、补充白蛋白等措施提高病人的肝脏储备功能,以降低术后脾脓肿的发生概率。此外,虽然糖尿病可降低机体抵抗力,使病人更易发生脾脓肿[3],但本研究未发现两组病人在糖尿病患病率上存在差异,我们认为这可能与病人围手术期血糖控制较好有关。也有学者提出,术中无菌操作不严格也是PSE后脾脓肿发生的不利因素,而术前做好肠道清洁准备则可降低术后菌群移位所致脾脓肿的发生概率[19],但我们未对这些因素进行分析,这也是本研究的局限之处。
总之,本研究表明,脾栓塞面积、Child-Pugh评分、脾静脉流速下降水平是门静脉高压症病人PSE后发生脾脓肿的危险因素,提高对这些因素的认识有助于临床医生更好的防治该并发症,而在脾脓肿发生后,根据病人全身情况及脓肿特点,积极实施手术切除脾脏或脓肿有效引流是提高治疗效果的重要措施。
1 王宁,阎英,郭占文,等.肝硬化并发脾功能亢进病人部分性脾栓塞的临床应用.中国老年学杂志,2014,34:79-81.
2 Amin MA,el-Gendy MM,Dawoud IE,et al.Partial splenic embolization versus splenectomy for the management of hypersplenism in cirrhotic patients.World J Surg,2009,33:1702-1710.
3 宋凤麟,逯林欣,李彩霞,等.脾脓肿19例临床资料分析.中华内科杂志,2013,52:313-317.
4 朱莉,李明,金满春,等.部分脾栓塞术对肝硬化病人门静脉血流动力学的影响.南通大学学报(医学版),2010,30:124-125.
5 Alzen G,Basedow J,Luedemann M,et al.Partial splenic embolization as an alternative to splenectomy in hypersplenism-single center experience in 16 years.Klin Padiatr,2010,222:368-373.
6 张澍,李宗芳.脾脏研究的问题与思考.中华实验外科杂志,2015,32:230-231.
7 Sreekar H,Saraf V,Pangi AC,et al.A retrospective study of 75 cases of splenic abscess.Indian J Surg,2011,73:398- 402.
8 Chang KC,Chuah SK,Changchien CS,et al.Clinical characteristics and prognostic factors of splenic abscess: a review of 67 cases in a single medical center of Taiwan.World J Gastroenterol,2006,12:460-464.
9 Lee WS,Choi ST,Kim KK.Splenic abscess:a single institution study and review of the literature.Yonsei Med J,2011,52:288-292.
10Koconis KG,Singh H,Soares G.Partial splenic embolization in the treatment of patients with portal hypertension:a review of the english language literature.J Vasc Interv Radiol,2007,18:463-481.
11蔡明岳,黄文薮,郭永建,等.部分脾栓塞术治疗肝硬化脾功能亢进的疗效预测.中华普通外科杂志,2014,29:161-164.
12王刚刚,倪才方.部分脾栓塞治疗脾亢的现状.临床肝胆病杂志,2012,28:99-102.
13Hadduck TA,McWilliams JP.Partial splenic artery embolization in cirrhotic patients.World J Radiol,2014, 6:160-168.
14Matsumoto T,Yamagami T,Terayama K,et al.Risk factors and clinical course of portal and/or splenic vein thrombosis after partial splenic embolization.Acta Radiol,2009,50:617-623.
15Zhu K,Meng X,Qian J,et al.Partial splenic embolization for hypersplenism in cirrhosis: a long-term outcome in 62 patients.Dig Liver Dis,2009,41:411-416.
16周瑶军,刘长江,王要军,等.肝硬化脾栓塞术后血小板升高水平与栓塞体积的关系以及并发症发生的危险因素.肝脏,2014,19:518-520.
17李茂美,程永德,朱西琪.两种不同脾栓方法后门脉压力变化对照研究.介入放射学杂志,2014,23:861-864.
18Hayashi H,Beppu T,Okabe K,et al.Risk factors for complications after partial splenic embolization for liver cirrhosis.Br J Surg,2008,95:744-750.
19冯早明,黄茂涛,季代金.部分脾栓塞术前准备对于防治术后并发症的意义.现代消化及介入诊疗,2013,18:321-323.
Risk factors of splenic abscess secondary to partial splenic embolization in patients with portal hypertension and treatment
LiLuhao,DangXiaowei,LiLin,LiSuxin,LiHai,XuShaokai,XuPeiqin.
DepartmentofHepatopancreatobiliarySurgery,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
DangXiaowei,Email:dangxw1001@163.com
Objective To investigate the treatment of splenic abscess secondary to partial splenic embolization (PSE) in patients with portal hypertension, and analyze its risk factors. Methods The clinical data of 12 cases of portal hypertension with splenic abscess secondary to PSE treated in the First Affiliated Hospital of Zhengzhou University from January 2007 to June 2015 were analyzed retrospectively (splenic abscess group), and the treatment strategies and outcomes were also analyzed. 72 patients with no secondary splenic abscess following PSE were selected as control group in the same term (non-splenic abscess group). Gender, age, white blood cells, hemoglobin, platelets, albumin, bilirubin, prothrombin time, ascites, Child-Pugh score, portal vein diameter, diabetes history, splenic embolization area, splenic embolization times and decreased level of splenic vein flow velocity were recorded and analyzed. Univariate analysis and unconditional Logistic regression model were performed to screen corresponding risk factors. Results In 12 splenic abscess patients, 8 patients were treated with operation directly (splenectomy or abscess incision drainage), 2 patients with operation after an ineffective puncture drainage, and 2 patients with puncture drainage. All patients recovered well except 1 patient died from sepsis after abscess incision drainage. Univariate analysis showed that the albumin levels were lower and Child-Pugh score, splenic embolization area and decreased level of splenic vein flow velocity were significantly higher in splenic abscess group than those in non-splenic abscess group (P<0.05 for all). The results of unconditional Logistic regression model analysis indicated that splenic embolization area, Child-Pugh score and decreased level of splenic vein flow velocity were independent risk factors of splenic abscess secondary to PSE in patients with portal hypertension (OR=4027.845, 2.203, 2.517;P=0.032, 0.006, 0.043, respectively). Conclusions For splenic abscess secondary to PSE in patients with portal hypertension, timely splenectomy or abscess incision drainage is necessary, and patients with larger splenic embolization area, higher Child-Pugh score and higher decreased level of splenic vein flow velocity are more likely to be complicated with splenic abscess after PSE.
Portal hypertension; Partial splenic embolization; Splenic abscess; Treatment; Risk factors
450052 郑州,郑州大学第一附属医院肝胆胰脾外科
党晓卫,Email:dangxwl001@163.com
R657.6
A
10.3969/j.issn.1003-5591.2015.06.005
2015-08-08)
