葫芦小孢子发育时期与花器形态相关性
2015-06-09胡雪丹徐锦华姚协丰李苹芳陈学好羊杏平
胡雪丹, 张 曼, 侯 茜, 徐锦华, 刘 广, 姚协丰, 李苹芳, 陈学好,羊杏平
(1.江苏省农业科学院蔬菜研究所,江苏 南京 210014;2.扬州大学园艺与植物保护学院,江苏 扬州 225000)
葫芦小孢子发育时期与花器形态相关性
胡雪丹1,2, 张 曼1, 侯 茜1, 徐锦华1, 刘 广1, 姚协丰1, 李苹芳1, 陈学好2,羊杏平1
(1.江苏省农业科学院蔬菜研究所,江苏 南京 210014;2.扬州大学园艺与植物保护学院,江苏 扬州 225000)
为了能够快速准确判断葫芦小孢子发育时期,通过对葫芦花器外观形态与花药显微结构的观察,并将其与小孢子发育时期进行联系。结果显示:葫芦小孢子经过四分体时期、单核期和二核期后发育成成熟花粉粒;在顶芽生长点肉眼可辨别花芽和叶芽的1 d和2 d时,在6.3~6.7 mm的花蕾中,小孢子多处于单核期,此时葫芦花雄蕊的花粉管干瘪较适合花药、小孢子培养;发育到第3 d、4 d时,花粉管较饱满,此时基本为发育成熟的花粉粒。表明可以根据葫芦花蕾的形态、大小及小孢子的发育时期,确定花药、小孢子培养最佳时期所对应的选蕾标准。
葫芦;小孢子;发育时期;花器形态
葫芦为葫芦科(Cucurbitaceae)葫芦属,一年生攀援草本植物。学名[Lagenaria siceraria(Molina)Standl.],又名瓠瓜、瓠子、扁蒲、蒲瓜、夜开花等[1]。葫芦是适宜嫁接的优良砧木,葫芦科植物的常规遗传育种方法育种周期长、难度大和遗传性状不稳定。单倍体育种技术为缩短育种年限、提高育种效率提供了可能,但在葫芦科蔬菜作物中,自发产生单倍体的频率极低[2]。为了获得单倍体,研究者尝试通过离体雄核发育途径(花药或小孢子培养)、雌核发育途径(未授粉子房或胚珠离体培养、外源化学药剂、正常花粉或辐射过的花粉授粉诱导的孤雌生殖)等手段诱导单倍体[3]。近年来,花药培养和游离小孢子培养技术的不断成熟,为单倍体离体培养的应用带来了曙光。在花药培养或小孢子培养时,花粉发育时期的选择是影响离体诱导单倍体成功的重要因素之一。不同植物种类诱导愈伤组织形成和胚状体发生的适宜小孢子发育时期是不同的,多数物种诱导胚胎发生的最佳小孢子发育时期是单核靠边期[2-7]。许多研究结果表明小孢子发育时期与花器外部形态密切相关,可以依据花器形态特征,特别是花蕾的大小,即可判断植物小孢子发育时期[8-11]。为此,通过对葫芦小孢子配子体发育时期的细胞学观察,找出小孢子各发育时期对应的花器与花药外观形态,研究其相关性,为葫芦小孢子发育时期的鉴定奠定基础。
1 材料与方法
1.1材料
供试葫芦品种为相生FMT,由江苏省农业科学院蔬菜研究所瓜类研究室提供,于2014年10月播种,11月定植于温室,常规管理。
1.2 方法
1.2.1 花蕾形态观察与测量 从葫芦植株顶端花芽与叶芽肉眼可辨认第1 d开始为观察期,每天13∶00点选择15朵大小相等的花蕾做标记,并每天用毫米尺测量记录长度。取样时间是15∶00—17∶00,用镊子按生长天数取葫芦花蕾放入自封口塑料袋内,用冰盒带回实验室。用游标卡尺测量花蕾纵径,然后用镊子剥去萼片、花瓣,取出花药,进行观察拍照。
取生长了1~16 d的花蕾两组,将样品去萼片、花瓣,置于0.1 mol/L磷酸缓冲液配制的2.5%的戊二醛溶液中抽真空固定后4℃过夜,处理好的样品在EVO-LS10扫描电子显微镜下观察并拍照。
1.2.2 小孢子发育过程观察 本研究参考钱春桃等[12]方法进行染色体制片,并进行改良,较适于对不同发育时期的小孢子进行观察。采集1 d到6 d的花蕾样品,用改良卡诺液(1体积无水酒精 ∶3体积冰醋酸)固定24 h,用75%的酒精保存在4℃冰箱中备用。
用镊子轻轻夹取少许花药置于载玻片,并挤压出花粉母细胞,去除杂质,用醋酸洋红染色和卡宝染色液染色,采用火焰微烤和45% 醋酸分色制片,使用Olympus(BX-51)显微镜观察并拍照。
2 结果与分析
2.1 葫芦花蕾形态观察
从第一批葫芦花蕾肉眼可辨直至第一批花蕾开花后,统计花蕾每天的生长值(表1),选取相对应大小的花蕾及剥去花萼、花瓣后的花药取样拍照(图1)。花蕾生长值记录从第1 d标记到开花,历时16 d;取样从第1 d标记到花败,历时18 d。
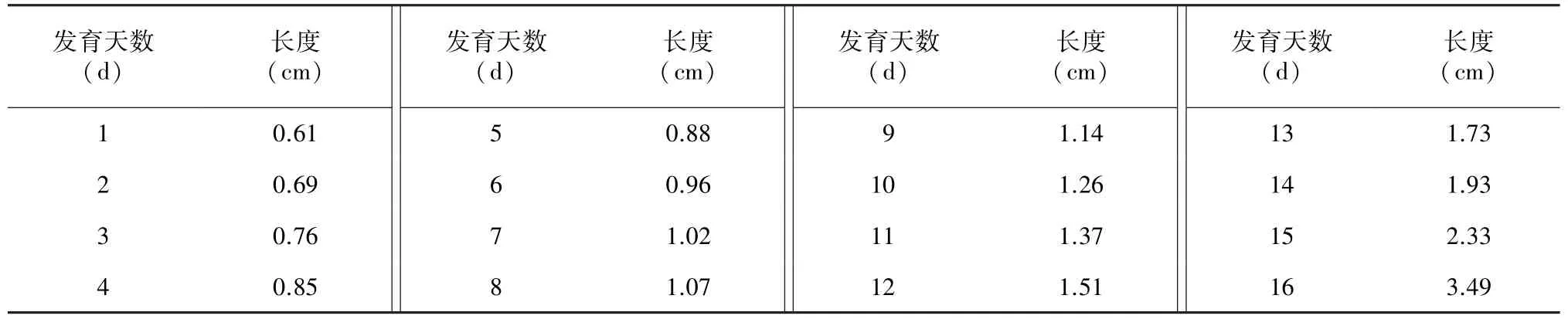
表1 葫芦花蕾各时期生长值Table 1 The grow th values of the groud buds
表1可知,花蕾在前期(第1~13 d)生长势较缓慢,待到14 d与15 d时生长迅速,开花前一天生长值是开花前两天生长值的3倍。由图1可见,在观察期第1 d,花蕾紧贴叶腋处皱缩,着生浓密白色绒毛的萼片将花冠紧紧包裹,去花瓣与萼片后,花药相对小且干瘪,整体呈深绿色。发育第2 d、3 d后,花蕾与花药均渐大并相对饱满,深绿色变浅,萼片开始展开。随着发育进程的推进,花蕾似钟形均匀缓慢生长,花萼逐渐开展,花冠长势超过花萼,花蕾与花药颜色由深绿色经过浅绿色、黄色,最终变成白色,并准备开放。
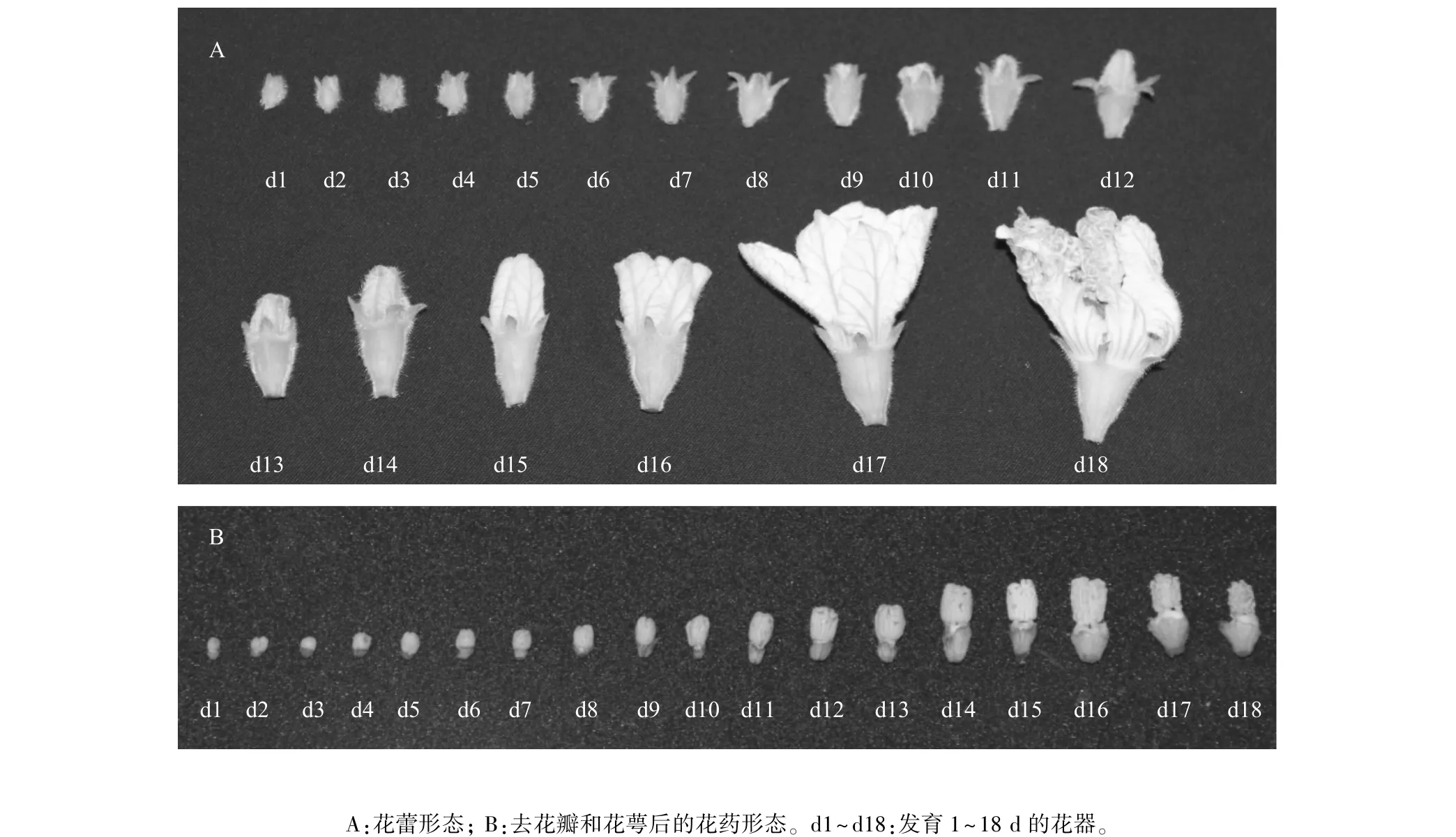
图1 葫芦各时期花器形态Fig.1 Gourd bud morphology at each developmental phase
2.2 葫芦花药发育过程
葫芦花是单性花,通过扫描电镜的观察,葫芦花为雄蕊之间花丝部分合生在一起,雄蕊群通过花丝合生成3个单体,花药相互分离,形成一个球体状的聚药雄蕊(图2A、图2B)。葫芦科部分植物为雄蕊5个,这3个单体是5个雄蕊通过两两合生、另一个离生而形成的三体雄蕊[13]。通过显微扫描可以观察到葫芦花雄蕊确实是由3个单体组成,其中合生的两个单体(图2C)体积明显比离生的单体(图2D)大一倍。3个单体紧密簇生形成不规则的球体,花药呈管状环绕,位于合生花丝形成的肉质联合体顶端(图2A、图2B)。
在花芽与叶芽可以肉眼分辨后1 d或2 d,葫芦花雄蕊的花粉管干瘪,发育3 d或4 d后花粉管逐渐饱满,花药表皮有一条明显的浅沟(图2E),随着发育,浅沟加深,其他方面没有明显差异。发育至第14 d时,花瓣从青色转为白色,花药的浅沟开始开裂。花药成熟后,花蕾开放时,花药在浅沟处纵裂,花粉粒沿裂缝散出,布满花粉管外围(图 2F、图2G)。发育到第18 d时,花蕾开败,花粉粒从着生处散落,仅留下开裂的花粉管(图2H)。
2.3 葫芦小孢子配子体的发育途径
成熟小孢子的发育途径为:四分体时期-单核小孢子早期-单核小孢子中期-单核靠边期-二细胞花粉早期-二细胞花粉中期-二细胞花粉晚期-成熟花粉时期(图3)。
经细胞学染色结果显示:在葫芦品种相生FMT发育1 d的样品中(图1),花蕾大小小于5.9 mm时小孢子还处于母细胞或者更前期;花蕾大小在5.9~6.2mm时,小孢子基本处于四分体时期(图3A);在发育2 d的样品中(图1),花蕾大小在6.3~6.7 mm时,小孢子基本处于单核期,此时胼胝质破裂,小孢子从四分体中释放出来(图3B),随着大液泡的形成,细胞内细胞核从细胞中央被挤向细胞壁较厚的一侧,即从小孢子单核早期经过单核中期进入单核靠边期(图3C~图3E);在发育2~3 d的样品中(图1),花蕾大小在6.8~7.2 mm时小孢子基本处于二细胞期(图3F~图3H),可以看到第1次有丝分裂前后的多种状态:其中一部分观察不到染色的细胞核此时期为小孢子进入了第1次有丝分裂的间期,大部分为已经完成第1次有丝分裂具有1个营养细胞和1个生殖细胞的二核期小孢子。营养细胞的体积大,靠近大液泡,生殖细胞体积小,贴近花粉壁。随着小孢子继续发育,生殖核会向细胞的中央迁移,从二细胞早期进入二细胞晚期。在大于7.2 mm的大花蕾中,大部分小孢子体积显著变大变圆,可以看到拥有3个萌发孔和三股沟的成熟花粉粒(图3I)。
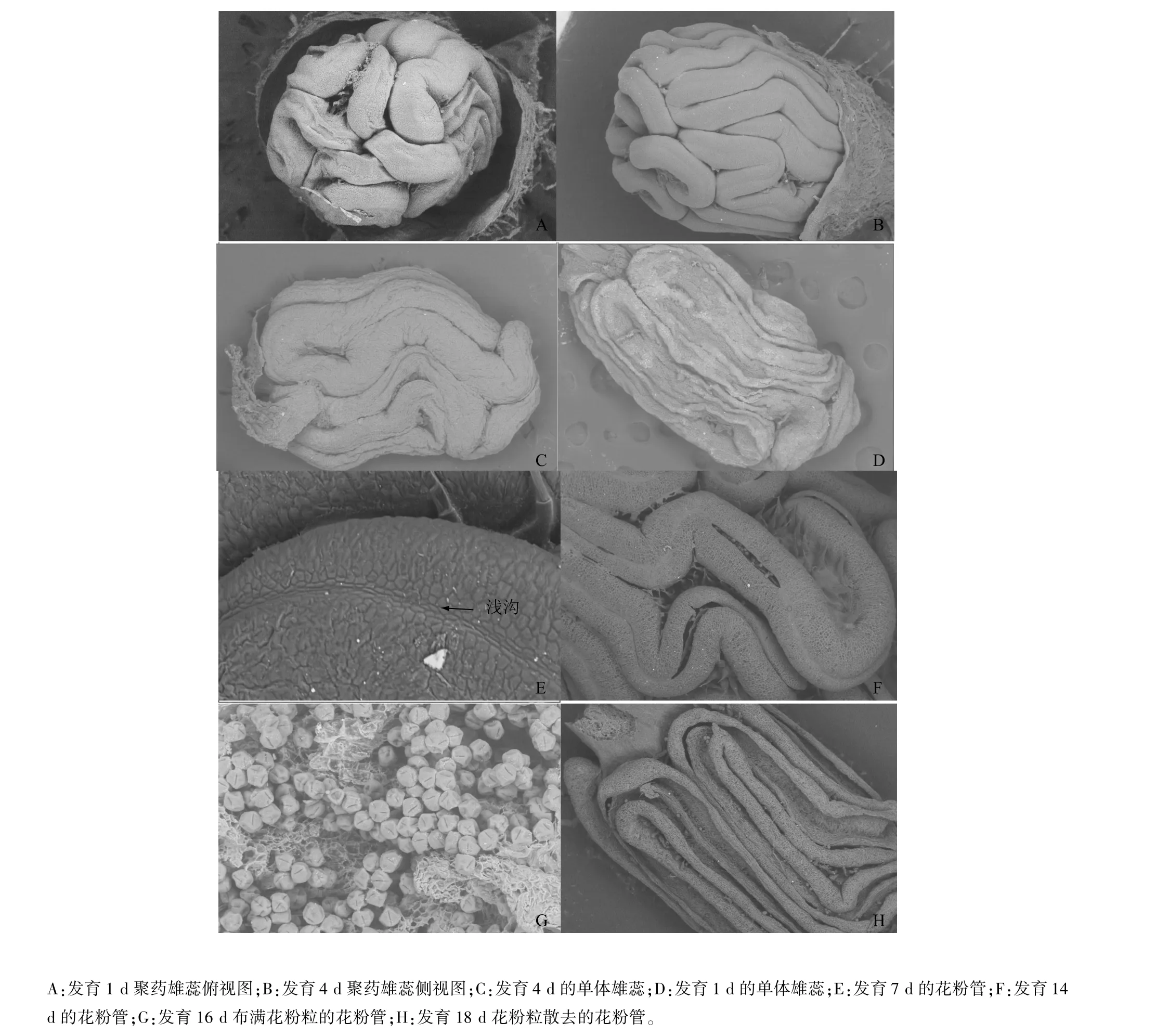
图2 花药发育结构图Fig.2 Anther developmental structure
2.4 相关性分析
2.4.1 小孢子发育时期与花器形态相关性分析花蕾大小在6.3~6.7 mm时,小孢子基本处于单核期,而在葫芦植株顶芽生长点处肉眼可辨花芽与叶芽后1 d的花蕾,其大小为5.5~6.5mm;发育到第2 d时,花蕾长度为6.0~7.0 mm。经观察统计,花蕾大小在5.9~6.2 mm时,小孢子基本处于四分体时期;花蕾大小在6.3~6.7 mm时,小孢子基本处于单核期;花蕾大小在6.8~7.2 mm时,小孢子基本处于二细胞期。此时花蕾紧贴叶腋处皱缩着,着生浓密白色绒毛的萼片将花冠包裹,花瓣未露出花萼;去花瓣与萼片后,花药相对小且干瘪,整体呈深绿色。所以后期花药与小孢子培养所需的小孢子单核靠边期取样时,应在可辨花芽与叶芽后发育1~2 d的花蕾中挑选大小为6.3~6.7 mm的花蕾用于培养。
2.4.2 小孢子发育时期与花药结构相关性分析
在观察1 d、2 d时,扫描电镜下葫芦花蕾的合生花丝皱缩,外围环绕的花粉管干瘪有皱褶(图2A和图2C),对应了葫芦花器观察期1 d、2 d时外观形态不饱满,此时葫芦小孢子多处于四分体到二核期。发育3 d、4 d后,小孢子逐渐发育成饱满的成熟花粉粒,花粉管也趋于饱满,花药表皮有一条不明显浅沟,随着发育,浅沟加深(图2E、图2F)直至后期开裂散出成熟花粉。

图3 葫芦小孢子各发育阶段的细胞学特征(×400)Fig.3 M orphological characteristics at each developmental stage of gourd m icrospore(×400)
3 讨论
随着单倍体育种技术的不断成熟,花药培养和小孢子培养的优势日渐体现,在葫芦花药和小孢子培养诱导单倍体的过程中,确定小孢子发育时期与花蕾外部形态特征的对应关系对于花药培养成功与否起着决定性的作用。通过对花粉染色制片观察小孢子雄配子发育途径细胞学特征,与其对应的花器外观和花药形态的相关性,得出结论:葫芦小孢子雄配子体发育经历四分体时期、单核期和二核期后发育成为成熟花粉粒;在葫芦植株顶芽生长点肉眼可辨别花芽和叶芽的1 d、2 d时,大小为6.3~6.7 mm的不饱满花蕾适宜做培养材料,此时花粉管干瘪,花器整体呈深绿色。在植物花药或小孢子培养过程中,取材时期对于培养成功与否起着决定性的作用。本试验为鉴定小孢子发育时期,快速找到小孢子单核期提供了简易的方法。
[1] 朱德蔚,王德槟,李锡香.中国作物及其野生近缘植物-蔬菜作物卷[M].北京:中国农业出版社,2008.
[2] SAVIN F,DECOMBLEV,LECOUVIOURM,etal.The X-ray detection of haploid embryos arisen in muskmelonCucumismelonL.seeds and resulting from a parthenogenetic development induced by irradiated pollen[J].Cucurbit Genet Coop,1988,11:39-42.
[3] 雷 春,陈劲枫.葫芦科蔬菜作物单倍体材料创制的研究进展[J].中国蔬菜,2006(1):33-36.
[4] 詹 艳,陈劲枫,AHMED A M.黄瓜游离小孢子培养诱导成胚和植株再生[J].园艺学报,2009,6(2):221-226.
[5] 王薇薇,羊杏平,范淑英,等.甜瓜小孢子发育时期与花器形态关系研究[J].西北农林科技大学学报:自然科学版,2015,43(4):108-111.
[6] 缑艳霞,张明方.西瓜花药离体培养影响因子研究[J].北方园艺,2010(10):117-120.
[7] 李 娟.西瓜花药和小孢子培养研究[D].成都:四川农业大学,2008.
[8] 谢 淼,秦丽颖,潘俊松,等.黄瓜花器形态发生、小孢子发育与花药培养[J].西北植物学报,2005,25(6):1096-1100.
[9] 张菊平,巩振辉,刘珂珂,等.辣椒小孢子发育时期与花器形态的相关性[J].西北农林大学学报:自然科学版,2007,35(3):153-158.
[10]林宗铿,张天翔,杨俊杰,等.白芦笋小孢子发育时期与花器形态相关性研究[J].中国农学通报,2011,27(28):200-204.
[11]杨宏光,孙晓梅,王孝鹏,等.三色堇小孢子发育时期与花器形态相关性分析[J].沈阳农业大学学报,2008,39(5):621-624.
[12]钱春桃,陈劲枫,娄群峰,等.黄瓜花粉母细胞减数分裂行为的研究[J].武汉植物学研究,2003,21(3):193-197.
[13]任明迅.植物雄蕊合生的多样性、适应意义及分类学意义初探[J].植物分类学报,2008,46(4):452-466.
(责任编辑:袁 伟)
Relationship between m icrospore development period and flower organ morphology of bottle gourd(Lagenaria siceraria)
HU Xue-dan1,2, ZHANG Man1, HOU Qian1, XU Jin-hua1, LIU Guang1, YAO Xie-feng1, LIPing-fang1,CHEN Xue-hao2, YANG Xing-ping1
(1.Institute of Vegetable,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China;2.College ofHorticulture and Plant Protection,Yangzhou University,Yangzhou 225009,China)
Researches on the relationship between the gourdmicrospore developmentand flower organmorphologywere carried out to find a way to identify the microspore developmental period quickly and acccurately through observing bottle gourd flower appearance and anthermicrostructure.The results showed thatbottle gourdmicrosporewent through tetrad stage,uninucleate stage,binucleate stage,and finally developed to themature pollen grain.In the growth of plant bud,the flower bud and leaf bud could be differentiated in the first one or two days.The bud size in 6.3-6.7mm weremostly at the uninucleate stage ofmicrospore.At thismoment,the staminal tubeswere shrivelled and suitable for anther andmicrospore culture.In the 3rd or 4th day,the tubes were full,and themicrospore had basically grown intomature pollen grain.The develpoment period of gourd microspore could be determined by themorphology and size of the buds,which helps to define the standard of bud selection corresponding to the optimal stage of anther and microspore culture.
gourd;microspore;developmental stage;flower organ morphology
S642.9
A
1000-4440(2015)06-1407-06
胡雪丹,张 曼,侯 茜,等.葫芦小孢子发育时期与花器形态相关性[J].江苏农业学报,2015,31(6):1407-1412.
10.3969/j.issn.1000-4440.2015.06.033
2015-05-25
国家西甜瓜产业技术体系项目(CARS-NO.8);江苏省农业科技支撑计划项目(BE2012323)
胡雪丹(1990-),女,江苏泰州人,硕士研究生,研究方向为葫芦游离小孢子培养。(E-mail)276518157@qq.com
羊杏平,(E-mail)xingping@jaas.ac.cn
