枸杞酸性转化酶基因的克隆与表达
2015-06-09赵建华李浩霞王华芳王亚军石志刚
赵建华, 李浩霞, 尹 跃, 安 巍, 王华芳, 王亚军, 石志刚
(1.北京林业大学生物科学与技术学院,北京 100083;2.宁夏农林科学院/国家枸杞工程技术研究中心,宁夏银川 750002; 3.宁夏农林科学院荒漠化治理研究所,宁夏银川 750002)
枸杞酸性转化酶基因的克隆与表达
赵建华1,2, 李浩霞3, 尹 跃2, 安 巍2, 王华芳1, 王亚军2, 石志刚2
(1.北京林业大学生物科学与技术学院,北京 100083;2.宁夏农林科学院/国家枸杞工程技术研究中心,宁夏银川 750002; 3.宁夏农林科学院荒漠化治理研究所,宁夏银川 750002)
以枸杞果实为试验材料,利用RACE技术克隆枸杞酸性转化酶基因LbAI的全长cDNA序列,应用生物信息学软件分析LbAI预期编码蛋白质特征;采用气相色谱法和实时荧光定量PCR技术,分析不同发育阶段枸杞果实及不同颜色成熟果实中可溶性糖含量及LbAI在果实中的相对表达量。结果显示:LbAI的cDNA序列全长2 252 bp,开放阅读框(ORF)长1 920 bp,编码642个氨基酸,LbAI编码的蛋白质相对分子量和等电点(pI)分别为70 600和5.9,GenBank登录号为KM191309。进化树分析结果显示,枸杞与马铃薯和番茄的亲缘关系最近,相似性在85%以上。随着果实生长发育,枸杞果实中果糖和葡萄糖含量不断升高,而蔗糖呈现出降低趋势;不同颜色枸杞果实中糖含量差异较大,成熟红色和黄色果实中果糖和葡萄糖含量显著高于黑色果实,但蔗糖含量在黑色果实中最高,在红色果实中最低;LbAI相对表达与果实中葡萄糖含量变化基本一致。表明LbAI基因在枸杞果实糖积累过程中具有重要的作用。
枸杞;酸性转化酶;基因克隆;表达;可溶性糖
枸杞为茄科(Solanaceae)枸杞属(LyciumL.)多年生落叶灌木,具有很强的抗逆性,是改良盐碱地的先锋树种[1-3],其果实中含有丰富的糖类物质[4]。糖是果实品质和风味物质的主要成分,也是色素、氨基酸、维生素和芳香物质等其他营养成分合成的基础原料,还参于新陈代谢和能量供给,并在细胞转导中起着信号分子的作用[5-6]。转化酶是调节蔗糖代谢的关键酶之一,在枸杞糖积累过程中发挥着主要作用[7-8]。因此,克隆枸杞转化酶基因,对其进行生物信息学和表达特性分析,进一步研究转化酶在枸杞果实发育过程中糖积累的作用具有重要意义。
转化酶广泛存在于高等植物中,不同组织存在着多种转化酶同工酶形式,主要包括酸性转化酶(AI)和碱性或中性转化酶(NI)。酸性转化酶可分为可溶性酸性转化酶和不可溶性酸性转化酶[9-10]。可溶性酸性转化酶主要存在于液泡中,其活性升高常与植物幼嫩组织的快速生长、贮藏器官的迅速膨大相关,其机理可能是蔗糖被AI分解为果糖和葡萄糖,导致液泡渗透压升高,从而诱导液泡生长和细胞分裂[11-12]。AI酶活性的缺乏是蔗糖积累的先决条件,酶活性高于临界阀值时将不再积累高浓度的蔗糖,主要起分解蔗糖作用[13]。枸杞果实转色前后枸杞果实中AI活性明显升高,糖的积累以葡萄糖和果糖为主[14],在成熟宁夏枸杞果实中,葡萄糖和果糖含量与AI和NI均呈极显著正相关,糖积累也以果糖和葡萄糖为主,且蔗糖含量很低[7,15]。王丽娟等[16]以宁夏枸杞为试验材料,克隆得到了枸杞可溶性酸性转化酶(SAI)的全长,并发现该基因在枸杞花中表达量最高,在根中表达水平较低。有关枸杞酸性转化酶(LbAI)分子水平研究相对滞后,克隆的枸杞SAI基因在果实不同发育时期基因表达与糖含量的关系及其参与果实糖积累的分子机制鲜有报道。本研究采用RACE-PCR技术克隆枸杞AI的cDNA全长,并用生物信息学分析该基因的序列特征。在此基础上,利用GC法和qRT-PCR技术分别对不同发育阶段枸杞果实中糖含量及LbAI相对表达量进行测定分析,以期为枸杞果实糖积累的分子机理研究提供理论基础。
1 材料与方法
1.1 供试材料
试验以国家枸杞工程技术研究中心枸杞种质资源圃保存的宁杞1号、黄果枸杞和黑果枸杞十年生枸杞树为材料。采集宁杞1号开花后9 d、15 d、22 d、27 d和34 d的果实,黄果枸杞和黑果枸杞采集成熟果实,并分别进行糖含量测定和荧光定量分析。所有供试材料采样后迅速置于液氮中,在-80℃冰箱保存。
1.2 试验方法
1.2.1 总RNA的提取及第一链cDNA的合成 采用Trizol提取液提取宁杞1号成熟果实中总RNA,提取过程参照Trizol试剂盒(天根生化科技有限公司产品)说明书进行。cDNA第一链的合成使用试剂盒RevertAid First Strand cDNA Synthesis Kit& DNase I(Thermo Scientific公司产品)完成。
1.2.2 目的基因中间片段克隆 根据NCBI公布的茄科植物(马铃薯、番茄、烟草等)酸性转化酶基因保守区的核苷酸序列,运用Primer 5.0软件设计兼并引物F1和R1(表1)。PCR扩增体系(50.0 μl),包括10×PCR bufferEx Taq5.0 μl、dNTP(2 mmol/L)5.0 μl、上下游引物各(10 μmol/L)2.0 μl、模板cDNA 1.0 μl、Ex Taq(5 U/μl)0.5 μl、dd H2O 34.5 μl。反应程序为94℃预变性5 min;98℃变性10 s,60℃退火30 s,68℃延伸1 min 30 s, 30个循环;68℃延伸5 min。PCR产物纯化后与载体pMD18T(TaKaRa公司产品)进行连接,然后转到感受态细胞上,挑选阳性克隆送到华大基因测序。
1.2.3 目的基因5′端序列克隆 根据克隆出中间片段,设计引物GSP1、GSP2和GSP3(表1)。采用Invitrogen公司的5′RACE System for Rapid Amplification of cDNA Ends(Version 2.0)试剂盒进行目的基因的5′端序列克隆。使用SUPERSCRIPTⅡRT酶和引物GSP1对总RNA进行目的基因第一链cDNA的合成,用RNase Mix对合成的cDNA进行去RNA处理,使用DNA纯化系统对经RNAase处理过的cDNA进行纯化,然后,用TdT酶和dCTP对纯化后的cDNA进行末端加上多聚C(dC)。以引物GSP2和试剂盒里自带的桥连铆钉引物AAP对已经加dC尾的cDNA进行PCR第一轮扩增,扩增体系(50.0 μl),包括ddH2O 31.5 μl、10×PCR buffer 5.0 μl、MgCl2(25 mmol/L)3.0 μl、dNTP(10 mmol/L) 1.0 μl、GSP2(10 μmol/L)2.0 μl、Abridged Anchor Primer(10 μmol/L)2.0 μl、dC-tailed cDNA 5.0 μl、DNA聚合酶(5 U/μl)0.5 μl。扩增程序为94℃预变性2 min;94℃变性为1 min,55℃退火45 s,72℃延伸1.2 min,35个循环;72℃延伸5 min。取出第一轮PCR产物5 μl,用引物GSP3和试剂盒里自带的通用扩增引物AUAP进行巢式PCR第二轮扩增,扩增程序为94℃预变性2 min;94℃变性为1 min,54℃退火45 s,72℃延伸1 min,35个循环; 72℃延伸5 min,5℃保存。PCR产物纯化后与载体pMD18T(TaKaRa公司产品)进行连接,然后转到感受态细胞上,挑选阳性克隆送到深圳华大基因科技有限公司测序。
1.2.4 目的基因3′端序列克隆 根据克隆出的中间片段,设计引物3′461-1和3′461-2(表1)。采用Clontech公司生产的SMARTerTMRACE cDNA Amplification Kit试剂盒进行目的基因的3′端序列克隆。使用逆转录酶SMARTScribeTMReverse Transcriptase和引物3′CDS primer A对总RNA进行逆转录合成cDNA,以引物3′461-1和UPM,对合成的cDNA为模板进行第一轮PCR扩增,扩增体系(50 μl),包括ddH2O 31.0 μl、10×Advantage 2 PCR buffer 5.0 μl、50×Advantage 2 Polymerase Mix 1.0 μl、dNTP(10 mmol/L)1.0 μl、3′461-1引物(10 μmol/L)2.0 μl、UPM引物(10X)5.0 μl、cDNA 5.0 μl。扩增程序为94℃变性4 min;94℃30 s,72℃3 min,5个循环;94℃30 s,70℃30 s,72℃3 min, 5个循环;94℃30 s,68℃30 s,72℃3 min,27个循环。将第一轮PCR扩增产物稀释50倍后,用引物3′461-2和UPM进行第二轮PCR扩增。扩增程序为94℃变性4 min;94℃30 s,72℃3 min,5个循环;94℃30 s,70℃30 s,72℃3 min,5个循环; 94℃30 s,68℃30 s,72℃3 min,27个循环,5℃保存。PCR产物纯化后与载体pMD18T(TaKaRa公司产品)进行连接,然后转到感受态细胞上,挑选阳性克隆送到深圳华大基因科技有限公司测序。
1.2.5 全长cDNA拼接验证 运用ContigExpress软件对酸性转化酶基因的中间片段、5′片段、3′片段进行拼接,利用NCBI网站上Open Reading Frame Finder软件对拼接结果进行编码区分析。在编码区序列两端设计1对引物F2和R2(表1),对拼接结果进行PCR扩增验证。扩增体系(50.0 μl):包括10×PCR bufferEx Taq5.0 μl、dNTP(2 mmol/L)5.0 μl、引物各(10 μmol/L)2.0 μl、模板cDNA 1.0 μl、Ex Taq(5 U/μl)0.5 μl、ddH2O 34.5 μl。扩增程序为94℃变性4 min;94℃30 s,55℃30 s,72℃3min,35个循环;72℃10 min,5℃保存。PCR产物纯化后与载体pMD18T(TaKaRa公司产品)进行连接,然后转到感受态细胞上,挑选阳性克隆送到深圳华大基因科技有限公司测序。
1.2.6 生物信息学分析 利用网站(http:// www.expasy.ch/tools/pi_tool.html)分析LbAI基因所编码蛋白质的等电点和分子量,并利用DNAStar软件生成LbAI氨基酸序列进化树,分析其进化关系。利用MEGA5.0软件进行基因氨基酸序列同源性比较。
1.2.7 实时荧光定量表达分析 根据LbAI的全长cDNA序列设计PCR引物F3和R3(表1),以枸杞18S基因作为内参基因,设计引物18S-F和18S-R (表1)。不同发育阶段枸杞果实和不同颜色枸杞果实RNA提取第一链cDNA的合成按照方法1.2.1进行,采用BIO-RAD CFX ConnectTM荧光定量PCR检测系统进行试验,使用Power SYBR®Green PCR Master Mix(Applied Biosystems®)试剂,反应体系为2×SYBR PCR Mix 10.0 μl、正反向引物各0.5 μl、cDNA 0.5 μl,加水至20.0 μl,每个样品设计3个重复。反应程序为95℃预变性3 min;95℃10 s,55℃30 s,72℃30 s,40个循环;65℃开始以1 s 0.5℃逐步升温至95℃。反应完成后进行溶解曲线分析,参照2-△△CT法计算基因的相对表达量。
1.2.8 可溶性糖测定 参照Zhao等[4]方法,用气相色谱法测定枸杞果实中的可溶性糖含量。采用Microsoft Excel 2003对可溶性糖含量和相对表达量进行作图分析。

表1 所用引物序列Table 1 Primes used in the experiment
2 结果与分析
2.1 枸杞LbAI的克隆与分析
在NCBI中依据登录的茄科植物酸性转化酶基因的保守区域设计兼并引物F1和R1,克隆出枸杞AI中间片段(图1),测序结果为830 bp。根据得到的中间保守序列设计5′和3′末端的RACE引物,5′端片段测序结果为502 bp(图1),3′端片段测序结果1 058 bp(图1)。将克隆到的3个部分片段利用ContigExpress软件进行拼接,获得了枸杞AI基因全长cDNA序列,全长2 190 bp,其中ORF为1 920 bp,编码642个氨基酸。在编码区设计引物F2和R2, PCR扩增产物见图1,测序结果为2 252 bp,与拼接结果的编码区大小相符,说明拼接结果正确,该基因命名为LbAI,GenBank登录号为KM191309。
2.2 枸杞LbAI氨基酸序列及进化树分析
枸杞LbAI的cDNA序列及其推导氨基酸组成如图2所示,利用DNAStar、ORF Finder和BioXM软件分析,该序列含有完整的开放阅读框,编码642个氨基酸,起始密码子为ATG,终止密码子为TAA,编码产物的分子量为70 600,等电点为5.9;其中酸性氨基酸(Asp+Glu)60个,碱性氨基酸(Arg+Lys)50个。脂肪系数为84.19,不稳定参数为40.21,根据不稳定参数值在40以下为稳定蛋白质,可推断LbAI所编码的蛋白质为不稳定蛋白质。
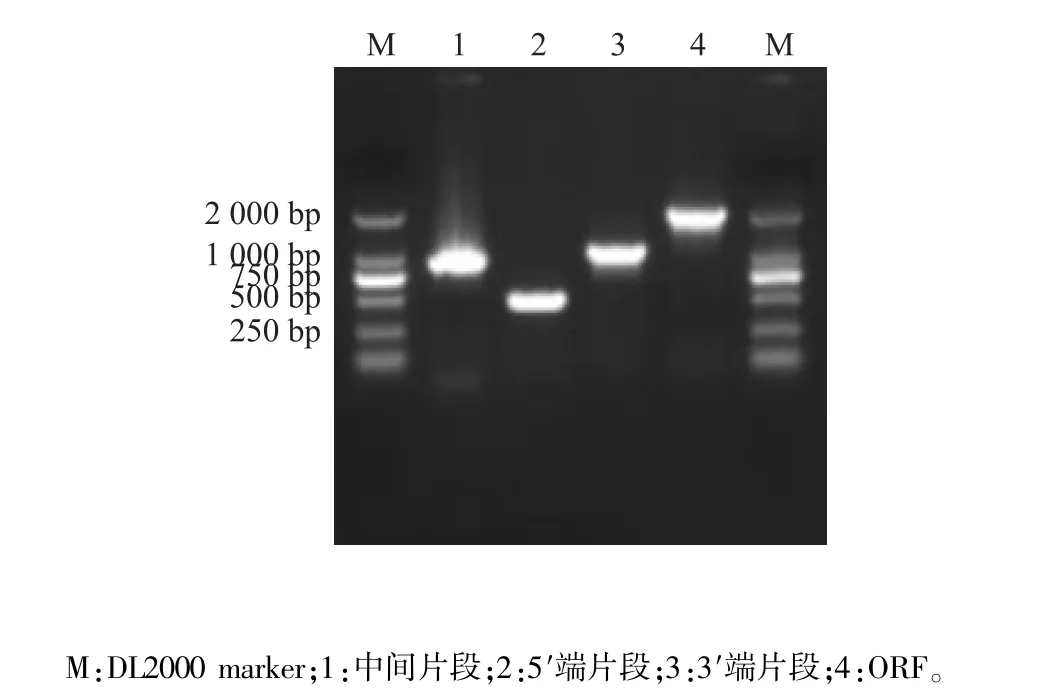
图1 枸杞LbAI的中间片段、5′片段、3′片段和全长PCR电泳图Fig.1 Agarose gel electrophoresis of PCR product in intermediate,5′RACE,3′RACE and full-length of LbAI gene
经过NCBI网站和BLAST比对,发现LbAI的核苷酸序列与马铃薯(ABF18956.1)、番茄(ADE44160.1)和甜瓜(ABX55832.1)的LbAI核苷酸序列相似性较高,分别为86%、85%和85%;与水稻(AAD10239.1)和苜蓿(AES90955.2)的LbAI核苷酸序列相似性较低,分别为66%和60%。将枸杞与以上5个物种进行氨基酸序列多重比对(图3),利用Mega6.06软件将LbAI与NCBI检索的酸性转化酶进行氨基酸序列比对,并构建系统进化树,结果(图4)显示,枸杞与马铃薯、番茄等茄科植物亲缘关较近;与梨和苜蓿等关系较远。

图2 枸杞LbAI基因的cDNA序列及其所推导氨基酸序列Fig.2 The cDNA sequence and deduced amino acid sequence of LbAI gene

图3 枸杞LbAI基因编码的氨基酸序列与其他物种同源氨基酸序列多重比对Fig.3 Alignment of the deduced amino acid sequences of wolfberry LbAI and other species

图4 枸杞LbAI基因编码的氨基酸序列与其他植物LbAI基因编码的氨基酸序列的发育树分析Fig.4 Phylogenetic tree of wolfberry and other species based on LbAI amino acid sequence
2.3 枸杞LbAI表达分析
2.3.1 不同发育阶段枸杞果实中LbAI表达模式
通过qRT-PCR研究LbAI在不同发育阶段枸杞果实中表达情况(图5A),并利用气相色谱法分析不同发育阶段枸杞果实中果糖、葡萄糖和蔗糖含量变化(图5B)。发现LbAI在开花后9~14 d相对表达量显著降低,在开花后14~25 d表达量缓慢降低,在开花后25 d达到最低,之后快速升高,开花后34 d(果实成熟期)的LbAI相对表达量升至最高。
糖含量测定结果(图5B)显示,枸杞果实中果糖和葡萄糖含量随着果实生长发育逐渐升高,在开花后34 d(果实成熟期)的升至最高,即为40.7 mg/g和2.49 mg/g;果实中蔗糖含量随着果实生长发育逐渐降低,在开花后34 d的降至最低,即为0.68 mg/g。比较分析不同发育阶段枸杞果实中LbAI表达量与果实中果糖、葡萄糖和蔗糖含量变化的关系,发现果实中LbAI表达量与果糖和葡萄糖含量成线性正相关,相关系数为0.627和0.748,而与蔗糖含量成线性负相关,相关系数为-0.519。可见,在果实发育过程中,LbAI对果实中葡萄糖含量影响较大。

图5 不同发育时期枸杞果实中LbAI基因表达量及糖含量Fig.5 Expression level of LbAI and sugar contents in wolfberry fruits at different growth and developmental stages
2.3.2 不同颜色果实中LbAI表达模式 通过对不同颜色枸杞成熟果实中LbAI的qRT-PCR分析(图6A),发现该基因在黄色果实中相对表达量最高,在黑色果实中最低,红色果实居中,其中,黄色果实中表达量是红色果实的1.1倍,是黑色果实的300倍。分析不同颜色枸杞成熟果实中糖含量变化,结果(图6B)显示,果糖在红色果实中最高,为40.7 mg/g;葡萄糖在黄色果实中最高,为2.8 mg/g;果糖与葡萄糖在黑色果实中均最低,分别为7.7 mg/g和1.1 mg/g)。蔗糖在黑色果实中最高,为1.38 mg/g;在红色果实中最低,为0.68 mg/g。比较不同颜色枸杞果实中LbAI表达量与果实中果糖、葡萄糖和蔗糖含量变化的关系,发现果实中LbAI表达量与果糖、葡萄糖含量成线性正相关,相关系数分别为0.496和0.996,而与蔗糖含量成线性负相关,相关系数为-0.995。可见,LbAI对不同颜色果实中葡萄糖和蔗糖含量影响较大。

图6 不同颜色枸杞果实中LbAI基因表达量及糖含量Fig.6 Expression level of LbAI and sugar contents in differently-coloured fruit of wolfberry
3 讨论
自从胡萝卜中分离出第一个酸性转化酶基因[17]以来,现已从番茄[18]、马铃薯[19]、拟南芥[20]、葡萄[21]、甜瓜[12]、甘蔗[22]等多种作物中分离到编码该酶的全长或部分核苷酸序列。这些基因分为两大类:一类是碱性等电点的与细胞壁紧密相连转化酶,另一类是酸性等电点的液泡酸性转化酶[23]。本研究通过同源克隆法从宁夏枸杞果实中成功获得AI的cDNA序列,并拥有完整的编码框,根据AI基因编码的氨基酸序列分析,枸杞与其他茄科物种具有很高的同源性。利用PSORT在线服务器进行AI基因所编码蛋白质亚细胞定位,发现该蛋白质可能位于液泡上,可见,LbAI属于液泡酸性转化酶基因。
本研究通过qRT-PCR技术,分析宁夏枸杞不同发育阶段果实中LbAI表达特征,发现随着果实生长发育LbAI表达水平呈现出高-低-高趋势,其中,成熟果实中LbAI高度表达,且显著高于其他发育阶段。这与番茄TIAI在成熟果实中高度表达相一致[24],但不同于甜橙AI在果实成熟过程中的逐渐减弱表达[25]。本研究发现LbAI表达高峰在枸杞果实成熟期。前人对玉米[26]和木薯[27]的转化酶基因的研究也得出相似的结论。本研究对不同颜色成熟枸杞果
实中LbAI的表达分析发现LbAI在3份枸杞材料中都有表达,且在黄色果实中表达量最高,在黑色果实中最低,红色果实居中。这些结果表明LbAI参与不同颜色枸杞果实的生长发育,其在黄色果实中的高表达有利于促进果糖积累,这与AI参与甘蔗和甜橙调节果实中糖分积累[22,28]相一致,但该基因是否与枸杞果实花色素苷生物合成有关需要进一步研究。本研究测定了宁夏枸杞不同发育阶段和不同颜色果实中糖含量,随着果实的发育果糖和葡萄糖含量显著升高,而蔗糖含量不断降低,这与其他研究一致[4],且果糖和葡萄糖含量和LbAI表达量从开花后
14 d大体上呈现出相似变化趋势,在果实成熟期两者均达到最高值;不同颜色果实中糖含量为红色果实果糖含量最高,黄色果实中葡萄糖含量最高,黑色果实中两者含量均最低。枸杞果实中葡萄糖含量和
LbAI表达量呈现出较高的一致性(r=0.996**),这说明LbAI对枸杞果实中糖积累具有主要作用。有关果实中LbAI是否还有其他功能还有待于进一步的研究。
[1] 白守宁.宁夏枸杞研究[M].宁夏:宁夏人民出版社,1999.
[2] 尚 洁,赵海燕,朱武政.枸杞DFR基因cDNA片段的克隆及生物信息学分析[J].江苏农业科学,2013,41(10):33-37.
[3] 张培通,郭文琦,李春宏.枸杞在江苏沿海滩涂盐碱地的应用前景及实用栽培技术[J].江苏农业科学,2014,42(3):197-199.
[4] ZHAO J H,LI H X,XI W P,et al.Changes in sugars and organic acids in wolfberry(Lycium barbarumL.)fruit during develop ment and maturation[J].Food Chemistry,2015,173(2015): 718-724.
[5] STADLER R,TRUERNIT E,GAHRTZ M,et al.The AtSUC1 sucrose carrier may represent the osmotic driving force for anther dehiscence and pollen tube growth inArabidopsis[J].The Plant Journal,1999,19(3):269-278.
[6] TEIXEIRA R T,KNORPP C,GLIMELIUS K.Modified sucrose, starch,and ATP levels in two alloplasmic male-sterile lines ofB. napus[J].Journal of Experimental Botany,2005,56(414): 1245-1253.
[7] 郑国琦,罗 霄,郑紫燕,等.宁夏枸杞果实糖积累和蔗糖代谢相关酶活性的关系[J].西北植物学报,2008,28(6):1172-1178.
[8] 赵建华,李浩霞,周 旋,等.干旱胁迫对宁夏枸杞生长及果实糖分积累的影响[J].植物生理学报,2012,48(11):1063-1068.
[9] ROITSCH T,GONZALEZ M C.Function and regulation of plant invertases:sweet sensations[J].TRENDS in Plant Science, 2004,9(12):606-613.
[10]STURM A.Primary structures,functions,and roles in plant development and sucrose partitioning[J].Plant Physiology,1999, 121:l-8.
[11]YAMADA Y,KOJIMA T,BANTOG N,et al.Cloning of two isoforms of soluble acid invertase of Japanese pear and their expression during fruit development[J].Journal of Plant Physiology, 2007,164(6):746-755.
[12]TIAN H M,KONG Q G,FENG Y Q,et al.Cloning and characterization of a soluble acid invertase-encoding gene from muskmelon[J].Molecular Biology Reports,2009,36:611-617.
[13]ZHU Y J,ALBERT H H,MOORE P H.Differential expression of soluble acid invertase genes in the shoots of high-sucrose and lowsucrose species ofSaccharumand their hybrids[J].Australian Journal of Plant Physiology,2000,27:193-199.
[14]冯 美,孙慧芳.枸杞果实转色前后糖积累与相关酶活性的研究[J].宁夏农林科技,2007(4):9-10.
[15]郑紫燕,郑国琦,罗 霄,等.宁夏枸杞叶片、果柄、果实糖积累与蔗糖代谢相关酶活性研究[J].西北农业学报,2009,18 (4):332-338.
[16]王丽娟,赵 辉,王彦才,等.枸杞酸性转化酶基因的克隆及组织表达分析[J].北方园艺,2014(1):86-90.
[17]STURM A,CHRISPEELSB M J.cDNA cloning of carrot extracellular beta-fructosidase and its expression in response to wounding and bacterial infection[J].The Plant Cell,1990,2(11):1107-1119.
[18]KLANN E,YELLE S,BENNETT A B.Tomato fruit acid invertase complementary DNA[J].Plant Physiol,1992,99(1):351-353.
[19]HEDLEY P E,MACHRAY G C,DAVIES H V,et al.Potato (Solanum tuberosum)invertase-encoding cDNAs and their differential expression[J].Gene,1994,145(2):211-214.
[20]SCHWEBEL-DUGUÉ N,MTILI N E,KRIVITZKY M,et al.Arabidopsis gene and cDNA encoding cell-wall invertase[J].Plant Physiol,1994,104(2):809-810.
[21]DAVIES C,ROBINSON S P.Sugar accumulation in grape berries:cloning of two putative vacuolar invertase cDNAs and their expression in grapevine tissues[J].Plant Physiology,1996,111 (1):275-283.
[22]牛俊奇,王爱勤,黄静丽,等.甘蔗可溶性酸性转化酶(SoSAI1)基因的克隆及表达分析[J].中国农业科学,2013,46(24): 5248-5260.
[23]TYMOWSKA-LAKANNE Z,KREIS M.The plant invertase: physiology,biochemistry and molecular biology[J].Adv Bot Res, 1998,28:71-117.
[24]GODT D E,ROITSCHT.Regulation and tissue-specific distribution of mRNAs for three extracellular invertase isoenzymes of tomato suggests an important function in establishing and maintaining sink metabolism[J].Plant Physiol,1997,115(1):273-282.
[25]王滕旭,李正国,杨迎伍,等.哈姆林甜橙蔗糖合酶Ⅰ和酸性转化酶基因表达与果实糖积累的关系[J].热带作物学报, 2010,31(5):745-749.
[26]MCLAUGHLIN J E,BOYER J S.Sugar-responsive gene expression,invertase activity,and senescence in aborting maize ovaries at low water potentials[J].Annals of Botany,2004,94(5): 675-689.
[27]YAO Y,WU X H,GENG M T,et al.Cloning,3D modeling and expression analysis of three vacuolar invertase genes from cassava (Manihot esculentaCrantz)[J].Molecules,2014,19:6228-6245.
[28]聂元冬,刘 洋,顿宝庆,等.甜高粱可溶性酸性转化酶基因(SAI-1)cDNA全长克隆及表达分析[J].分子植物育种, 2014,12(2):262-269.
(责任编辑:袁 伟)
Cloning and expression of acid invertase gene(LbAI)in wolfberry(Lycium barbarum L.)
ZHAO Jian-hua1,2, LI Hao-xia3, YIN Yue2, AN Wei2, WANG Hua-fang1, WANG Ya-jun2, SHI Zhi-gang2
(1.College of Biological Sciences and Technology,Beijing Forestry University,Beijing100083,China;2.Ningxia Academy of Agricultural and Forestry Sciences/National Wolfberry Engineering Research Center,Yinchuan 750002,China;3.Desertification Control Research Institute,Ningxia Academy of Agricultural and Forestry Sciences,Yinchuan 750002,China)
The acid invertase gene(LbAI)full-length cDNA sequence from the fruits of wolfberry(Lycium barbarum L.)was clone by rapid amplification of cDNA ends(RACE),the features of LbAI-encoded protein were analyzed by bioinformatics software,and the patterns of gene expression and accumulation of soluble sugars at different fruits growth stages and differently-colored fruits of wolfberry were analyzed by real-time fluorescent quantitative PCR(qRT-PCR)and gas chromatography(GC).The full length of LbAI cDNA sequence was 2 252 bp,containing a 1920 bp open reading frame(ORF)which encoded 642 amino acids with a relative molecular mass of 70 600 and isoelectric point (pI)of 5.9.The phylogenetic tree showed that LbAI had the closest genetic relationship with Solanum tuberosum and S.lycopersicum,with the similarities above 85%.The contents of glucose and fructose increased along with thefruit growth and development,while sucrose content declined.The contents of glucose and fructose in red and yellow fruits were significantly higher than those in black fruit at maturity.The content of sucrose in black fruit was the highest and in red fruit was the lowest.The expression level of LbAI was consistent with the glucose content in fruits.It was suggested that LbAI might play an important role in sugar accumulation of wolfberry fruits.
wolfberry;acid invertase;gene cloning;expression;soluble sugar
S567;Q785
A
1000-4440(2015)05-1140-09
赵建华,李浩霞,尹 跃,等.枸杞酸性转化酶基因的克隆与表达[J].江苏农业学报,2015,31(5):1140-1148.
10.3969/j.issn.1000-4440.2015.05.031
2015-03-09
国家自然科学基金项目(31360191、31060104);宁夏自然科学基金项目(NZ13125);宁夏农林科学院科技创新先导基金项目(NKYJ-14-07)
赵建华(1977-),男,甘肃靖远人,博士,副研究员,主要从事枸杞种质创新与利用研究。(Tel)0951-6886792; (E-mail)zhaojianhua0943@163.com
王华芳,(E-mail)hfwang@bjfu.edu.cn
