海洋扩展青霉(Penicillium expansum)果胶酶的纯化及酶学性质研究
2015-06-09潘仁瑞蔡敬民
吴 爽,张 敏,潘仁瑞,蔡敬民,
(1.安徽农业大学生命科学学院,合肥230036;2.合肥学院生物与环境工程学院,合肥230601)
海洋扩展青霉(Penicillium expansum)果胶酶的纯化及酶学性质研究
吴 爽1,张 敏2,潘仁瑞2,蔡敬民1,2
(1.安徽农业大学生命科学学院,合肥230036;2.合肥学院生物与环境工程学院,合肥230601)
通过超滤、DEAESephadex A-50离子交换层析、Sephadex G-100凝胶过滤层析,对一株来自海洋的扩展青霉(Penicillium expansum)所产果胶酶进行分离纯化,得到电泳纯的果胶酶,经SDS-PAGE电泳显示单一条带,且果胶酶亚基的分子质量约为63.96 ku,纯化倍数为24.13,回收率为36.32%。酶学性质研究结果表明,该果胶酶的最适反应温度为50℃,最适pH值5.4,在pH值4.6~6.2比较稳定,Mg2+、Ca2+对果胶酶活力有明显激活作用,Cu2+有明显抑制作用,以果胶粉为底物的Vmax为393.56μg/(m in·m L),Km为3.34mg/m L。
海洋扩展青霉;果胶酶;分离纯化;酶学性质
果胶酶(Pectinase)是指能够分解果胶质的一类酶的总称,包括聚半乳糖醛酸酶、果胶酯酶、果胶裂解酶等[1-2]。果胶酶广泛应用于果汁澄清、木材防腐、麻类脱胶、棉织物精练、天然药物活性成分提取、饲料加工、茶叶发酵、环保等领域[3-7]。国外对果胶酶的研究始于20世纪30年代,在菌种选育、发酵优化、纯化等领域已经取得了很多成果,中国从20世纪60年代开始研究果胶酶,目前生产的果胶酶纯度不高,多数要依赖进口,工业化生产落后于法国、德国、荷兰、丹麦、意大利等果胶酶的主要生产国[2],然而中国海域辽阔,微生物资源非常丰富,因此利用高产果胶酶的海洋微生物生产果胶酶,并探索高效的纯化工艺,成为提高中国工业果胶酶品质的重要途径。
目前,果胶酶已被学者们广泛研究,已发现许多霉菌和少量细菌以及酵母菌都可以产生果胶酶,国内外科学家利用盐析、层析、液相色谱、电泳等手段对果胶酶进行纯化,研究表明,果胶酶分子质量一般在20 ku~60 ku之间,活性范围在pH值3.0~9.0之间,大部分果胶酶的最适作用温度在45℃左右[8-10]。
很多学者是从腐烂的果蔬或者果园泥土中筛选出产果胶酶的菌株[1,7,11]进行研究,对于海洋来源的产果胶酶菌株的研究鲜有报道,本文从实验室保藏的一株来自海洋的扩展青霉(Penicillium expansum)出发,对其所产果胶酶进行分离纯化,并对果胶酶的酶学性质进行了研究,旨在探索出一条高效、低耗、简捷的果胶酶纯化新工艺。同时本文所利用的果胶酶生产菌来自海洋,为新型酶制剂的开发提供了理论指导。
1 材料与方法
1.1 菌株及培养基
菌株:扩展青霉(Penicillium expansum),分离自浙江苍南海域的海水,保藏于本实验室。
种子培养基:PDA培养基
固态发酵培养基:麸皮7 g,果胶粉0.42 g,氯化铵0.28 g,人工海水[9]8.4m L,pH值自然,121℃灭菌20m in。
液态培养基:硝酸钠0.3 g,磷酸氢二钾0.1 g,MgSO4·7H2O 0.05 g,氯化钾0.05 g,硫酸亚铁0.001 g,蔗糖3 g,琼脂2 g,果胶粉1 g,蒸馏水100m L,加热溶解,121℃灭菌20m in。
1.2主要试剂及仪器
牛血清白蛋白、DEAESephadex A-50、Sephadex G-100、低分子量标准蛋白,上述试剂均购自Sigma公司。
752型紫外-可见分光光度计,上海光谱仪器股份有限公司;自动部分收集器:BSA-160型,上海沪西分析仪器厂;DYY-6C型电泳仪,北京六一仪器厂。
1.3果胶酶活力测定
采用DNS法,参考文献[13]作适当修改。
半乳糖醛酸标准曲线:精确配置1.5mg/m L的半乳糖醛酸溶液,取8支试管,分别加入0.1m L、0.2m L~0.8 m L的半乳糖醛酸溶液,分别用蒸馏水定容至1 m L,每个试管均加入3m L DNS溶液,沸水浴10m in,迅速冷却,蒸馏水定容至20m L,540 nm波长处测定吸光值,以1m L蒸馏水作为空白对照。每管重复3次,取平均值,以半乳糖醛酸含量为横坐标,吸光值(D540nm)为纵坐标,绘制标准曲线,如图1所示。得到半乳糖醛酸标准曲线的回归方程为y=0.85762 x-0.02689,相关系数R2=0.99873。
取0.2m L适当稀释的酶液于试管中,50℃水浴平衡5min,加入1.8m L水浴平衡过的0.4%的果胶底物溶液,50℃水浴反应30min后,加3m LDNS试剂终止反应,沸水浴10m in,冷却后蒸馏水定容到20m L,摇匀;以灭活的酶液做空白对照。在540 nm波长处测定吸光度。结合上述标准曲线,在上述反应体系中,以每毫升酶液1min降解果胶底物产生1μg半乳糖醛酸定义为1个酶活力单位(U)。
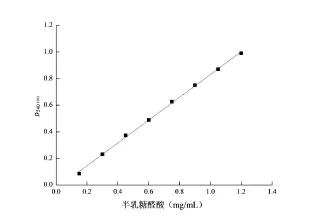
图1 半乳糖醛酸标准曲线Fig 1 Standard curve of galacturonic acid
1.4 蛋白含量的测定
按Bradford法[14],以牛血清白蛋白为标准蛋白绘制标准曲线。
1.5海洋扩展青霉产果胶酶方式的确定
250m L三角瓶中装50m L液态培养基,灭菌,冷却,接种4m L孢子悬液(3×107个/m L),28℃恒温培养3 d,将发酵液于4℃,10000 r/m in离心10m in,分别收集上清液和菌体。菌体用生理盐水重悬,离心,反复清洗几次后,悬浮于同发酵上清液等体积的生理盐水中,加入溶菌酶,37℃水浴1 h[15],使细胞破碎,细胞内含物扩散出来,并于4℃,10000 r/m in离心10m in,取上清液,分别测定发酵上清液和细胞内含物上清液的酶活力。
1.6 果胶酶的纯化
1.6.1粗酶液的制备
按发酵培养基配方配制培养基并接种2m L(107个/ m L)孢子悬液,28℃条件下培养3 d取出,每瓶固态发酵酶曲中倒入50m L pH值5.4,0.04mol/LNa2HPO4~0.02 mol/L柠檬酸缓冲液,室温浸提1 h,浸提液用6层纱布过滤,再经4℃,10000 r/min离心10min,去除残留的菌丝体及杂质,上清液即为粗酶液。
1.6.2超滤
取粗酶液,分别使用截留分子质量为100 ku和30 ku的超滤膜对上清液进行超滤,取分子质量在30 ku和100 ku之间的部分备用。
1.6.3DEAESephadex A-50离子交换层析
将上述所得酶液在 pH值 5.4,0.04 mol/L Na2HPO4~0.02 mol/L柠檬酸缓冲液中透析后,用PEG20000浓缩,再经4℃,10000 r/m in离心10m in,取上清液,上样于相同缓冲液平衡好的DEAE-Sephadex A50离子交换层析柱(1.6 cm×30 cm,床层体积50m L),用0~1mol/LNaCl和上述缓冲液进行线性梯度洗脱,流速1m L/m in,每管5m L,收集有酶活力的蛋白峰[9],超滤浓缩后备用。
1.6.4 Sephadex G-100凝胶过滤层析
上述所得酶液经4℃,10000 r/min离心10min后,上清液上样15m L于pH值5.4,0.04mol/L Na2HPO4~0.02mol/L柠檬酸缓冲液平衡后Sephadex G-100凝胶过滤层析柱(2.6 cm×100 cm)[16],用同样的缓冲液洗脱,流速为0.3m L/min,收集有酶活力的蛋白峰,透析浓缩。
1.7纯度鉴定及分子量的测定
利用SDS-PAGE电泳[17]测定酶的分子量,浓缩胶3%,分离胶12%,起始电压为200V,进入分离胶后,电压调整为150V,考马斯亮蓝R250染色。
1.8酶学性质
1.8.1最适反应温度及温度稳定性
果胶酶与底物在不同温度(30℃、40℃、50℃、60℃和70℃)下反应,测定酶活力,得最适反应温度;将果胶酶在不同温度(30℃、40℃、50℃、60℃和70℃)下保温120m in,每隔20m in测1次酶活力,研究果胶酶的温度稳定性。
1.8.2最适反应pH值及稳定性
果胶酶与不同pH值(3.0、3.8、4.6、5.0、5.4、5.8、6.2、7.0、7.8和8.6)的缓冲液所配制的果胶底物反应,测定酶活力,得果胶酶的最适反应pH值;将果胶酶用不同pH值(3.0、3.8,4.6、5.0、5.4、5.8、6.2、7.0、7.8和8.6)的缓冲液处理2 h后,测定酶活力,研究果胶酶的pH稳定性。
1.8.3不同金属离子对果胶酶的影响
向酶反应体系中分别加入不同金属离子(Mg2+、Cu2+、Zn2+、Ca2+、Al3+、Fe2+、Mn2+、K+)[18],使其在体系中的浓度为2mmol/L,测定酶活力。
1.8.4果胶酶动力学常数的测定
果胶酶分别与不同浓度(0.1%、0.2%、0.3%、0.4%、0.5%和0.6%)的果胶底物在最适条件下反应,测定酶活力,根据Lineweave-Burk双倒数法作图,利用公式1/V=1/V max+(K m/V max)·(1/〔S〕),求出果胶酶的动力学常数[19]。
1.9 数据处理方法
使用Spss20.0中的LSD法进行方差分析和多重比较。
2 结果与分析
2.1海洋扩展青霉产果胶酶方式的确定
检测到细胞内含物上清液中酶活几乎为0,发酵上清液有较高酶活力,说明该果胶酶为胞外酶。

图2 果胶酶DEAE Sephadex A-50离子交换层析图Fig 2 Elution profileof pectinaseon DEAESephadex A-50 column
2.2 DEAESephadex A-50离子交换层析如图2所示,超滤后的酶液经DEAESephadex A-50离子交换层析后,出现3个蛋白峰,检测到第3个峰有酶活,前2个蛋白峰没有酶活,为杂蛋白,离子交换层析是根据吸附力大小分离蛋白质的,第1个峰处的杂蛋白吸附力最小,先被洗脱下来,果胶酶的吸附力大,最后被洗脱下来,前2个峰处的杂蛋白分子量可能比果胶酶分子量小,也可能比果胶酶分子量大。
2.3 Sephadex G-100凝胶过滤层析

图3 果胶酶Sephadex G-100凝胶过滤层析图Fig 3 Elution profileof pectinaseon Sephadex G-100 column
离子交换层析后,收集有酶活的第3个蛋白峰,经Sephadex G-100凝胶过滤层析后,出现3个较明显的蛋白峰,如图3所示,检测到第2个蛋白峰有酶活,为果胶酶所在的峰,另外2个蛋白峰没有酶活,为杂蛋白,根据凝胶过滤层析的原理,大分子先被洗脱下来,小分子后被洗脱下来,说明第1个峰处的杂蛋白分子量大于果胶酶分子量,第3个峰处的杂蛋白分子量小于果胶酶分子量,且从图2可以看出,杂蛋白含量明显比果胶酶含量低。
2.4 果胶酶的纯化结果
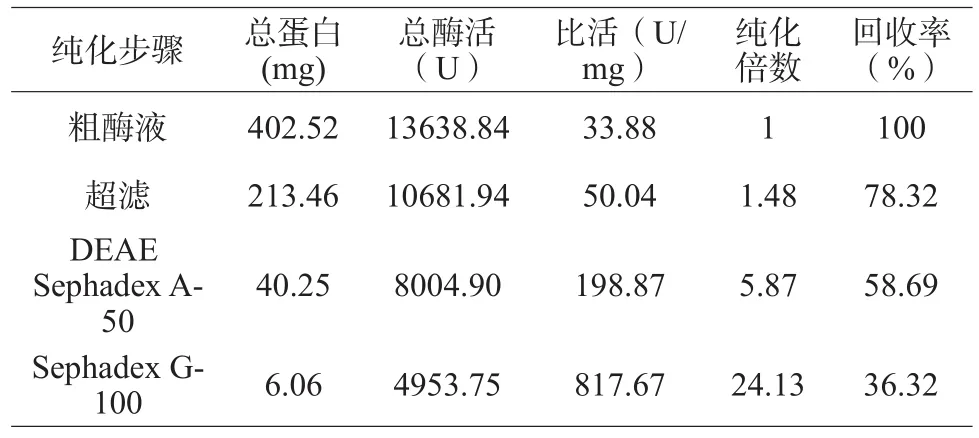
表1 果胶酶的提纯结果Table1 Summary of purification of pectinase
由表1可知,经3步纯化后,果胶酶被提纯了24.13倍,回收率为36.32%。
2.5 果胶酶分子量测定结果
如图4所示,纯化后的酶液经SDS-PAGE电泳显示单一的条带,说明纯化后的果胶酶只有单一的亚基,酶液已达到电泳纯,以Marker中各蛋白的相对迁移率Rf为横坐标,分子质量的对数值lg M r为纵坐标,得标准曲线lg Mr=-1.8784Rf+2.6988(R2=0.9749),代入样品的迁移率,计算得果胶酶亚基的分子质量为63.96 ku,这与张名爱[12]的研究结果61.4 ku接近。
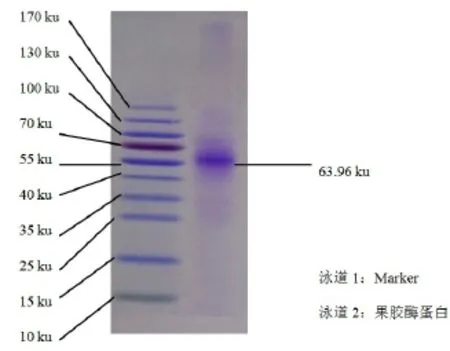
图4 纯化的果胶酶SDS-PAGEFig 4 SDS-PAGE pattern of purified pectinase
2.6果胶酶的最适反应温度及温度稳定性
如图5所示,随着温度上升,果胶酶活力呈先上升后下降趋势,当温度低于50℃或高于50℃时,酶活力显著下降(P<0.05),50℃酶活力最高,表明该海洋扩展青霉所产果胶酶的最适反应温度为50℃。
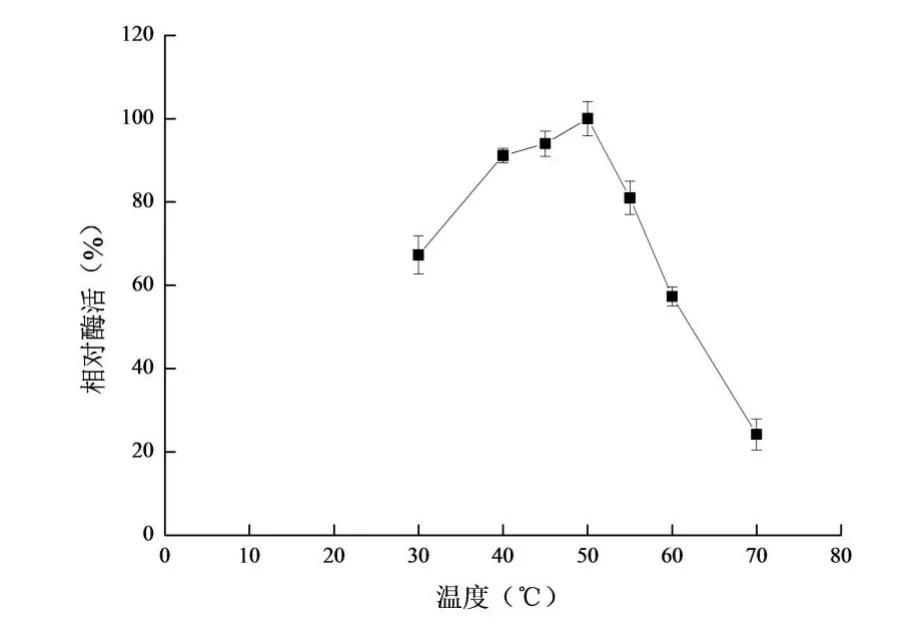
图5 果胶酶的最适反应温度Fig 5 Theoptimum reaction temperatureof pectinase
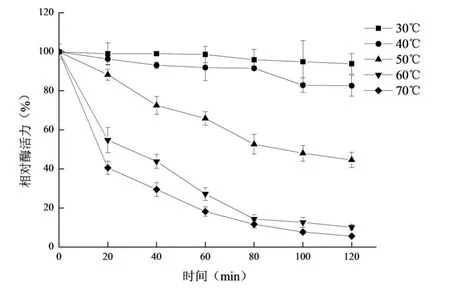
图6 果胶酶的温度稳定性Fig 6 The temperature stability of pectinase
由图6可知,随着保温时间的延长,果胶酶活力逐渐下降,30℃保温120m in,果胶酶活力下降不显著,说明果胶酶在30℃,稳定性好,40℃保温80min后,酶活力开始显著下降(P<0.05),在50℃、60℃和70℃中,随着保温时间延长,酶活力显著(P<0.05)下降;50℃、60℃和70℃保温,相同时间点酶活力呈下降趋势,并且与30℃对应时间点酶活力相比,下降显著(P<0.05);50℃保温80min,酶活力保留率为52.58%,50℃保温120m in,酶活保留率为44.60%;60℃保温20m in,酶活保留率为54.81%,70℃保温20 m in,酶活为初始的40.64%。60℃和70℃保温120min后,酶活力保留率均在10%以下。
2.7果胶酶的最适pH值及稳定性
如图7所示,随pH值上升,果胶酶活力先上升后下降,pH值小于5.0或大于5.8,酶活力显著下降(P<0.05),pH值5.4时酶活力最高,表明果胶酶最适反应pH值5.4。
如图7所示,pH值低于4.6或高于6.2,酶活力显著下降(P<0.05),pH值4.6~6.2范围内,酶活力基本稳定,且显著(P<0.05)高于其他pH值的酶活力,表明果胶酶在pH值4.6~6.2范围内稳定。
2.8金属离子对果胶酶活力的影响
如表2所示,金属离子对果胶酶活力促进作用顺序Mg2+>Ca2+>Na+>Sr2+>Co2+>K+,对果胶酶活力抑制作用大小Cu2+>Zn2+>Fe2+,Mg2+、Ca2+对果胶酶有很强的激活作用,Mn2+对果胶酶活力几乎无影响,Cu2+有对果胶酶有很强的抑制作用。
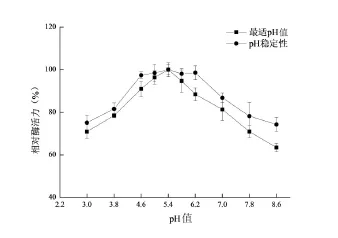
图7 果胶酶的最适pH值及稳定性Fig 7 Theoptimum reaction pH and pH stability of pectinase

表2 金属离子对果胶酶活力的影响Table2 Effectofmetal ionson theactivity of pectinase
2.9 果胶酶的反应动力学研究
果胶酶分别与不同浓度的果胶底物(0.1%、0.2%、0.3%、0.4%、0.5%和0.6%)在最适条件下反应,测定酶活力,根据Lineweave-Burk双倒数法作图8,利用公式:1/V=1/V max+(K m/V max)·(1/〔S〕),求出果胶酶的动力学常数,当以果胶为底物时,V max为393.56 μg/(min·m L),K m为3.34mg/m L。

图8 果胶酶的Lineweaver-Burk图Fig 8 Lineweaver-Burk plotof pectinase
3 讨论
对一株海洋扩展青霉(Penicillium expansum)所产果胶酶进行纯化,经超滤、DEAE Sephadex A-50离子交换层析、Sephadex G-100凝胶过滤层析后,获得电泳纯的果胶酶,其亚基单一的分子质量约为63.96 ku,纯化倍数为24.13,回收率为36.32%,该酶的最适反应温度为50℃,在30℃稳定,40℃较稳定;最适反应pH值5.4,在pH值4.6~6.2比较稳定;对果胶酶活力促进作用大小顺序Mg2+>Ca2+>Na+>Sr2+>Co2+>K+,Mn2+对果胶酶活力无影响,对果胶酶活力抑制作用大小Cu2+>Zn2+>Fe2+。Mg2+、Ca2+对果胶酶活力有很强激活作用,Cu2+有很强抑制作用,Mn2+几乎不影响果胶酶活力;以果胶粉为底物的V max为393.56μg/(min·m L),K m为3.34mg/m L。
许多学者对酶的纯化,首先采用硫酸铵沉淀,此方法操作起来比较耗时,而且很容易因局部硫酸铵浓度过大,使酶变性失活。本文采用超滤的方法,操作起来比较简捷,而且因为是物理分离,酶活损失非常少。本文研究的果胶酶分子质量约为63.96 ku,与张名爱[9]的研究结果61.4 ku比较接近,张名爱研究的草酸青霉果胶酶最适作用pH值为5.0,最适反应温度为40℃,pH值稳定范围为4.0~6.0,与本文研究的果胶酶最适温度有一定差距,最适pH值比较接近,稳定范围相对小一点,蓝丽精等[10]研究的果胶酶最适反应温度为50℃,最适反应pH值5.0,与本研究结果相近但有少部分区别,可能是果胶酶产生菌不同,表达果胶酶的基因不同,造成果胶酶蛋白分子结构有所不同,使得性质也有区别。
中国海域辽阔,海洋微生物资源非常丰富,且容易获得,海洋中有陆地上不存在的微生物,以海洋微生物出发,寻求稳定性好,活力高的果胶酶,应用于工业生产,有利于提高我国果胶酶制剂的品质。本文为探究海洋真菌所产果胶酶的性质,分子结构等提供了理论指导。
[1]陈勇强,严 芬,叶秀云.高产果胶酶菌株的筛选鉴定及其发酵条件研究[J].中国食品学报,2014,14(2):138-144.
[2]许均华,李高阳,李志坚.高产果胶酶菌株的选育及其发酵生产的研究进展[J].食品与机械,2011(01):146-150.
[3]Oszm ianski J,Wojdylo A,Kolniak J.Effectof pectinase treatment on extraction of antioxidant phenolsfrom pomace for the production of puree-enriched cloudy apple juices[J].Food Chem istry, 2011,127(2):623-631.
[4]Pinelo M,Zeuner B,Meyer A S.Juice clarification by protease and pectinase treatments indicates new roles of pectin and protein in cherry juice turbidity[J].Food and Bioproducts Processing, 2010,88(2/3):259-265.
[5]A lix S,Lebrun L,Marais S,et al.Pectinase treatments on technical fibresof flax:Effectsonwater sorption andmechanical properties[J].Carbohydrate Polymers,2012,87(1):177-185.
[6]段盛文,刘正初,郑 科,等.从富集液中发掘麻类脱胶果胶酶基因的技术[J].中国生物工程杂志,2014,34(1):86-89.
[7]吕丽娟,樊明涛,刘晓娇,等.扩展青霉利用苹果渣发酵产果胶酶条件的优化[J].食品工业科技,2011(07):220-222,241.
[8]初 乐,赵 岩,葛邦国,等.果胶酶研究及应用[J].果蔬加工, 2012(02):54-56.
[9]张名爱,王宝维,岳 斌,等.草酸青霉果胶酶分离纯化工艺及酶学性质研究[J].食品科学,2013,34(9):175-179.
[10]蓝丽精,蔡琪敏,宋迤明,等.草酸青霉液体发酵产果胶酶条件的优化及其产物的酶学性质[J].微生物学杂志,2011,31(4):36-41.
[11]Fu JJ,Li X Q,GaoW D,etal.Bio-processing of bamboo fibres for textile applications:a m ini review[J].Biocatal Biotransform, 2012,30:141-153.
[12]Liu K,Li X F,Li X M,et al.Lowering the cationic demand caused by PGA in papermaking by solute adsorption and immobilized pectinase on chitosan beads[J].Carbohydrate Polymers, 2010,82(3):648-652.
[13]M iller G L.Use of dinitrosalicylic acid reagent for determ ination of reducing sugar[J].AnalChem,1959,31:426-428.
[14]胡 泊,吴 胜,杨 柳,等.嗜冷枯草芽孢杆菌低温脂肪酶纯化与酶学性质研究[J].微生物学通报,2007,36(3):524-527.
[15]郭清泉,威 英.酸奶制品在储存过程中发酵剂菌的β-半乳糖苷酶活性测定及变化规律研究[J].食品工业科技,2002,23(3): 34-36.
[16]赵先朋,吴茜茜,蔡敬民.假海源菌ZJCN121岩藻多糖酶的纯化及其性质[J].安徽农业大学学报,2013,40(5):833-837.
[17]Laemm li U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970(277):680-685.
[18]张舒平,周 鹏,苏春元,等.重组枯草芽孢杆菌壳聚糖酶的纯化和性质研究[J].中国农业大学学报2012,17(1):125-131.
[19]郝杰清,王帅坤,师 慧,等.重组毕赤酵母葡萄糖氧化酶的纯化和性质[J].食品科学,2013,34(09):159-163.
Purification and enzymatic charactersof pectinase from marine Penicillium expansum
WU Shuang1,ZHANGM in2,PAN Ren-rui2,CAIJing-m in1,2
(1.College of Life Sciences,AnhuiAgriculturalUniversity,Hefei230036; 2.Schoolof Biologicaland EnvironmentalEngineering,HefeiUniversity,Hefei230601,China)
Pectinase from marine Penicillium expansum was separated and purified by ultrafiltration,DEAESephadex A-50 ion exchange chromatography,Sephadex G-100 gel filtration chromatography.SDS-PAGE of the purified pectinase revealed a single band atan apparentmolecularmassof 63.96 ku.Resultshowed thatpectinasewas purified by 24.13 foldsw ith a yield of 36.32%.The enzymology properties revealed that theoptimal reaction temperaturewas50℃,and theoptimalpH was5.4.Pectinasewasstable in the range of pH4.6-6.2.Mg2+and Ca2+had obviousactivation on pectinase activity,however Cu2+had obvious inhibition.Vmax and Km for jelly powderwere 393.56μg/(m in·m L)and 3.34mg/m L,respectively.
marine Penicillium expansum;pectinase;purification;enzymology properties
Q814.1;TQ925.3
A
2095-1736(2015)03-0037-05
10.3969/j.issn.2095-1736.2015.03.037
2014-10-30;
2014-12-01
安徽省教育厅自然科学项目(KJ2012B153)
吴 爽,硕士,从事微生物酶学和海洋微生物活性天然产物研究,E-mail:wushuangsunshine@163.com。
蔡敬民,教授,博士,硕士生导师,从事微生物酶学和海洋微生物活性天然产物研究,E-mail:caijingmin@hfuu.edu.cn。
