氨基葡萄糖及其自然氧化产物抗氧化功能研究
2015-06-09宋丽青刘必谦王亚军周湘池
宋丽青,刘必谦,王亚军,周湘池
(宁波大学海洋学院应用海洋生物学教育部重点实验室,浙江宁波315211)
氨基葡萄糖及其自然氧化产物抗氧化功能研究
宋丽青,刘必谦,王亚军,周湘池
(宁波大学海洋学院应用海洋生物学教育部重点实验室,浙江宁波315211)
以自制的小型单电渗析装置于实验室制备氨基葡萄糖。经不同时间存放后氨基葡萄糖(Glucosam ine,GNH2)发生褐变反应,分别对无色、淡黄色、黑色的G-NH2进行抗氧化性实验。结果发现,G-NH2随着存放时间的延长颜色加深,其1,1-二苯基-2-三硝基苯肼(1,6-Bis(diphenylphosphino)hexane,DPPH)清除能力大幅增强,5mg/m L时DPPH清除能力达到峰值97.09%;同样其还原力也随之增强,1mg/m L浓度的G-NH2还原铁氰化钾在700 nm波长下的吸光值由0.566上升到1.9698,是同浓度谷胱甘肽(Glutathione,GSH)相应值的2.8倍;而·OH清除能力随着G-NH2颜色的加深急剧下降,且具有一定浓度依赖性,实验浓度为5mg/m L时,无色G-NH2清除·OH能力为74.06%,淡黄色G-NH2清除率为16.46%,呈现黑色时已不具备·OH清除能力。
氨基葡萄糖;美拉德反应;变色;抗氧化性;自由基清除
美拉德反应(maillard reaction,MR)又称为非酶褐变反应,由氨基化合物(蛋白质或氨基酸等)和羰基化合物(还原糖等)之间发生经过一系列复杂反应最终生成褐黑色物质。美拉德反应过于复杂,反应机理、产物组成及其性质未研究透彻,但已有报道,不同氨基化合物和羰基化合物类反应物结构越复杂,产物相应越复杂[1-3]。
氨基葡萄糖(Glucosam ine,G-NH2)是甲壳素的最终水解产物,是一种天然的氨基单糖,几乎分布于人体所有组织,参与构造人体组织和细胞膜,是蛋白多糖大分子合成的中间物质[4]。它是葡萄糖的一个羟基替代为氨基的化合物。已有研究表明,G-NH2具有广泛的生理功能,在抗菌消炎、增强免疫力、抗肿瘤、伤口愈合以及食品保鲜等方面有着重要应用价值[5-8]。然而GNH2的性质不稳定,由于其是还原性糖类物质,且带有氨基,容易受温度、光照等环境影响自身发生美拉德反应,颜色由刚制备时的无色转变成淡黄,最终加深变成黑色[9-11]。在常温下,G-NH2单一物质发生的美拉德反应,由于反应物的结构和成分相对简单,其美拉德反应产物组分也相对较少,成分相对明确。主要反应机理为分子内羰氨反应、分子间脱水缩合和烯醇化反应,生成产物主要有羟甲基糠醛、吡嗪杂环、吡喃、呋喃、还原酮等[10-12]。
氨基葡萄糖(G-NH2)自然状态下发生美拉德反应,颜色随存放时间延长而加深,G-NH2溶液由最初的无色渐变成淡黄色、褐色直至黑色。本文研究了不同存放时间的G-NH2溶液的抗氧化能力的变化,以便更好地应用不同阶段的G-NH2所具有的性质。
1 材料和方法
1.1 材料与试剂
氨基葡萄糖(Glucosamine,G-NH2)以本实验室自制的小型单电渗析槽实验室制备。1,1-二苯基-2-三硝基苯肼(1,6-Bis(diphenylphosphino)hexane,DPPH)购自Sigma公司;维生素C(Vitam in C,VC)、谷胱甘肽(Glutathione,GSH)、乙酸、三氯乙酸、铁氰化钾、硫酸亚铁、邻二氮菲、过氧化氢等其它试剂均为化学分析纯;氨基葡萄糖盐酸盐(DC级)由浙江金壳药业有限公司提供。
1.2仪器与设备
自制小型单电渗析槽:用有机玻璃自制体积为100m L的长立方形电渗析槽,槽的一个侧面为空,供装阴离子交换膜。阴极位于槽内,阳极在外。电极丝为铂金丝。电源为宁波产DCPOWERSUPPLYDF1730SL3A。
T6型可见分光光度计,北京普析通用仪器有限公司;3001型全波长扫描多功能酶标仪,美国赛默飞世尔科技公司;DK-S22电热恒温水浴箱,上海精宏实验设备有限公司;电子天平,梅特勒-托利多公司;D-37520离心机,美国赛默飞世尔科技公司;IONSEPTM特种分离膜购自杭州埃尔环保科技有限公司。
1.3 实验方法
1.3.1 氨基葡萄糖制备
1)制备开始。将分离膜阴膜装在槽的空出一侧,并压紧防渗漏。槽内装入20%的氨基葡萄糖盐酸盐饱和溶液,放入以自来水流水作为外液的容器中。保证电渗析低温环境,在外液中定时更换冰袋。
2)制备终止。待内液pH值9~10;银离子浊度法检测实验样液,未检出氯离子。
此时槽内外离子交换接近停止,终止电渗析。将内液装袋低温储藏或冷冻干燥成干粉末后冷藏保存。
1.3.2 样品处理
配制10mg/m L氨基葡萄糖(Glucosam ine,G-NH2)溶液于磨口带塞透明玻璃瓶中,放置于实验室窗台上,不避光。无色G-NH2:现制现用;淡黄色G-NH2:室温30°左右,不避光放置20 d;黑色G-NH2:室温30°左右,不避光放置6个月。
1.3.3 DPPH清除能力
取不同阶段存放的氨基葡萄糖(Glucosamine,GNH2),分别配制浓度为0.25、0.5、0.75、1、1.5、2、2.5、3、3.5、4、4.5和5mg/m L的G-NH2备用。以1mg/m L的维生素C(Vitam in C,VC)作为对照。取0.1m L样品加入2×10-4mol/L的DPPH的乙醇溶液0.1m L,混匀,于常温下避光反应30m in。使用酶标仪测定反应液在517 nm波长处的吸光值(Ai)。测定0.1m L 2×10-4mol/L的DPPH溶液和0.1m L无水乙醇混合物的吸光值(A0)及0.1m L样品液和0.1m L无水乙醇混合物的吸光值(Aj)。清除率越大抗氧化性越好[13]。
DPPH清除率计算公式:
清除率=[A0-(Ai-Aj)]/A0×100%
1.3.4 还原力测定
取不同阶段存放的G-NH2,分别配制浓度为1、1.5、2、2.5、3、3.5、4、4.5和5mg/m L的G-NH2和1mg/m L的谷胱甘肽(GSH)备用,以GSH为对照。取1m L样品液于1m L pH值6.6的0.2mol/L磷酸盐缓冲液,加入1 m L 1%铁氰化钾,混匀,50℃恒温水浴20m in。迅速冷却,加1m L 10%三氯乙酸,终止反应并离心(3000 r/ m in)10min,取上清液1m L,并加1m L ddH2O和0.2 m L 0.1%三氯化铁,混合均匀,室温静置10min后取0.2m L于酶标板中,使用酶标仪测定700 nm波长处的吸光度,当所得吸光度越大,说明样品的还原能力就越强[14]。
1.3.5·OH清除能力
取不同阶段存放的G-NH2,分别配制浓度为1、1.5、2、2.5、3、3.5、4、4.5和5mg/m L的G-NH2和1mg/m L的维生素C(VC)备用,以VC为对照。以Fenton反应检测样品对·OH清除能力[15]。取0.15m L样品液于0.5m L 3.75mmol/L邻二氮菲溶液中,以pH值7.40磷酸缓冲液补至2m L,充分混匀后,依次加入0.5m L 3.75mmol/L硫酸亚铁和0.5m L 0.03%过氧化氢溶液,于37℃恒温水浴中反应60m in,测定536 nm波长处吸光值,记为A样。0.5m L蒸馏水代替双氧水组,测得536 nm吸光度记为A未。不加样品液组得536 nm处吸光度,记为A损。
·OH清除率计算公式:

2 结果
2.1 DPPH清除能力

图1 不同颜色G-NH2的DPPH清除能力Fig 1 The scavenging activitieson DPPH radicalsof differentcolorsw ith G-NH2
DPPH的乙醇溶液显紫色,是一种稳定的自由基,在517 nm处有最大吸收。当有自由基清除剂存在时,DPPH的单电子由于被配对使其浓度减小而溶液颜色变浅,相应在517 nm波长处的吸光度变小。这种颜色变浅的程度与配对电子数成化学计量关系,因而可用分光光度计进行定量分析[16]。不同颜色的G-NH2的DPPH自由基的清除作用如图1所示。
由上图可知G-NH2具有DPPH清除能力。淡黄色G-NH2比无色G-NH2的DPPH清除能力略微好一些,随浓度0.25mg/m L到5mg/m L,清除率从29.45%上升到57.24%。而黑色G-NH2的DPPH清除能力大幅上升,随浓度增大,0.25 mg/m L时清除率为62.37%,在2.5mg/m L达到96.05%,之后清除率趋于稳定,最高为5 mg/m L G-NH2的DPPH清除能力是97.16%,高于1 mg/m LVC的DPPH清除率95.31%。说明G-NH2的非酶褐变反应随时间的延长,能清除DPPH自由基的产物浓度增多强度增大。
2.2 还原力测定
还原能力的测定是以样品是否为良好的电子供体为指标。铁氰化钾还原法是测定样品总还原力的经典方法。具有良好还原能力的样品供应的电子不仅能使Fe3+还原成Fe2+,还可以与自由基反应,使之成为较为稳定的物质,从而中断自由基连锁反应。反应液在700 nm处吸光值越大表明样品的还原力越强[17]。不同颜色的G-NH2还原能力如图2所示。
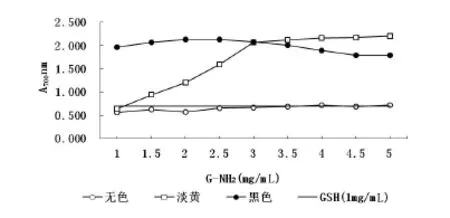
图2 不同颜色G-NH2的还原能力Fig 2 The reducing powerof differentcolorsof G-NH2
由上图可知G-NH2具有较好的还原能力。淡黄色G-NH2还原能力随浓度增大而提高,在3mg/m L质量浓度后还原能力上升趋缓。黑色G-NH2的还原能力在低浓度时有一个缓上升趋势,2.5mg/m LG-NH2浓度下,700 nm波长的吸光值达2.1277,接着趋于下降。在3mg/m L的浓度位置黑色和淡黄色G-NH2还原能力一致。1mg/m L浓度G-NH2在变成黑色后还原能力是同浓度GSH的2.8倍。G-NH2褐变反应产物还原力主要来源于还原酮类物质,随着反应时间增加,还原酮类物质积累增多,还原能力增强;反应时间进一步增加,还原性物质分解[18]。
2.3·OH自由基清除能力
羟基自由基(·OH)清除率能有效反映物质抗氧化能力。在其氧原子上含有一个未配对电子,具有很强的得电子能力。在过渡金属离子催化作用下,过氧化氢可发生均裂产生羟自由基(·OH)[19],反应式如下:

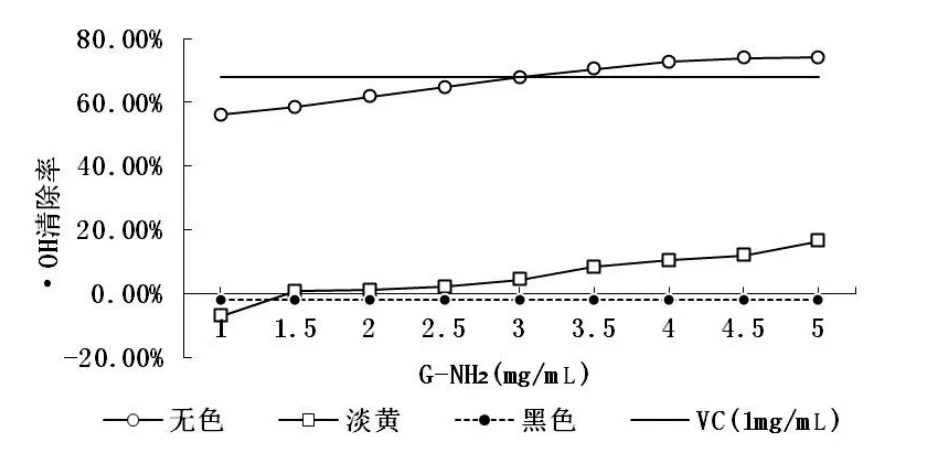
图3 不同颜色G-NH2的·OH清除能力Fig 3 The scavenging activitieson·OH radicalsof differentcolorsof G-NH2
由图3可知刚制备的无色G-NH2具有较好的·OH自由基清除能力,且随着G-NH2浓度的增大,·OH自由基清除能力增强,最高达74.06%。在3mg/m L浓度时与1mg/m l VC的·OH清除能力一致。但是刚制备的无色G-NH2在常温不避光环境下放置后,随着时间增长,G-NH2自身发生相应美拉德反应,淡黄色G-NH2的·OH自由基清除能力急剧下降。变成黑色的G-NH2已经不具备·OH自由基清除能力。
3 讨论
3.1 受试条件
氨基葡萄糖非酶褐变反应变色前后不同阶段产物的抗氧化能力产生了变化。其机理十分复杂,褐变程度与温度、pH值、加热时间、还原剂等条件密切相关,不管是用于食品保鲜还是抗氧化性等方面,G-NH2在常温不避光环境下受试最为合理。
3.2 G-NH2美拉德反应机理
G-NH2是葡萄糖2号位羟基替换为氨基的一种化合物,分子式C6H13NO5,分子量为179。它自身由于含有氨基、环氧基以及多个羟基而性质活泼,新鲜制备G-NH2具备一定抗氧化能力。另一方面,正是由于其为还原性糖类,且带有氨基而致自身很容易发生美拉德非酶褐变反应,使得自身原本的结构改变从而相应的性质也改变。
美拉德反应是一个极其复杂的过程,通常被分为初级、中级与高级3个不同程度的阶段[2]。本研究的G-NH2美拉德反应可能发生在G-NH2分子之间或者GNH2自身作为糖胺直接进入美拉德反应的高级反应阶段。根据常规氨基酸和还原性糖的美拉德反应机理推断总结G-NH2美拉德反应基本路线如图4[11,20-22]。

图4 氨基葡萄糖美拉德反应基本框架Fig 4 Thebasic framework of G-NH2maillard reaction
目前已有研究较为认可的G-NH2美拉德反应为分子内羰胺缩合、反醇醛缩合和分子间脱水缩合、烯醇化反应。氨基葡萄糖和葡萄糖一样有链式结构和环状结构,此以链式结构作图。见图5和图6[21-23]。
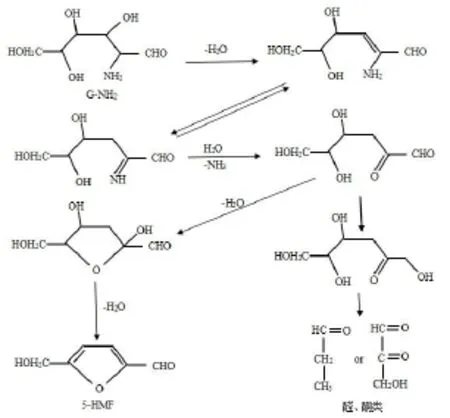
图5 氨基葡萄糖分子内美拉德反应Fig 5 G-NH2intramolecularmaillard reaction

图6 氨基葡萄糖分子间美拉德反应Fig 6 G-NH2intermolecularmaillard reaction
3.3 DPPH清除能力和还原力变化
实验结果显示,G-NH2在室温不避光环境下放置,随着时间的增长,美拉德反应的深入,DPPH清除能力和还原能力趋于增强。羰氨缩合、Amadori/Heyns重排形成醛糖、还原酮或者抗氧化肽片段,使得DPPH清除能力和还原能力的提高。还原酮物质通过提供电子来破坏自由基链式反应,它可以与一些过氧化物的前体物反应阻止过氧化物的生成,从而达到抗氧化的目的[24]。还原酮、不饱和醛等产物拥有比G-NH2自身更好的清除自由基,阻断自由基连锁反应的能力,使得DPPH清除能力和还原能力提高。Yu等[25]人分析了葡萄糖-酪氨酸-组氨酸体系生成的美拉德反应产物组分,其中包括大量挥发性的呋喃酮、吡喃酮、烯酮、醛类、吡嗪等物质以及酚类物质,指出该产物的抗氧化性与产物中的酚类、还原性酮类浓度有关。
还原力测定实验中,黑色G-NH2在2.5mg/m L浓度下,700 nm波长的吸光值达2.1277,接着趋于缓慢下降。Jun等[22]将氨基葡萄糖进行美拉德反应,100℃下加热2 h,降解产物中确证有2-(四羟基丁基)-5-(3,4-二羟基-1-反式-正丁巴比妥)-吡嗪,而在40℃实验时未检出该物质。同理,黑色高浓度G-NH2还原力趋于下降可能是因为铁氰化钾还原法实验需在高温50℃恒温水浴20min,随浓度增高,黑色G-NH2发生更进一步的复杂反应,还原酮等小分子降解、烯醇化或者醇醛缩合最终聚合生成大分子褐色类黑精,使得高浓度GNH2的还原能力下降,亦或50℃水浴下产物成分中生成了一些其他物质抑制了还原性物质的还原能力[20]。
3.4·OH清除能力下降
在·OH清除能力测定结果中,反应物G-NH2本身具有很强的·OH清除能力,且其能力具有浓度依赖性,随着G-NH2的褐色反应的加深,其清除能力下降。本实验结果与唐杰等以氨基葡萄糖美拉德反应产物作为研究的结果一致。Remko等[26]和郭静[27]对G-NH2进行量子化学研究表明G-NH2结构中-NH2官能团是最活泼的,它与邻位的羟基由于电子的相互作用,十分容易发生亲核反应。在G-NH2美拉德反应中,游离氨基在碱性条件存在,随着反应进行pH值减小,当pH≤4时,氨基质子化,其反应活性降低[28-29]。从本实验结果看,G-NH2的·OH清除能力,在无色时最强,变黄色时大量下降,到黑色就完全失去了·OH清除能力。这一现象表明正是G-NH2本身具有很强的·OH清除能力,因为颜色逐渐变深意味着越来越多的G-NH2因发生美拉德反应而减少,其活性氨基含量下降,这种能力也随之下降直至完全消失。与葡萄糖相比,G-NH2多了2位上的氨基,正是这个差异导致G-NH2具有了·OH清除能力[30]。游离氨基清除·OH自由基化学式:
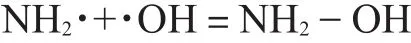
项惠丹等[31]和Yoshimura等[32]以蛋白质/氨基酸与还原糖类美拉德产物进行·OH自由基清除实验结果为随反应时间延长,产物的·OH自由基清除能力提高。进一步说明了本实验G-NH2自身褐变产物与蛋白质或氨基酸与还原糖类反应生成的产物有很大的区别。氨基葡萄糖单糖自身褐变反应产物对比于其他学者用蛋白质或氨基酸与还原性糖类的反应产物,其中的组分相对较少,缺少清除·OH自由基的物质或者因某种组分的存在而抑制了对·OH自由基的清除。
4 结论
1)虽然G-NH2因褐变失去清除·OH自由基的能力,但褐变产物却获得了新的、较强的还原能力和DPPH清除能力。而后两种性能,也是抗氧化、保健类物质所需要的优良性能。所以G-NH2及其自然氧化物,分别具有不同的功能,都具有较好应用前景。
2)G-NH2易发生褐变,因而纯度较高的G-NH2比较难以制备。本实验自制电渗析器适用于实验室规模制备G-NH2。由于制备过程中容易观察和控制电渗析条件,产物不需要再处理就可以直接保存,有效防止了褐变发生。液体G-NH2可以在普通冰箱冷冻室保存几年不发生褐变。固体G-NH2在真空、低温条件下,目前保存一年以上也没有发生褐变。
[1]Fogliano V,Birluez-Aragon I.Maillard reaction:an ever green hot topic in food and biological science[J].Food&Function,2013,4 (7):1000.
[2]郑文华,许 旭.美拉德反应的研究进展[J].化学进展,2005,17 (1):122-129.
[3]Silván JM,van de Lagemaat J,Olano A.Analysis and biological properties of am ino acid derivates formed by Maillard reaction in foods[J].Journal of Pharmaceutical and Biomedical Analysis, 2006,41(5):1543-1551.
[4]刘尚礼,吕浩然,丁 悦.骨关节炎的氨基葡萄糖治疗研究进展[J].广东医学,2005,26(7):1008-1009.
[5]Jeong K C,Ahn K O,Lee B I,etal.Themechanism of transglutaminase 2 inhibition w ith glucosamine:implications of a possible anti-inflammatory effect through transglutaminase inhibition[J].J CancerResClin Oncol,2010,136:143-150.
[6]曹秀明,壳寡糖及衍生物抗肿瘤作用免疫调节作用及其机制的研究[D].青岛:中国海洋大学,2010.
[7]Kantor E D,Lampe JW,Peters U,et al.Use of glucosam ine and chondroitin supplements and risk of colorectal cancer[J].Cancer CausesControl,2013,24:1137-1146.
[8]谢 晶,侯伟峰,朱军伟.复合生物保鲜剂在南美白对虾防黑变中的应用[J].农业工程学报,2012,28(5):267-272.
[9]Zeng L T,Qin C Q,ChiW L,et al.Browning of chitooligomers and their optimum preservation[J],Carbohydrate Polymers,2007, (67):551-558.
[10]唐 杰,刘必谦,周湘池,等.虾蟹壳提取物氨基葡萄糖美拉德反应及其产物的抗氧化性能研究[J].海洋与湖沼,2012,43 (4):741-747.
[11]步 芬,李 博,徐光富,等.壳寡糖/氨基葡萄糖非酶褐变研究进展[J].食品工业,2013,34(5):181-185.
[12]Shu C K.Degradation products formed from glucosam ine in water[J].Journalof Agric Food Chem,1998,46:1129-1131.
[13]Singh N,Ragini PS.Free radical scavenging activity of an aqueous extract of potato peel[J].Food Chem istry,2004,85:611-616.
[14]Zhuang Y,Sun L.Antioxidantactivity ofmaillard reaction products from lysine-glucosemodel system as related to optical property and copper(II)binding ability[J].A frican Journal of Biotechnology,2011,10(35):6784-6793.
[15]陈 健,欧阳玥,闫 静.磷酸盐缓冲溶液对邻二氮菲-Fe~(2+)氧化法测定羟基自由基的影响[J].分子科学学报,2012(04): 350-352.
[16]Lu Y R,Foo Y L.Antioxidantactivitiesof polyphenols from sage (Salvia oficinalis)[J].Food Chem,2001,75(2):197-202.
[17]Yen G C,Chen H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].Agric Food Chem,1995, 43(1):27-32.
[18]王延平,赵谋明,彭志英,等.美拉德反应产物抗氧化性能研究进展[J].食品与发酵工业,1997,24(1):70-73.
[19]Yilmaz Y,Toledo R.Antioxidant activity of water-soluble Maillard reaction products[J].Food Chem,2005,93(2):273-278.
[20]LiB,Chen F,Wang X,etal.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chem istry,2007,102(4):1135-1143.
[21]于彭伟.Maillard反应产物抗氧化性能、有害成分分析及其对猪肉保鲜效果的研究[D].南京:南京农业大学,2011.
[22]Jun M,Shao Y,Ho CT,etal.Structural identification of nonvolatile dimerization products of glucosamine by gas chromatography mass spectrometry,liquid chromatography mass spectrometry, and nuclear magnetic resonance analysis[J].Journal of Agric Food Chem,2003,51(21):6340-6346.
[23]张敦铁.Maillard反应中间体的研究[D].武汉:华中科技大学, 2006.
[24]马志玲,王延平,吴京洪.模式美拉德反应产物抗氧化性能的研究[J].中国油脂,2002,27(4):68-71.
[25]Yu X,Zhao M,Hu J.Formation and antioxidantactivity of volatile compounds produced by heating glucose w ith tyrosine/histidine inwater-ethanoland water-glycerolmedia[J].Food Chemistry,2012,133(4):1394-1401.
[26]Remko M,HricoviniM.Theoretical study of structure and properties of hexuronic acid and D-glucosam ine structural units of glycosam inoglycans[J].StructChem,2007,18:537-547.
[27]郭 静.N-(O,O-二烷基磷酰基)-D-氨基葡萄糖的合成、表征以及相关量化研究[D].郑州:郑州大学,2010.
[28]Zeng L T,Qin C Q,ChiW L,et al.Browning of chitooligomers and their optimum preservation[J].Carbohydrate Polymers, 2007,67(4,19):551-558.
[29]陈伟珠,封明艳,易瑞灶.硫酸氨基葡萄糖非酶褐变的初步研究[J].食品科学,2009,30(5):36-39.
[30]李 进.臭氧氧化过程中羟基自由基的氧化性能的研究[D].北京:北京化工大学,2007.
[31]项惠丹,许时婴,王璋.蛋白质与还原糖美拉德反应产物的抗氧化活性[J].食品科学,2008,29(7):52-57.
[32]Yoshimura Y,Iijima T,Watanabe T.Antioxidative effectof Maillard reaction products using glucose-glycine model[J].Journal ofAgric Food Chem,1997,45:4106-4109.
G lucosam ineantioxidant function and it’snatural oxidation products
SONG Li-qing,LIU Bi-qian,WANGYa-jun,ZHOU Xiang-chi
(Key Laboratory ofApplied Marine Biotechnology ofM inistry of Education,SchoolofMarine Sciences, Ningbo University,Ningbo 315211,China)
Glucosam ine was prepared by m initype electrodialyzer designed and produced in laboratory.Natural oxidation products of glucosam inewere prepared by storing G-NH2in the same environmentw ith differentperiods of time.The reaction changed G-NH2from colorless to yellow,even black.Antioxidant experiment results suggested that G-NH2’s ability of scavenging the DPPH free radicals increased over time and reached to 97.01%at the concentration of 5mg/m L.Its ability of reducing was strengthened.With the concentration of 1mg/m L,A700nm wavelength absorbance value increased from 0.566 to 1.9698,which was 2.8 times of thatof the same concentration of GSH.However,the scavenging activities of hydroxyl free radical fell sharply w ith the deepening of G-NH2color,in a concentration dependentmanner.The scavenging activities of hydroxyl free radical of colorless G-NH2at 5mg/m L was 74.06%,the pale yellow’swas16.46%,theblack’shad no function.
glucosamine;maillard reaction;discoloration;antioxidant function;radicalscavenging
TS201.2
A
2095-1736(2015)03-0025-05
10.3969/j.issn.2095-1736.2015.03.025
2014-09-26;
2014-11-24
浙江省重大科研社会发展资助项目(2004C13037号);宁波市科技计划项目(2006B100069)
宋丽青,硕士研究生,主要从事氨基葡萄糖应用开发;
刘必谦,博士,研究员,主要研究方向为生物资源开发利用和现代生物技术,E-mail:lbqhy@nbu.edu.cn。
