磁性微球固定化胶原酶筛选抑制剂的研究
2015-06-09赵东旭
陈 蕊,严 月,赵东旭
(北京理工大学生命学院,北京100081)
磁性微球固定化胶原酶筛选抑制剂的研究
陈 蕊,严 月,赵东旭
(北京理工大学生命学院,北京100081)
以表面修饰的磁性微球作为载体,以共价结合的方式将胶原酶固定化,从56种中草药中快速筛选具有抑制作用的种类。结果表明:表面羧基磁性微球与胶原酶能较好地固定化,酶的反应浓度为2mg/m L,并且不影响其活性。以SDS-PAGE电泳的方法作为检测手段,从56种中草药中筛选出草河车对胶原酶具有较好的抑制作用。
磁性微球;固定化;胶原酶;中草药;抑制剂
高分子磁性微球作为一种优良的酶固定化载体,能够显著提高酶的操作稳定性和使用寿命,降低生产成本,便于自动化操作,具有很好的工业应用前景。胶原酶是基质金属蛋白酶(Matrix metalloproteinases,MMPs)中的一种,是一种具有高度专一性的蛋白酶,在人体组织正常代谢及减轻病理损坏中起着重要作用。相关资料表明,基质金属蛋白酶及其相关组织物调控着细胞外基质的更新[1],维持细胞的稳定性,如肿瘤侵入及扩散转移、骨关节炎、心血管疾病等[2],都与MMPs调控失衡有着密切的关系。目前,MMPs的抑制剂主要可以分为5类[3],包括异羟肟酸类、反式异羟肟酸类、非异羟肟酸类、非锌离子结合基类以及各种天然产物。而胶原酶的抑制剂主要有3类,包括天然抑制剂、人工合成抑制剂以及抗体类抑制剂。因此,探索和研究胶原酶天然抑制剂是寻找治疗相关疾病所迫切需求的。
基于上述背景,本实验以表面修饰的磁性微球作为载体,将胶原酶固定化后,从多种中草药中快速筛选具有抑制作用的种类。在此研究中需要解决的关键问题是磁性微球与胶原酶的固定化以及固定化后胶原酶活性的测定,然后利用固定化的胶原酶从中草药提取液中筛选其抑制剂。
1 材料与方法
1.1 材料
表面羧基修饰的磁性微球,购于天津市倍思乐色谱技术开发中心;Ⅰ型胶原酶,购于北京欣经科生物技术有限公司;Ⅰ型酸溶性胶原蛋白(非纯),购于成都新际生物活性胶原开发有限公司;BCA法微量蛋白质浓度测定试剂盒,购于生工生物工程(上海)有限公司;各种中药材,均购于北京同仁堂药店。
1.2羧基磁球对酶的固定化
1.2.1 磁球固定化原理[4]
EDC(1-(3-Dimethylam inopropyl)-3-ethylcarbodiim ide hydrochloride)是可溶于水的碳二亚胺,在酰胺合成中用作羧基的活化试剂,使用时的pH值范围为4.0~6.0,常和N-羟基琥珀酰亚胺连用,以提高偶联效率。
1.2.2羧基磁球与酶的共价连接
[5],具体操作如下:1)将磁球摇匀后取1000μL于2m L离心管中,在磁分离条件下用MES缓冲液(50mM,pH值6.0)洗3遍,弃上清。2)称取EDC 20mg溶于200μLMES缓冲液中,N-羟基琥珀酰亚胺20mg溶于200μLMES缓冲液中,即浓度均为100mg/ m L,2种溶液依次加入磁球中混匀。3)将反应样品放入30℃摇床中,180 r/min,反应30min。4)反应后,在磁分离条件下用PBS缓冲液(10mmol/L,pH值7.4)洗3次,弃上清。加入2mg/m L的酶1m L,在同样条件下反应1 h。5)用PBS缓冲液清洗4次,每次600μL,收集洗液待测浓度。固定化酶于4℃冰箱中保存待用。
1.3载酶量的测定
通过测定固定化酶洗液中胶原酶水解Ⅰ型胶原蛋白的能力,可知胶原酶的酶活,进而可得出未连接的酶量。根据BCA法微量蛋白质浓度测定的相关操作摸索出最佳的实验条件,并作标准曲线[6]。
1.3.1制作标准曲线
1)标准曲线酶浓度的设定与配制(表1);2)取7支2m L离心管,各管分别加入500μL相应浓度的配制好的酶溶液,然后各管分别加入500μL蛋白工作液,迅速混匀;3)在60℃金属浴中保温1 h,冷却至室温后,以酶浓度为0的管作对照,在分光光度计上测各管的D562nm值。4)以各管的D562nm为纵坐标,酶浓度为横坐标,绘制标准曲线。
1.3.2 磁球载酶量的测定
样品蛋白质浓度乘以总体积得到洗下的酶的量,总酶量已知,于是:
磁球载酶量=(总酶量-洗液中酶量)(mg)/磁球的量(g)
1)取3支2m L的离心管,其中一管加入500μL蒸馏水作为对照,另外两管分别加入浓度相同的500μL样品稀释液。2)各管分别加入500μL蛋白工作液,迅速混匀,在60℃金属浴中保温1 h。冷却至室温后,在分光光度计上测各管D562nm值。3)取两个相同样品稀释液的D562nm值的平均值,在标准曲线上确定出该样品经稀释后的蛋白质浓度。4)根据下式计算样品的蛋白质浓度:

表1 标准曲线测定用酶浓度Table 1 The determ ination of the standard curveof enzyme concentration
样品蛋白浓度(μg/m L)=该样品稀释后的蛋白质浓度×样品稀释倍数。
1.4 固定化酶的活性检测
据相关文献可知胶原酶活力的测定方法,如羟脯氨酸法[7]、胶原悬浮分析法[8]、放射性标记法[9]、荧光法[10]、考马斯亮蓝法[11]等。然而以上多种方法中,或需要特殊仪器设备,或操作过程繁琐。本实验最终确定利用SDS-PAGE电泳的方法对胶原酶活性进行测定,该方法操作简便,可信度高。SDS-PAGE方法参考文献[12]。
1)SDS-PAGE凝胶配制:浓缩胶浓度为5%、分离胶浓度为10%。2)凝胶板的制备:将混匀的分离胶约3.7m L加到玻璃板的缝隙内,用1m L蒸馏水水封。约30min后,将上层水倒去,加入约1m L浓缩胶,插入样品梳。约30m in后,小心拔出梳子。向电泳槽中加入电极缓冲液。3)上样、电泳。制备好相应的电泳样品,用微量注射器取10μL加到上样槽中,针头尽量插入上样槽内部。进样结束后打开电源,将电压调至70 V开始电泳,约15min后,样品在电场作用下进入分离胶。再将电压调至150V左右。待染料前沿迁移至距硅胶框底边1 cm左右,停止电泳。
1.5 中草药的提取
查阅相关文献[13-16],本研究采用56种可能具有相关疾病防治的中草药,根据其药用部位,分为块根块茎类、全草类、果实类、叶类、矿物类6大类中药。中草药的处理步骤如下:
1)取所需中药材分别进行粉粹,与蒸馏水以1∶10比例混合,静置2 h,于95℃进行煎煮1~2 h。2)煎煮后静置冷却至室温,然后用布氏漏斗过滤、10000 r/min离心30min,收集中草药上清液。3)取上述中草药上清液于分液漏斗中,与水饱和的正丁醇以1∶1的比例混合,振荡后静置12 h。待两相分层后,取下层的水相。4)经正丁醇萃取后的水相,用70%的乙醇进行沉淀,萃取后于10000 r/m in的转速下离心20min,取上清液备用。
2 结果与分析
2.1所用胶原酶以及胶原蛋白电泳检测

图1 胶原酶与胶原蛋白电泳图Fig 1 Theelectrophorogram of collagenaseand collagen proteina—Ⅰ型胶原酶;b—Ⅰ型胶原蛋白
图1表明,Ⅰ型胶原酶分子质量为120 ku;胶原蛋白的最大条带在100~150 ku之间,除此之外还有其他条带,是因为蛋白样品不纯所致。
2.2羧基磁球固定化酶
图2中未加交联剂EDC的羧基磁球固定化酶是按照羧基磁球固定化酶的操作步骤,以排除磁球对胶原酶本身的吸附作用和验证清洗的步骤是否彻底。从电泳图中可以看出,胶原蛋白的条带和未加交联剂的羧基磁球固定化酶与蛋白溶液反应后的条带几乎相同,说明不加交联剂胶原酶不会连接到羧基磁球上,而羧基磁球固定化酶与蛋白溶液反应后蛋白条带明显变浅,说明胶原酶已经被成功地固定到羧基修饰的磁球上并发挥良好的活性水解作用。
2.3羧基磁球固定化酶反应时酶浓度对反应效果的影响

图2 羧基磁球固定化酶检测效果Fig 2 The effectof immobilized collagenasew ith carboxyl-modified magneticm icrospheres1—marker;2—胶原蛋白;3—未加交联剂EDC的羧基磁球固定化酶与胶原蛋白反应作阴性对照;4—羧基磁球固定化酶与胶原蛋白反应。

图3 反应酶浓度对固定化酶效果的影响Fig 3 Effectsof differentenzyme concentration on theeffectof immobilized enzyme1—marker;2—胶原蛋白;3—酶浓度0.5mg/m L;4—酶浓度1mg/m L;5—酶浓度1.5mg/m L;6—酶浓度2mg/m L;7—酶浓度2.5mg/m L。
图3表明,随着酶浓度的增高,固定化酶的水解反应也越来越彻底,说明酶的浓度增加有利于酶的固定化反应,直到酶浓度为2mg/m L时,固定化酶的水解效果最好,但是酶的浓度继续增高时,固定化酶的水解程度不再增加,反而有少许下降,这可能是由于酶的浓度过高造成空间上的阻碍,不利于酶的固定化。于是实验中采用酶的反应浓度为2mg/m L。
2.4 载酶量的测定
测定羧基修饰的磁球固定化反应后洗液中酶的比活,取均值。测量3次固定化反应后取平均值,参照绘制的酶标准曲线计算洗液中酶的浓度,可知洗下来的酶的量。具体数值见表2。

表2 羧基磁球固定化酶洗下的酶浓度Table 2 The determ ination of the concentration of immobilized collagenasew ith carboxyl-modifiedmagneticm icrospheres
由表2得出的洗下的酶的量0.574mg,酶的总量2 mg,磁球量5 g,因此磁球的载酶量为:
羧基磁球的载酶量=(2-0.574)/5×1000=285.2mg/g
据刘天金介绍,在综合利用互联网、大数据、人工智能等现代信息技术和装备的前提下,传统的植保工作将逐渐演变成为一种数据集中和共享的方式——在此基础之上,技术融合、业务融合、数据融合都将逐步实现。
2.5 中草药的抑制效果
1)所用中草药的大规模筛选。
图4表明,块茎1组中药对酶有很强的抑制作用,块茎2组、块茎3组、叶类、矿物类、果实类、全草类没有抑制作用。
2)块茎1组中具有抑制效果中药的确定。
图5表明,3种中草药中,只有草河车对胶原酶的水解活性有抑制作用。
3 讨论
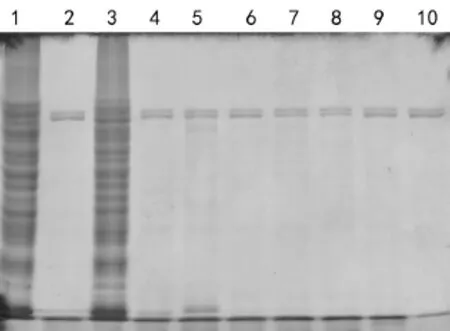
图4 各大类中药抑制效果Fig 4 Effectsof themajor categoriesof Chineseherbals1—胶原蛋白;2—胶原酶与胶原蛋白蛋白反应;3—块茎1组;4—块茎2组;5—块茎3组;6—叶类;7—全草类;8—果实类;9—矿物类;10—胶原酶。

图5 草河车·重楼、猫爪草·毛茛、天葵子·毛茛的抑制效果Fig 5 Effectsof Parispolyphylla Sm ith,Ranunculus ternatus Thunb and SemiaquilegiaadoxoidesMak1—marker;2—草河车(2min);3—猫爪子(2min);4—天葵子(2m in);5—草河车(5m in);6—猫爪子(5m in);7—天葵子(5m in);8—胶原蛋白;9—胶原酶。
高活性的胶原酶与多种疾病相关,其抑制剂在疾病治疗方面具有重要的作用,针对胶原酶的活性进行靶向治疗是近年来的研究热点之一。国内对胶原酶抑制剂的研究主要集中在对常见药物的抑制效果的测定,国外则大力开发化学合成的抑制剂,从分子化学结构的角度设计新的抑制剂和修饰已有的抑制剂。但国内外都很少从天然产物中尝试寻找胶原酶的抑制成分。本研究主要从天然中草药中寻找胶原酶抑制剂,我国在中草药资源上具有独特的优势,开发中草资源可以推动中药走向国际舞台。
本研究采用EDC作为交联剂成功地将Ⅰ型胶原酶共价结合到羧基磁性微球上,通过对照实验可知交联剂EDC在固定化过程中是必要的。并且该固定化并不影响胶原酶的活性。实验数据显示,在酶的反应浓度为2mg/m L时,固定化酶的水解效果最好。胶原酶与羧基磁球的共价结合是本研究进行的关键,该技术的解决为后面胶原酶抑制剂的筛选奠定了基础,对于胶原酶的固定化有一定的参考价值。从传统中草药中筛选活性成分是遴选药物分子的重要手段之一。本研究采用了一种比较快速的方法进行筛查,即对筛选的批量中草药进行分组,确定有活性的中药组后再分别进行活性筛查。从初步的研究结果看,草河车对胶原酶有一定的抑制作用,对之后的胶原酶抑制剂研究有一定的借鉴作用。我们接下来的工作就是通过色谱分析确定草河车中哪种活性成分对胶原酶有抑制作用,并进行相关的分析。
参考文献:
[1]Cawston T E,Galloway W A,Merce E,etal.Purification of rabbit bone inhibitor of eollagenase[J].Biochem ical Journal,1981,195: 159-165.
[3]涂国刚,黄惠明,熊 芳,等.基质金属蛋白酶抑制剂的研究进展[J].中国新药与临床杂志,2008,3(27):219-226.
[4]Zhu Y H,Wang QB,Gu HC,etal.Preparation of surface functionalmagneticmicrospheres and theirapplication in nucleic acid separation and enzyme immobilization[J].Acta Academiae Medicinae Sinicae,2002,24:118-124.
[5]Jiang D S,Long SY,Huang J,etal.Immobilization of pycnoporus sanguineus laccase on magnetic chitosan m icrospheres[J].Biochem icalEngineering Journal,2005,25:15-23.
[6]刘雅超,刘 旭,白鸿源,等.蛋白质定量分析的研究进展[J].中国民族民间医药,2009,18(8):49-50.
[7]刘 芳,李德富,林 炜,等.羟脯氨酸含量的测定方法与应用[J].中国皮革,2007,36(15):51-54.
[8]李国英,张忠楷,付 强,等.胶原的形态分类及其生理机能[J].陕西科技大学学报,2004,22(3):80-82.
[9]张自强,赵东旭,杨新林.羟脯氨酸的研究与开发[J].氨基酸和生物资源,2006,28(1):55-58.
[10]赵元晖,曾名勇,郭 瑶,等.罗非鱼骨骼肌中胶原蛋白分解酶的提取纯化及活性[J].现代食品科技,2006,22(2):40-42.
[11]王 睿,李志强,陈 敏,等.胶原酶及其活性测定方法的研究进展[J].中国皮革,2007,36(1):27-31.
[12]赵东旭,路秀玲,苏志国.聚乙二醇对血红蛋白离子交换层析行为的影响[J].北京理工大学学报,2004,24(10):924-928.
[13]刘延泽,陈士林,马 培,等.中草药中发现新抗癌药物的途径[J].现代药物与临床,2012,27(4):323-337.
[14]裴艳霞.谈中药抗肿瘤[J].光明中医,2011,21(12):128-129.
[15]杜 琴,胡 兵,沈克平.抗癌中药配伍研究[J].中国实验方剂学杂志,2010,20(13):43-44.
[16]郑 康,耿 耘.常见活血止痛类中药抗肿瘤研究进展[J]. 2014,32(2):252-253.
Research of screening inhibitorsof collagenase immobilized by magneticm icrospheres
CHENRui,YANYue,ZHAODong-xu
(Beijing Institute of Technology,Schoolof Life Science,Beijing 100081,China)
The presentpaperused surface-modifiedmagneticm icrospheresasa carrierof collagenase immobilized by covalentbonding to screen the kindsw ith inhibition on collagenase from 56 kinds of Chinese herbals.The results showed thatcollagenase could be immobilized better in carboxyl-modifiedmagneticm icrosphereswhen the optimum concentration of enzymewas 2mg/m L.The immobilized enzyme still keptnormal activity after immobilization.The SDS-PAGE was introduced to exam the hydrolysis degree by collagenase in existence of Chinese herbalextract.Thismethod could identify quickly Parispolyphylla Sm ith w ith inhibition to collagenase from 56 kindsof Chinese herbals.
magneticm icrospheres;immobilization;collagenase;herbals;inhibitors
Q814
A
2095-1736(2015)03-0021-04
10.3969/j.issn.2095-1736.2015.03.021
2014-10-17;
2014-10-21
国家自然科学基金资助项目(21175011)
陈 蕊,硕士研究生,专业方向为生物学,E-mail:rui618310@163.com;
赵东旭,博士,研究生导师,研究方向:主要生物活性成分的分离分析,E-mail:zhaodx@bit.edu.cn。
