异基因造血干细胞移植后发生的肾小球疾病
2015-06-09刘正钊谢红浪刘志红
刘正钊 谢红浪 刘志红
·临床集锦·
异基因造血干细胞移植后发生的肾小球疾病
刘正钊 谢红浪 刘志红
中年女性,因急性非淋巴细胞白血病行异基因造血干细胞移植,术后6月出现尿检异常,并逐渐进展至肾病综合征,伴镜下血尿,血清肌酐正常,血清抗磷脂酶A2受体抗体阴性,肾活检病理示肾小球膜性病变,诊断符合移植物抗宿主病相关性膜性肾病。泼尼松治疗2个月联合他克莫司治疗1个月后患者临床病情获部分缓解。
异基因造血干细胞移植 移植物抗宿主病 膜性肾病
病史摘要
50岁女性患者,因“异基因造血干细胞移植术后15个月,尿检异常9个月”,于2015-07-06入院。
现病史 患者2013年6月无明显诱因出现乏力、全身多处淤斑,12月当地医院确诊急性非淋巴细胞白血病(M2型),予阿柔比星、阿糖胞苷等药物化疗后获完全缓解。2014年4月接受异基因造血干细胞移植(allo-HSCT),供者来自中华骨髓库,人类白细胞抗原(HLA)配型全相合,BuCy方案(马利兰+环磷酰胺)预处理,移植过程顺利,骨髓造血功能重建良好,术后予环孢素A(CsA)100 mg/d及地塞米松2.25 mg/d治疗。2014年10月查尿蛋白++,尿隐血++,血清肌酐(SCr)正常,谷丙转氨酶400 U/L,予保肝药物治疗1周后谷丙转氨酶恢复正常。2014年12月停CsA及地塞米松,此后定期复查尿蛋白定量波动于1.7~3.0 g/24h。2015年3月发生腰背部带状疱疹,静滴阿昔洛韦半月后好转,当时行胸部CT示“右肺散在感染灶”,患者无发热咳嗽咳痰,考虑曲霉菌感染,予伏立康唑口服3月余,复查胸部CT提示右肺感染灶吸收。2015年6月查尿蛋白定量5.89 g/24h,尿沉渣红细胞计数(RBC)700万/ml(多形型),血清白蛋白(Alb)22.3 g/L,SCr 57.46 μmol/L,遂收入院进一诊治。既往史、个人史、婚育史及家族史无特殊。
体格检查 血压106/79 mmHg,神志清楚,全身皮肤未见扁平苔藓、红斑、色素减退、色素沉着,指甲无异位及缺失,咽不红,扁桃体不大,口腔未见溃疡、黏膜萎缩和苔藓样改变,心、肺听诊未见异常,腹部平坦,全腹无压痛反跳痛,肝脾肋下未触及,移动性浊音阴性,双下肢无水肿。
实验室检查
尿液 尿蛋白定量10.75 g/24h,RBC 700万/ml(多形型),白细胞0~1/HP,尿C3 10 mg/L,尿α2巨球蛋白5 mg/L,NAG 72.6 U/(g·Cr),RBP 0.8 mg/L,溶菌酶<0.5 mg/L。尿κ轻链124.8 mg/L,尿λ轻链47.47 mg/L,κ/λ 2.63。
血液 WBC 6.7×109/L,N/L 41.40/45.7,血红蛋白98 g/L,PLT 193×109/L。总蛋白29.4 g/L,Alb 19.1 g/L,球蛋白10.3 g/L,尿素氮3.68 mmol/L,SCr 53.92 μmol/L,eGFR>90 ml/(min·1.73m2),尿酸279 μmol/L。胆红素及转氨酶正常,碱性磷酸酶45 U/L,γ谷酰转肽酶22 U/L,乳酸脱氢酶236 U/L,总胆固醇9.76 mmol/L,三酰甘油6.14 mmol/L,前白蛋白144 mg/L,钙 1.78 mmol/L,C反应蛋白<0.50 mg/L,D-二聚体阴性,血糖及电解质正常。
免疫学 ANA 1∶ 128,抗ds-DNA抗体阴性,抗磷脂酶A2受体(PLA2R)抗体阴性,ENA多肽抗体谱、抗C1q抗体,抗心磷脂抗体、狼疮抗凝因子、抗β2-糖蛋白1抗体均阴性,自身免疫性肝病及甲状腺相关抗体阴性。免疫球蛋白IgG 4.33 g/L,IgA 0.531 g/L,IgM 0.611 g/L,IgE 607.0 IU/ml,ASO及RF阴性,补体C3 0.8 g/L,补体C4 0.1 g/L。外周血淋巴细胞亚群:CD3+/CD4+/CD8+2012/808/1056个/μl,CD20 511个/μl,调节性T细胞46个/μl。血κ轻链 42.3 mg/L,血λ轻链35.94 mg/L,κ/λ 1.17。免疫固定电泳未见异常。HBsAg阴性,HCV-Ab阴性。
骨髓细胞学检查 骨髓增生尚活跃,淋巴系比例稍高,占46%。
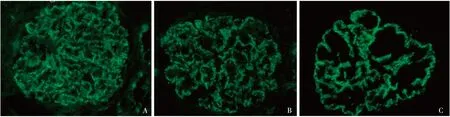
图2 IgG++(A)、IgG1++(B)、IgG4+++(C),呈颗粒状弥漫沉积于肾小球毛细血管袢(IF,x 400)
辅助检查
双肾B超 左肾:135 mm×50 mm×67 mm;右肾:115 mm×46 mm×57mm,结构清楚,双肾动脉及静脉未见异常。
CT 胸部CT:右肺下叶少许炎症、双侧少量胸腔积液、心包少量积液。腹部CT:肝胆胰脾未见异常,少量盆腔积液。头颅CT未见异常。
其他 心电图及上消化道钡餐均正常。
肾脏病理
光镜 11个肾小球中1个节段硬化,2个肾小球袢皱缩,囊壁增厚分层、囊周纤维化。余肾小球毛细血管袢开放好、僵硬状,系膜区轻~中度增宽,系膜细胞增生伴基质增多,节段系膜溶解。PASM-Masson:肾小球上皮侧较多嗜复红物沉积(图1)。肾小管间质慢性病变轻~中度,皮质多处小灶性肾小管萎缩、基膜增厚,伴中度急性病变,灶性肾小管上皮细胞刷状缘脱落,皮质间质纤维化+,小灶性水肿,少量单个核细胞浸润,小灶性聚集,亦见散在嗜酸性粒细胞,髓质间质纤维化++~+++。小动脉节段透明变性。
上世纪九十年代,随着中国企业实力的不断增强,大型国企开始了“走出去”的步伐。一些大型国企如中国石油、中国石化、中国电网、中国建设、中国铁路等,在“走出去”的过程中,在国际同类行业中逐步获得较高知名度,成为全球500 强中很具实力的知名企业,成为全球经济可持续发展的重要推动力量,成为中国深度参与全球治理,对外展示文明大国、东方大国、负责任大国和社会主义大国形象最活跃、最典型的代言人。总结国有企业在海外的形象主要呈现了三个方面的特点:
免疫荧光 IgG++、C3++,呈颗粒状弥漫分布于肾小球毛细血管袢(图2A); IgM+,呈颗粒状沉积节段分布于肾小球毛细血管袢;IgA、C1q阴性。IgG亚型染色:IgG1++(图2B)、IgG2+、IgG3+、IgG4+++(图2C),呈颗粒状弥漫分布于肾小球毛细血管袢。轻链染色:κ轻链++、λ轻链++,呈颗粒状弥漫分布于血管袢。PLA2R染色阴性。
电镜 观察1个肾小球。肾小球毛细血管袢开放好,基膜上皮侧较多高电子密度的致密物沉积,致密物周围见细小钉突形成,部分致密物被包绕至基膜内,个别袢见插入和新的基膜形成,节段基膜内皮下疏松、区域增宽,偶见外周袢融合。肾小球节段系膜区轻度增宽,系膜基质增多,系膜区未见明确电子致密物沉积。肾小球足细胞足突融合广泛(70%~80%),胞质内较多空泡(图3)。
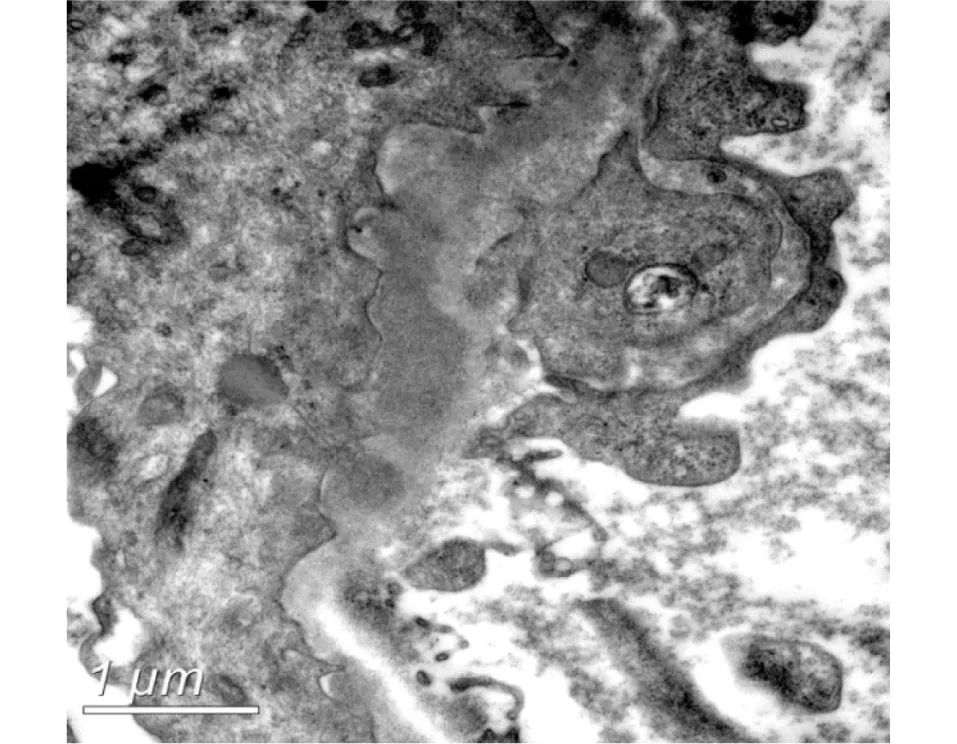
图3 肾小球基膜上皮侧较多高电子密度的致密物沉积,致密物周围见细小钉突形成(EM)
小结:(1)肾小球膜性病变伴系膜增生,节段系膜溶解;(2)肾小管间质中度慢性病变合并中度急性病变。
诊疗分析
本例患者临床特点如下:(1)中年女性,因急性非淋巴细胞白血病行allo-HSCT,移植前无肾脏疾病史;(2)allo-HSCT术后6个月发现尿检异常,停免疫抑制剂后尿检异常加重,入院时临床表现肾病综合征伴大量镜下血尿,血压及肾功能正常;(3)肾脏病理提示肾小球膜性病变,血清抗PLA2R抗体阴性,肾组织PLA2R染色亦阴性,免疫荧光IgG4染色阳性强于IgG1;(4)allo-HSCT术后11个月时曾出现带状疱疹及肺部感染;(5)病程中全身皮肤未见扁平苔藓、红斑、色素减退及色素沉着,无恶心呕吐及腹泻,无面部红斑、光过敏、关节疼痛及不规则发热,无口干及眼干等表现,除ANA阳性外,其他自身抗体阴性,补体正常。患者肾脏损害的病因需要考虑以下几种可能。
血白病相关肾脏损害 患者原发疾病为急性非淋巴细胞白血病,其肾脏损害应首先除外与白血病相关。血白病相关肾脏损害多为白血病细胞的直接浸润或代谢物导致肾脏损伤, 也可通过免疫反应、电解质紊乱损伤肾脏,临床表现为梗阻性肾病、肾病综合征或肾炎综合征、急慢性肾功能不全等。白血病相关肾脏损害的临床表现通常随着白血病的缓解而缓解,白血病复发后肾脏病再次出现或加重。本例患者在确诊白血病时无肾脏受累,化疗及allo-HSCT后白血病明显缓解后才出现肾脏损害,肾脏病理也未见白血病细胞浸润,故不支持白血病相关肾损害的诊断。
药物相关肾脏损害 allo-HSCT患者整个治疗过程中需要使用抗肿瘤药物、抗生素、免疫抑制剂等药物,大剂量抗肿瘤药物会破坏体细胞, 产生大量尿酸, 引起高尿酸血症, 导致急性肾损害, 主要表现为肾小管功能障碍、肾内梗阻、急性肾损伤和慢性肾衰竭,甚至溶血尿毒症综合征, 而本例患者无高尿酸血症及急性肾损伤表现,而且患者的肾脏损害并非发生在化疗期间,所以不支持化疗药物导致的肾脏损害。白血病及allo-HSCT患者常需要抗生素治疗,可造成急性间质性肾炎或急性肾小管坏死,临床表现为急性肾损伤。本例患者临床表现为肾病综合征伴大量镜下血尿,肾脏病理表现为膜性肾病,因此不支持抗生素导致的肾脏损害。患者曾接受CsA治疗8个月,应注意有无CsA导致的肾脏中毒或血栓性微血管病可能。本例患者临床表现大量蛋白尿及大量血尿,停用CsA后尿检加重,肾脏病理未见CsA中毒的典型小管间质和间质小血管病变,故不支持CsA导致的肾脏损害。
移植物抗宿主病(GVHD) GVHD是allo-HSCT术后的主要并发症,严重影响allo-HSCT患者的长期生存。在allo-HSCT后出现肾脏损害的患者,应首先排除原发血液系统疾病和药物导致肾脏损害及血栓性微血管病。对于allo-HSCT术后出现膜性肾病,也必须排除已知的能够导致膜性肾病的疾病,如系统性红斑狼疮、类风湿性关节炎、慢性乙型病毒性肝炎、实体肿瘤等。
最后诊断 (1)异基因造血干细胞移植术后;(2)移植物抗宿主病相关膜性肾病。
治疗及随访情况 患者以肾病综合征伴大量镜下血尿入院,无高血压及肾功能损害,肾脏病理提示肾小球膜性病变。明确诊断后于入院8d予泼尼松30 mg/d,入院10d时出现发热伴鼻塞涕咳嗽咳白色黏痰,体温最高达38.3 ℃,胸部CT示右肺下叶少许炎症,将泼尼松减量至20 mg/d,同时予头孢哌酮舒巴坦1.5g 1次/8h静滴抗感染治疗后肺部感染好转。1个月后加用他克莫司(FK506)4 mg/d,2个月后复查尿蛋白定量降至4.25 g/24h,RBC降至22万/ml,Alb升至31.8 g/L,SCr稳定。
讨 论
GVHD是移植物中淋巴细胞(主要是T细胞)识别宿主抗原而致敏、增殖、分化,直接或间接攻击受者靶组织而发生的一种排斥反应, 是allo-HSCT的主要并发症,也是移植后非复发死亡的主要原因之一。GVHD的发生率受供者HLA相配程度、移植物中T细胞数量、患者年龄及预防性措施的影响,其涉及的靶器官主要包括免疫系统、皮肤、肝脏和消化道等,因各靶器官受累的程度不同使GVHD患者的病情呈多样化。通常以移植后100d为界,100d内发生的GVHD为急性GVHD(aGVHD),100d后发生者为慢性GVHD(cGVHD)[1]。
aGVHD是一个复杂的病理过程,一般认为大致可分为三个阶段[2]:(1)放化疗预处理引起受者组织炎症性损伤,激活抗原递呈细胞,分泌炎症因子,并上调抗原递呈细胞表面黏附分子表达,增强供者成熟T淋巴细胞识别受者抗原能力;(2)供体T淋巴细胞激活期,供受体抗原递呈细胞和炎症因子靶向激活供体T细胞,扩增和分化为效应细胞;Th1/Th2细胞失衡,产生大量细胞因子[γ干扰素(IFN-γ)、肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)等]形成细胞因子风暴,近年发现调节性T细胞、NK细胞、NKT细胞、B 细胞也在aGVHD 发生中起重要作用;(3)炎症效应期,效应细胞介导细胞毒攻击靶组织,最终引起宿主靶组织(皮肤、黏膜、肝脏、肠道)损伤和全身aGVHD。cGVHD的发病机制更为复杂,其病理过程有两大特征:(1)移植后胸腺功能受损,体内自身反应性供者T细胞逃逸胸腺负选择,且以Th2细胞占优势;(2)这些自身反应性T细胞持续存在,识别宿主抗原递呈细胞的MHCII类分子抗原,促进B细胞合成抗宿主组织抗原的多种抗体,引起类似于自身免疫疾性疾病的病理损害[3]。
aGVHD发病率高达30%~80%,多累及皮肤、肝脏、消化道等器官,可引起皮肤、肝脏和消化道上皮细胞坏死,临床表现为皮肤局部或全身性斑丘疹, 黄疸、肝酶升高或口腔溃疡、腹泻、血便等。cGVHD的发病率为60%~70%,依次累及皮肤(65%~80%)、口腔(48%~72%)、肝脏(40%~73%)、眼(18%~47%)、胃肠道/体重下降(16%~26%)、肺(10%~15%)、食管(6%~8%)和关节(2%~12%)[4]。部分患者cGVHD的临床症状与一些自身免疫性疾病如系统性硬化、干燥综合征、原发性胆汁性肝硬化或多发性肌炎等类似或相关[5]。
2005年,美国国立卫生研究院专家制定了GVHD的诊断标准[1]。移植100d内出现的斑丘疹、红皮样皮损、恶心呕吐、厌食、大量腹泻、肠梗阻或胆汁淤滞性肝炎,临床诊断为经典aGVHD。上述表现即使发生在100d后也应判定为aGVHD,特别是患者出现肝脏受累(转氨酶升高,胆汁瘀滞)或是肠道受累(胃、小肠或结肠功能障碍导致的恶心、呕吐、腹泻及体重减轻),若不伴发cGVHD的诊断或特征性表现,应被列入持续型、复发型或迟发型aGVHD。移植后出现至少1项cGVHD而非aGVHD的典型的临床症状(如皮肤异色病、巩膜硬化、口腔苔藓样改变)即可诊断为cGVHD。如果移植后出现至少1项有高度提示性的cGVHD的特征性症状(如指甲营养不良、白斑样色素脱失、闭塞性细支气管炎),同时同一器官或其他器官的实验室和病理检查支持cGVHD,也可诊断为cGVHD。cGVHD的诊断必须排除感染或其他原因。
allo-HSCT后肾病综合征较少见,文献报道发生率为0.6%~3.8%[6-8],肾脏病理可为表现为肾小球膜性病变、微小病变,少数为系膜增生性肾小球肾炎、系膜毛细血管性肾小球肾炎和局灶节段性肾小球硬化等。目前多数学者认为HSCT术后出现肾病综合征就是GVHD的一种表现,其原因如下:(1)通过将亲代小鼠T细胞注射至MHC不相容的F1代体内诱导cGVHD建立的狼疮性肾炎实验研究发现,动物表现为重度蛋白尿和多种自身抗体阳性,肾脏组织形态学表现为免疫复合物介导的膜性病变[9]。(2)肾脏损害发生与减停免疫抑制剂有关,肾病综合征通常发生在减撤免疫抑制剂1~5个月。(3)约70%慢性GVHD患者体内出现高水平的自身抗体,如抗核抗体、抗双链DNA抗体及抗平滑肌抗体[3],部分HSCT术后肾病综合征患者也可以检测到抗核抗体的存在。(4)采用CD20单抗治疗难治性cGVHD时肾病综合征也可同步缓解[10]。有作者试图采用微嵌合体理论来解释GVHD相关膜性肾病,即allo-HSCT受者是一个微嵌合体,其体内存在来自异基因供体的骨髓干细胞,可在受者体内产生针对受体足细胞足突抗原和裂孔隔膜成分(如nephrin)的抗体[11]。后者攻击受者体内的足细胞抗原而导致膜性病变发生。但其确切发生机制仍有待深入研究。
Huang等[12]报道了allo-HSCT术后膜性肾病的临床病理特征,5例患者均表现为肾病综合征,3例ANA阳性,4例血清抗PLA2R抗体阴性,5例患者肾组织IgG亚型均以IgG4和IgG1沉积为主。Terrier等[13]总结文献报道的24例allo-HSCT后膜性肾病,其中5例患者在诊断膜性肾病后才出现GVHD的其他系统症状。因此本例allo-HSCT后膜性肾病患者,虽然目前暂未出现GVHD的典型皮肤黏膜、消化道、肝脏等特征性表现,但仍考虑其肾小球膜性病与GVHD相关,在随访中应关注是否发生其他系统损害。
与特发性膜性肾病相比,GVHD相关膜性肾病对免疫抑制剂的反应较好[8]。Huang等[12]报道的5例HSCT术后膜性肾病患者,在免疫抑制剂治疗后,1例获得完全缓解,4例获得部分缓解。Terrier等[13]报道的5例GVHD相关膜性肾病患者,经激素联合免疫抑制剂治疗后,4例临床有效,仅1例尿蛋白无缓解,血白蛋白持续低下。本例患者亦在激素联合FK506治疗2个月后尿检改善。
总之,allo-HSCT后GVHD相关膜性肾病可不伴有GVHD多系统受累的典型表现,但应当首先除外其他原因继发的肾小球膜性病变和肾脏损害。
1 Filipovich AH, Weisdorf D,Pavletic S,et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease:Ⅰ.Diagnosis and staging working group report. Biol Blood Marrow Transplant,2005,11(12):945-956.
2 Ferrara JL,Levine JE,Reddy P,et al. Graft-versus-host disease. Lancet,2009,373(9674):1550-1561.
3 Svegliati S,Olivieri A,Campelli N,et al. Stimulatory autoantibodies to PDGF receptor in patients with extensive chronic graft-versus-host disease. Blood,2007,110(1): 237-241.
4 Higman MA,Vogelsang GB. Chronic graft versus host disease. Br J Haematol,2004,125(4):435-454.
5 Vinzio S,Lioure B,Grunenberger F,et al. [Auto-immune-like disease post-bone marrow transplantation]. Rev Med Interne,2004,25(7):514-523.
6 Brukamp K,Doyle AM,Bloom RD,et al. Nephrotic syndrome after hematopoietic cell transplantation: do glomerular lesions represent renal graft-versus-host disease? Clin J Am Soc Nephrol,2006,1(4):685-694.
7 Imai H,Oyama Y,Miura AB,et al. Hematopoietic cell transplantation related nephropathy in Japan. Am J Kidney Dis,2000,36(3):474-480.
8 陈瑶,黄晓军,张晓辉,等. 异基因造血干细胞移植后并发肾病综合征的单中心临床分析. 中华内科杂志,2011,50(7):572-575.
9 Bruijn JA,van Elven EH,Hogendoorn PC,et a1.Murine chronic graft-versus—host disease as a model for lupus nephritis.Am J Pathol,1988,130(3):639-641.
10 Rao PS.Nephrotic syndrome in patients with peripheral blood stem cell transplant. Am J Kidney Dis,2005,45(4):780-785.
11 Nagahama K,Maru K,Kanzaki S,et al. Possible role of autoantibodies against nephrin in an experimental model of chronic graft-versus-host disease. Clin Exp Immunol,2005,141(2):215-222.
12 Huang X,Qin W,Zhang M,et al. Detection of anti-PLA2R autoantibodies and IgG subclasses in post-allogeneic hematopoietic stem cell transplantation membranous nephropathy. Am J Med Sci,2013,346(1):32-37.
13 Terrier B,Delmas Y,Hummel A,et al. Post-allogeneic haematopoietic stem cell transplantation membranous nephropathy: clinical presentation,outcome and pathogenic aspects. Nephrol Dial Transplant,2007,22(5):1369-1376.
(本文编辑 心 平 律 舟)
Glomerular disease after allogeneic hematopoietic stem cell transplantation
LIUZhengzhao,XIEHonglang,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
A-50-years-old female underwent allogeneic hematopoietic stem cell transplantation because of acute non-lymphocytic leukemia,after six months she appeared abnormal urinalysis,the disease gradually progressed to nephrotic syndrome with microscopic hematuria, normal serum creatinine, serum anti-phospholipase A2 receptor antibody negative, renal biopsy shows membranous nephropathy, diagnosis is considered to be graft versus host disease associated membranous nephropathy. patients achieved partial response after prednisone 2 months combine tacrolimus 1month.
allogeneic hematopoietic stem cell transplantation graft versus host disease membranous nephropathy
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-09-01
