移植肾抗体介导的排斥反应的诊治新进展
2015-06-09综述文吉秋审校
李 雪 综述 文吉秋 审校
·肾脏移植·
移植肾抗体介导的排斥反应的诊治新进展
李 雪 综述 文吉秋 审校
肾移植是终末期肾病有效的治疗手段之一,但抗体介导的排斥反应(ABMR)是影响移植肾预后的最严重最危险的因素。以往ABMR是以C4d在移植肾肾小管周围毛细血管(PTC)沉积作为诊断标准,最近提出了C4d阴性的ABMR,使得ABMR检出率大大提高。影响ABMR预后的危险因素包括C4d在移植肾PTC沉积、供者特异性抗体(DSA)、与补体结合的DSA及亚临床ABMR。ABMR的治疗策略主要是清除预存抗体和抑制新抗体的产生,抑制新抗体产生的治疗包括使用抗CD20单克隆抗体、硼替佐米、抗C5a单克隆抗体等方法。
肾移植 抗体介导的排斥反应 诊断 治疗
随着配型技术的提高和免疫抑制剂的发展,近十年来,移植肾的一年存活率得到了显著提高,但移植肾的长期存活率并未得到明显改善[1]。抗体介导的排斥反应(ABMR)是影响移植肾远期预后的首要因素[2]。最近随着对ABMR研究深入,在诊断方法、检测抗体技术、预后影响因素的研究均有新的进展。而在治疗上,随着对其机制的深入认识,也有很多新药出现。本文就ABMR的诊疗进展做一综述。
ABMR的发病机制
ABMR的细胞和分子机制仍有待阐明,目前认为B细胞和浆细胞活化产生供者特异性抗体(DSA),后者与内皮细胞上的人类白细胞抗原(HLA)或非HLA分子结合造成内皮细胞的损伤是ABMR的主要机制[3]。
抗体与内皮细胞结合,通过补体依赖与非补体依赖途径募集自然杀伤细胞(NK细胞)、多形核中性粒细胞和巨噬细胞,从而导致毛细血管炎和组织损伤[3](图1)。急性ABMR(aABMR)在形态学上主要表现为血小板聚集、血栓性微血管病(TMA)和中性粒细胞聚集,进而导致细胞坏死和急性移植肾功能不全。慢性ABMR(cABMR)源于反复的微血栓形成和炎性改变,表现为移植肾肾小球病(TG)和移植肾功能下降[4]。除了直接由抗体导致的病理改变,B细胞和浆细胞也参与排斥和免疫耐受。
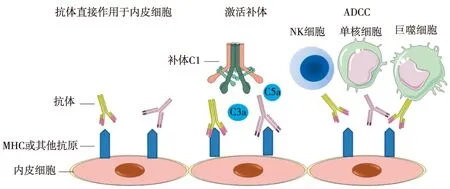
图1 抗体介导排斥反应的发生机制[3]MHC:主要组织相容性复合体;ADCC:抗体依赖的细胞介导的细胞毒作用;NK细胞:自然杀伤细胞
ABMR的诊断标准
早期对ABMR的诊断主要强调两个方面:管周毛细血管炎、中性粒细胞浸润和新出现的HLA Ⅰ类抗体[5]。1993年,Feucht等[6]发现补体C4被激活后的终末裂解产物C4d可特异沉积于肾小管周围毛细血管(PTC)内皮,并被认为是aABMR的特异性标志物。直到2003年Banff会议根据临床病理和免疫学发现,对细胞性排斥(TCMR)和ABMR进行了明确地区分[7]。2013年的Banff会议进一步明确了ABMR的诊断标准,包括血清中存在DSA,DSA与血管内皮相互作用,最终导致组织损伤。值得注意的是,C4d不再作为ABMR诊断的必要条件(表1)[8]。

表1 ABMR的分类标准(Banff 2013)
ABMR:抗体介导的排斥反应;ENDAT:内皮激活和损伤转录;cg:Banff慢性肾小球病分数;g:Banff肾小球炎分数;v:Banff血管炎分数;ptc:肾小管周围毛细血管
C4d与ABMR C4d是补体C4活化的裂解产物,是通过不同的补体激活途径裂解产生的补体片段,可与血管内皮细胞和基膜结合。C4d可稳定保持数小时至数月,一直以来被认为是ABMR重要的标志物[9]。但C4d诊断ABMR的敏感度很低,其表达与PTC的密度呈正比[9]。因此,近年来很多研究提出了C4d阴性ABMR的概念。Loupy等[10]研究发现,55%的C4d阴性ABMR存在管周毛细血管炎,Einecke等[2]发现63%的晚期移植肾失功可能与ABMR有关,而其中很多为C4d阴性。总之,在缺血的组织,如急性肾小管损伤(ATN)和移植肾延迟恢复(DGF)的组织中很少见C4d沉积。虽然C4d诊断ABMR敏感度差,假阳性率较高,但其仍是ABMR的重要标记物。血清DSA与C4d呈现很好的相关性,而C4d阳性是移植肾丢失的独立危险因素。
DSA与ABMR 器官移植体液免疫理论的建立与抗体检测的技术息息相关。1914年染料排除试验的建立使人类最早发现了细胞毒抗体[11]。50年后的Terasaki等[11]建立了微量淋巴毒检测方法证实了血清中存在HLA抗体。
1987年,Bjorkman等[12]在鉴定HLA分子结构方面做出了重大突破。有了这样的基础,通过重组细胞株可获得单一抗原特异性,并由此促成了Luminex单一抗原微珠检测技术的诞生,进而精确地检测出抗体的特异性,包括针对供者的抗体,即DSA[13]。DSA可直接针对HLA或其他内皮细胞抗原,目前已成为ABMR的诊断的必要条件[14]。一项系统性分析表明,移植前预存的DSA使急性排斥的风险升高2倍,使移植肾失功的风险升高75%[15]。体外研究证实HLA I类抗体可通过补体依赖和非补体依赖途径激活的损伤内皮细胞[16]。值得注意的是,并非所有的DSA均可与补体结合并引起ABMR,有些病理表现为毛细血管炎及C4d阳性的病例并未检测到DSA,实际上,大多数DSA阳性的患者移植肾功能正常,与DSA阴性的患者长期存活率相当[17]。
TG与ABMR TG是慢性移植肾损伤的一种特殊病理改变,主要表现微循环内皮细胞的反复损伤和重塑。典型的TG光镜下可见肾小球外周袢双轨样改变,肾小球系膜基质增多,电镜下可见外周袢肾小球基膜分层,伴有内皮肿胀和内皮窗孔的消失,免疫荧光染色无明显免疫复合物的沉积;早期的TG主要依靠电镜诊断,电镜下肾小球外周袢基膜分层,内皮肿胀和内皮窗孔的消失[18]。HLA Ⅱ类抗体是导致TG的主要原因,一些研究认为,自身抗体、丙型肝炎病毒抗体等因素也可导致TG样改变[19],诊断时应注意鉴别。总之,cABMR是诱发TG的主要原因,与TG关系密切。
影响ABMR预后的危险因素
急性和慢性ABMR均与移植肾的预后不良相关,既往出现aABMR的患者再发排斥反应和出现cABMR的风险显著增加,而曾经诊断为cABMR的患者移植肾丢失的风险也显著提高。即使如此,并非所有的ABMR预后均差,一些ABMR患者在治疗后移植肾功能可长期稳定。以下我们综述影响ABMR预后的危险因素,包括C4d、DSA、与补体结合的DSA及亚临床ABMR。
C4d 对于aABMR,C4d是再次出现排斥、发展为cABMR和移植肾失功的独立的生物标志物。Djamali等[20]对致敏受者移植肾血液开放后的零点活检标本进行研究后发现,局灶C4d沉积对之后的ABMR有预测价值;Loupy等[10]发现弥漫和局灶的C4d沉积患者的微血管炎症无明显差别。而术后3个月常规活检时出现微血管炎症和HLA Ⅱ类的DSA的患者之后cABMR的发病率是对照组的4倍。
C4d和内皮细胞损伤同样是cABMR预后不良的危险因素。Gaston等[21]对173例肾移植10年以上受者影响预后的因素进行分析,试图对导致其移植肾功能不全的原因进行分析,结果发现大多数患者存在抗体介导的相关损伤(C4d或DSA),且C4d是影响后期移植肾预后的独立危险因素。其他研究也证实局灶或弥漫的C4d沉积与cABMR移植物丢失有关[22]。
DSA及与补体结合的DSA(C1q-DSA、C3d-DSA) 预存的和新产生的抗体都会对移植肾的生存率产生影响。这些抗体可针对内皮细胞上的HLA和非HLA分子,包括MICA和血管紧张素Ⅰ类受体。2011年Banff会议将aABMR分为两型,Ⅰ型主要见于术前预存抗体的患者,排斥主要发生于术后早期;Ⅱ型主要见于术后后期新出现DSA的患者,目前认为主要与免疫抑制不足和患者依从性差有关。由于Ⅱ型抗体主要见于术后晚期的ABMR,因此,与Ⅰ型相比,Ⅱ型抗体与移植肾失功密切相关。
DSA的临床意义与其平均荧光强度(MFI)相关,也与其与补体结合的能力相关。最近的研究表明,与C1q结合的DSA(C1q-DSA)是移植肾失功的独立危险因素[23]。C1q是构成补体C1的一个重要成分,由6个相同的亚单位组成对称的六聚体,当两个以上的C1q与免疫复合物中的IgM或IgG的Fc段结合后,C1q构型发生改变,启动补体经典激活途径。Loupy等[23]根据DSA(+/-),DSA-C1q(+/-),MFI值(是否>6 000)将1 016例肾移植受者分为5组并观察其预后,结果发现,与DSA的MFI值相比,C1q-DSA的意义更大。在其他实体器官移植中(如心脏移植)也可见相似的现象。这些研究也表明由DSA导致的补体级联激活是ABMR发展的主要机制,而并非所有的DSA均可结合并激活补体系统。法国Sicard等[24]探索应用DSA与补体C3d结合能力(C3d-DSA)来评价移植肾失功的风险,发现C3d-DSA是强烈的独立预示移植肾失功因子,且较C1q-DSA评价指标更佳,对AMR患者更能准确预示移植肾失功。
亚临床ABMR 亚临床ABMR的诊断需要符合两点,一是移植肾功能正常,二是满足ABMR诊断标准。目前研究表明亚临床排斥也是影响移植肾预后的重要因素。Loupy等[23]对54例术前存在DSA的肾移植受者进行了观察,在术后3个月的常规活检中,17例受者诊断为亚临床排斥反应;在术后一年重复肾活检时,亚临床排斥的受者间质纤维化/肾小管萎缩(IFTA)程度和TG的发生率均较对照组高。因此,我们认为对于高危患者(如术前或术后检测到DSA、CDC阳性),常规活检是必要的。而对于亚临床ABMR的受者,有必要进行积极的干预。
ABMR的治疗
目前认为之前所谓的“耐激素排斥反应”即ABMR;激素主要通过杀伤和调节T细胞治疗排斥反应,对TCMR效果较好,而其治疗ABMR的有效率只有15%~30%[14]。抗胸腺细胞免疫球蛋白(ATG)可诱导B细胞和浆细胞的凋亡[25],但其单独治疗ABMR效果不佳。ABMR的治疗策略主要是清除预存抗体和抑制新抗体的产生。传统的清除预存抗体的方法包括血浆置换/免疫吸附(PE/IA)和静脉用人免疫球蛋白(IVIG),而随着对B细胞和补体系统的深入研究,近年来针对ABMR的治疗出现了一些新的药物,包括利妥昔单抗、硼替佐米、依库丽单抗(eculizumab)等。上述药物单独或联合使用,对ABMR的预防和治疗提供了新的思路(图2)。
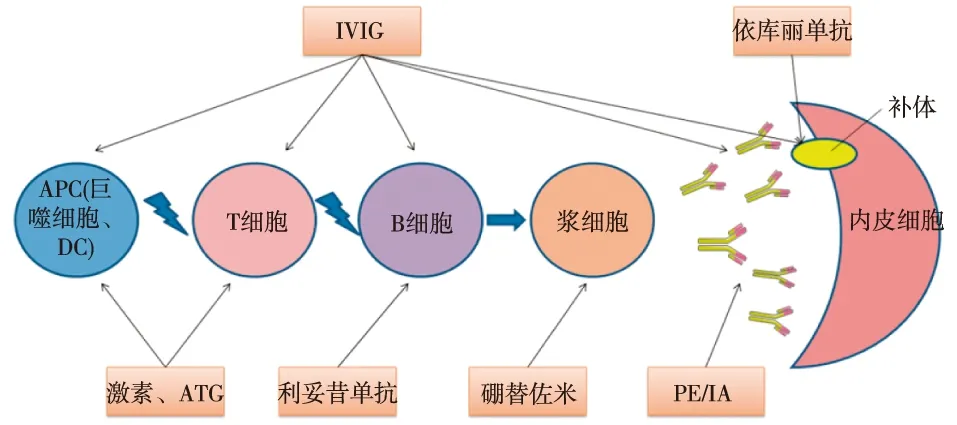
图2 ABMR的治疗[3]ABMR:抗体介导的排斥反应;APC:抗原提呈细胞;ATG:抗胸腺细胞免疫球蛋白;IVIG:静脉用人免疫球蛋白;PE/IA:血浆置换/免疫吸附;DC: 树突状细胞
PE/IA PE/IA可快速清除抗体,是治疗aABMR的重要手段[26]。但治疗结束后血浆抗体浓度发生反跳,故PE/IA并非病因性治疗,只是比药物更迅速、有效地降低抗体的浓度,终止由此导致的组织损害,使疾病暂时得到控制。
IVIG IVIG对B细胞和T细胞均有免疫调节作用,因此也常应用于高敏肾移植患者术前的脱敏治疗。IVIG还可以诱导B细胞凋亡并调节B细胞信号传导,大剂量IVIG可与DSA结合并减轻DSA导致的移植肾损伤[26]。
虽然改善全球肾脏病预后组织(KDIGO)推荐IVIG作为aABMR的治疗方案[27],目前仍缺少IVIG的随机对照研究(RCT)。多项回顾性研究证实IVIG治疗aABMR的有效率为50%~90%,而各项研究使用的IVIG的剂量也各有不同,也有IVIG与PP或激素联合使用的报道。
IVIG的半衰期为3~4周。输液反应一般在30 min内出现,可调整输液速度,一般无需特殊处理。罕见严重不良反应,主要包括血栓形成、溶血性贫血、急性肾衰竭和化脓性脑膜炎。
利妥昔单抗 利妥昔单抗是抗CD20人鼠嵌合抗体,早期主要用于非霍奇金淋巴瘤和类风湿关节炎的治疗。CD20表达于正常的初始B细胞与成熟B细胞,但不表达于干细胞、前B细胞、浆细胞。利妥昔单抗主要通过补体依赖的细胞毒作用和抗体依赖细胞介导的细胞毒作用导致细胞溶解。
目前已有多项研究证实利妥昔单抗联合血浆置换、激素或(和)IVIG对体液排斥治疗有效[28-29]。Faguer等[28]观察利妥昔单抗(不联合PP或IVIG)对8例aABMR患者的治疗效果,10月后仅有2例移植肾失功[28]。Mulley等[29]对8例aABMR的患者进行4周的利妥昔单抗联合PP及IVIG的治疗,治疗21月后移植肾存活率为100%。尽管如此,目前进行的利妥昔单抗对ABMR治疗的研究多为观察性研究及个案报道,且使用的治疗方案各异,其有效性尚待随机对照试验进一步证实。
感染是利妥昔单抗最常见的并发症,可见于半数的患者,包括巨细胞病毒、带状疱疹、多瘤病毒及真菌感染[28-29]。有报道利妥昔单抗可激活乙肝病毒的复制,因此建议乙肝核心抗体阳性的患者定期监测血清乙肝病毒的复制情况。利妥昔单抗使用一年内感染的风险都会增加,且不适合活疫苗的接种[30]。另有报道利妥昔单抗可出现致命的注射反应[30],常见于首次注射的30~100 min;因此,建议使用对乙酰氨基酚和抗组胺药作为预防用药。
硼替佐米 硼替佐米是高选择性蛋白酶体抑制剂,可特异性清除体内活化的浆细胞,主要批准用于多发性骨髓瘤患者的治疗。由于浆细胞是产生抗体的主要细胞,2008年,Everly等[31]最早尝试硼替佐米用于ABMR的临床治疗,取得了良好的效果。之后又有多项应用硼替佐米成功治疗ABMR的个案报道[32-33]。总的来说,85%~100%的患者可出现抗体平均荧光强度(MFI)值的下降,在血清肌酐<265.2 μmol/L或尿蛋白定量<1g/24h的患者中效果更佳[32]。另外,药物使用的时间对效果也有影响,早期的ABMR(肾移植术后半年之内)对硼替佐米的反应更好[33]。
硼替佐米的副作用基本是可控且可逆的,最常见的有胃肠道毒性、低血压、周围神经病变等。硼替佐米可导致骨髓抑制,血小板减少症的发生率高达32%,有些患者血小板数量可下降60%。但上述副作用在用药后10d内均可缓解。另外,由于硼替佐米主要通过细胞色素P450代谢,因此对于肝脏功能不全的患者需要调整药物剂量。
依库丽单抗和TNT003 依库丽单抗和TNT003是针对补体系统的单克隆抗体。依库丽单抗是一种直接作用于补体蛋白C5的人源单克隆抗体,可以阻止补体终末复合物的活化,最终抑制膜攻击复合物C5b-9的形成,在难治性ABMR及cABMR治疗中已有短期成功的报道[34]。TNT003 一种新型抗补体C1s的单克隆抗体,可抑制由抗HLA-Ⅰ类和Ⅱ类抗体诱导的补体活化,阻止补体经典途径的激活,减少HLA-I类和Ⅱ类抗体诱导的C3d沉积,阻断补体在内皮细胞的沉积以及补体分裂产物形成。TNT003的研究尚处于体外研究阶段,其有效性有待进一步试验证实[35]。
小结:ABMR是影响移植肾远期预后的首要因素,其诊断标准包括血清中存在DSA,DSA与血管内皮相互作用,最终导致组织损伤。影响ABMR患者预后的危险因素包括C4d、DSA、与补体结合的DSA及亚临床ABMR。ABMR的治疗策略主要是清除预存抗体和抑制新抗体的产生,近年来出现了一些针对ABMR的新药,为治疗提供了新的思路,但其疗效仍有待大样本、多中心的临床试验证实。
1 Lamb KE,Lodhi S,Meier-Kriesche HU.Long-term renal allograft survival in the United States:a critical reappraisal.Am J Transplant,2011,11(3):450-462.
2 Einecke G,Sis B,Reeve J,et al.Antibody-mediated microcirculation injury is the major cause of late kidney transplant failure.Am J Transplant,2009,9(11):2520-2531.
3 Farkash EA,Colvin RB.Diagnostic challenges in chronic antibody-mediated rejection.Nat Rev Nephrol,2012,8(5):255-257.
4 Drachenberg CB,Papadimitriou JC.Endothelial injury in renal antibody-mediated allograft rejection:a schematic view based on pathogenesis.Transplantation,2013,95(9):1073-1083.
5 Halloran PF,Wadgymar A,Ritchie S,et al.The significance of the anti-class I antibody response.I.Clinical and pathologic features of anti-class I-mediated rejection.Transplantation,1990,49(1):85-91.
6 Feucht HE,Schneeberger H,Hillebrand G,et al.Capillary deposition of C4d complement fragment and early renal graft loss.Kidney Int,1993,43(6):1333-1338.
7 Racusen LC,Halloran PF,Solez K.Banff 2003 meeting report:new diagnostic insights and standards.Am J Transplant,2004,4(10):1562-1566.
8 Haas M,Sis B,Racusen LC,et al.Banff 2013 meeting report:inclusion of c4d-negative antibody-mediated rejection and antibody-associated arterial lesions.Am J Transplant,2014,14(2):272-283.
9 Cohen D,Colvin RB,Daha MR,et al.Pros and cons for C4d as a biomarker.Kidney Int,2012,81(7):628-639.
10 Loupy A,Hill GS,Suberbielle C,et al.Significance of C4d Banff scores in early protocol biopsies of kidney transplant recipients with preformed donor-specific antibodies(DSA).Am J Transplant,2011,11(1):56-65.
11 Terasaki PI,Ozawa M.Predicting kidney graft failure by HLA antibodies:a prospective trial.Am J Transplant,2004,4(3):438-443.
12 Bjorkman PJ,Saper MA,Samraoui B,et al.Structure of the human class I histocompatibility antigen,HLA-A2.Nature,1987,329(6139):506-512.
13 Testi M,Andreani M.Luminex-Based Methods in High-Resolution HLA Typing.Methods Mol Biol,2015,1310:231-245.
14 Mengel M,Sis B,Haas M, et al.Banff 2011 Meeting report:new concepts in antibody-mediated rejection.Am J Transplant,2012,12(3):563-570.
15 Mohan S,Palanisamy A,Tsapepas D,et al.Donor-specific antibodies adversely affect kidney allograft outcomes.J Am Soc Nephrol,2012,23(12):2061-2071.
16 Zhang X,Reed EF.Effect of antibodies on endothelium.Am J Transplant,2009,9(11):2459-2465.
17 Wiebe C,Gibson IW,Blydt-Hansen TD,et al.Evolution and clinical pathologic correlations of de novo donor-specific HLA antibody post kidney transplant.Am J Transplant,2012,12(5):1157-1167.
18 Husain S,Sis B.Advances in the understanding of transplant glomerulopathy.Am J Kidney Dis,2013,62(2):352-363.
19 Baid-Agrawal S,Farris AB 3rd,Pascual M,et al.Overlapping pathways to transplant glomerulopathy:chronic humoral rejection,hepatitis C infection,and thrombotic microangiopathy.Kidney Int,2011,80(8):879-885.
20 Djamali A,Muth BL,Ellis TM,et al.Increased C4d in post-reperfusion biopsies and increased donor specific antibodies at one-week post transplant are risk factors for acute rejection in mild to moderately sensitized kidney transplant recipients.Kidney Int,2013,83(6):1185-1192.
21 Gaston RS,Cecka JM,Kasiske BL,et al.Evidence for antibody-mediated injury as a major determinant of late kidney allograft failure.Transplantation,2010,90(1):68-74.
22 Kedainis RL,Koch MJ,Brennan DC,et al.Focal C4d+ in renal allografts is associated with the presence of donor-specific antibodies and decreased allograft survival.Am J Transplant,2009,9(4):812-819.
23 Loupy A,Lefaucheur C,Vernerey D,et al.Complement-binding anti-HLA antibodies and kidney-allograft survival.N Engl J Med,2013,369(13):1215-1226.
24 Sicard A,Ducreux S,Rabeyrin M,et al.Detection of C3d-binding donor-specific anti-HLA antibodies at diagnosis of humoral rejection predicts renal graft loss.J Am Soc Nephrol,2015,26(2):457-467.
25 Zand MS,Vo T,Huggins J,et al.Polyclonal rabbit antithymocyte globulin triggers B-cell and plasma cell apoptosis by multiple pathways.Transplantation,2005,79(11):1507-1515.
26 White NB,Greenstein SM,Cantafio AW,et al.Successful rescue therapy with plasmapheresis and intravenous immunoglobulin for acute humoral renal transplant rejection.Transplantation,2004,78(5):772-774.
27 Kidney Disease:Improving Global Outcomes(KDIGO) Transplant Work Group.KDIGO clinical practice guideline for the care of kidney transplant recipients.Am J Transplant,2009,9(Suppl 3):S1-155.
28 Faguer S,Kamar N,Guilbeaud-Frugier C,et al.Rituximab therapy for acute humoral rejection after kidney transplantation.Transplantation,2007,83(9):1277-1280.
29 Mulley WR,Hudson FJ,Tait BD,et al.A single low-fixed dose of rituximab to salvage renal transplants from refractory antibody-mediated rejection.Transplantation,2009,87(2):286-289.
30 Kaposztas Z,Podder H,Mauiyyedi S,et al.Impact of rituximab therapy for treatment of acute humoral rejection.Clin Transplant,2009,23(1):63-73.
31 Everly MJ,Everly JJ,Susskind B,et al.Bortezomib provides effective therapy for antibody- and cell-mediated acute rejection.Transplantation,2008,86(12):1754-1761.
32 Flechner SM,Fatica R,Askar M,et al.The role of proteasome inhibition with bortezomib in the treatment of antibody-mediated rejection after kidney-only or kidney-combined organ transplantation.Transplantation,2010,90(12):1486-1492.
33 Walsh RC,Brailey P,Girnita A,et al.Early and late acute antibody-mediated rejection differ immunologically and in response to proteasome inhibition.Transplantation,2011,91(11):1218-1226.
34 Chehade H,Rotman S,Matter M,et al.Eculizumab to treat antibody-mediated rejection in a 7-year-old kidney transplant recipient.Pediatrics,2015,135(2):e551-555.
35 Thomas KA,Valenzuela NM,Gjertson D,et al.An Anti-C1s Monoclonal,TNT003,Inhibits Complement Activation Induced by Antibodies Against HLA.Am J Transplant,2015,15(8):2037-2049.
(本文编辑 心 平)
Antibody-mediated rejection in kidney transplantation: diagnosis and management
LIXue,WENJiqiu
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Kidney transplant is the preferred treatment of end-stage renal disease. One of the most challenging aspects of kidney transplant is the prevention and treatment of antibody-mediated rejection (ABMR), which is one of the main causes of graft dysfunction and early graft loss. Improved understanding of the roles of acute and chronic ABMR has evolved in recent years following major progress in the technical ability to detect and quantify recipient anti-HLA antibody production. Despite its prevalence and clinical significance, few well-studied treatment options have been proposed. Currently, plasmapheresis with or without immunoabsorption, high-dose intravenous immunoglobulin, rituximab, bortezomib and eculizumab have been proposed in the treatment of ABMR individually or in various combinations. Robust clinical trials are urgently needed to address this major cause of allograft loss. This review will summarize the current knowledge of the pathophysiology, diagnosis, and management of ABMR.
renal transplantation antibody-mediated rejection diagnosis treatment
国家自然科学基金(81570681)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-08-28
