(L)-2-氧代四氢噻唑-4-羧酸的合成研究及工艺改进
2015-06-09冯柏成于洪强
冯柏成,于洪强,解 东
(青岛科技大学 化工学院,山东 青岛 266042)
(L)-2-氧代四氢噻唑-4-羧酸作为一种重要的精细化工原料,是很好的手性酰基化试剂,而且可以手性识别,可作为对氨基衍生物如R,S-胺、R,S-氨基酸酯等的拆分试剂。另外,它的同类物质硫代噻唑烷羧酸也是很好的手性酰基化试剂[1]。(L)-2-氧代四氢噻唑-4-羧酸能与醇反应生成酯,这些酯能干扰黑色素的合成并且去除皮肤的死细胞[2],可用于化妆品的添加。
(L)-2-氧代四氢噻唑-4-羧酸是一种重要的有机合成中间体,目前已知的合成方法为:L-半胱氨酸盐酸盐和氯甲酸苯酯通过亲核加成消除反应[3]制备,L-半胱氨酸盐酸盐和氯甲酸乙酯也是通过亲核加成消除反应制备,但是此方法由于亲核试剂的原因产率低;(L)-2-氧代四氢噻唑-4-羧酸酯的水解[4]反应为酸和醇酯化反应的逆反应,对于工业化来说不经济;L-半胱氨酸盐酸盐与固体光气反应[5],固体光气在反应过程中有光气产生,对设备要求严格,不安全。
作者选择L-半胱氨酸盐酸盐和氯甲酸苯酯为主要原料合成(L)-2-氧代四氢噻唑-4-羧酸,并通过调节反应条件对合成工艺进行优化,合成目标产物,绿色安全,原料利用率高,对工业化具有积极的指导意义。
1 实验部分
1.1 试剂与仪器
L-半胱氨酸盐酸盐:食品级,质量分数99%,河南盛之德商贸有限公司;氯甲酸苯酯:化学纯,无锡贝诺精细化工有限公司;甲苯:化学纯,天津迪博化工股份有限公司;氢氧化钠、乙酸乙酯:化学纯,天津化学试剂三厂。
JJ-1 1000W型精密增力电动搅拌器、DF-101S型恒温油浴:巩义市英峪予华仪器有限公司;BILON-RE2LB型旋转蒸发仪:上海比朗仪器制造有限公司;Bruker500M型核磁共振仪:德国布鲁克公司;WZZ-2SS型旋光仪:上海物理光学仪器厂。
1.2 实验步骤
将NaOH 70 g(17.5 mol)加入440 mL水中溶解,并倒入烧瓶,降温至5~6 ℃。将L-半胱氨酸盐酸盐88 g(0.5mol)加入烧瓶中,氮气保护,搅拌5 min,升温至25 ℃,将氯甲酸苯酯109.55 g(0.7 mol)加到175 mL的甲苯中混合,用滴液漏斗滴加到烧瓶中,滴加完毕,水浴升温至40 ℃,反应2 h。将混合液倒入分液漏斗,分液,保留水相,并加100 mL甲苯搅拌10 min,分液留取水相。室温(31 ℃)下加盐酸约80 g于水相,调节pH值。搅拌水相30 min,得沉淀,静置,抽滤得白色沉淀38.06 g。剩余液体约500 mL,用乙酸乙酯萃取,旋蒸得固体15 g,共得53 g。将40 mL水和40 mL 盐酸混合,将白色沉淀加到混合溶液中搅拌并升温至使其溶解,后降温至使其重结晶,测定熔点为169~171 ℃。
2 结果与讨论
2.1 实验机理
(L)-2-氧代四氢噻唑-4-羧酸合成反应方程式见图1。

图1 (L)-2-氧代四氢噻唑-4-羟酸合成反应方程式
根据上述反应方程式,可能的反应机理见图2。
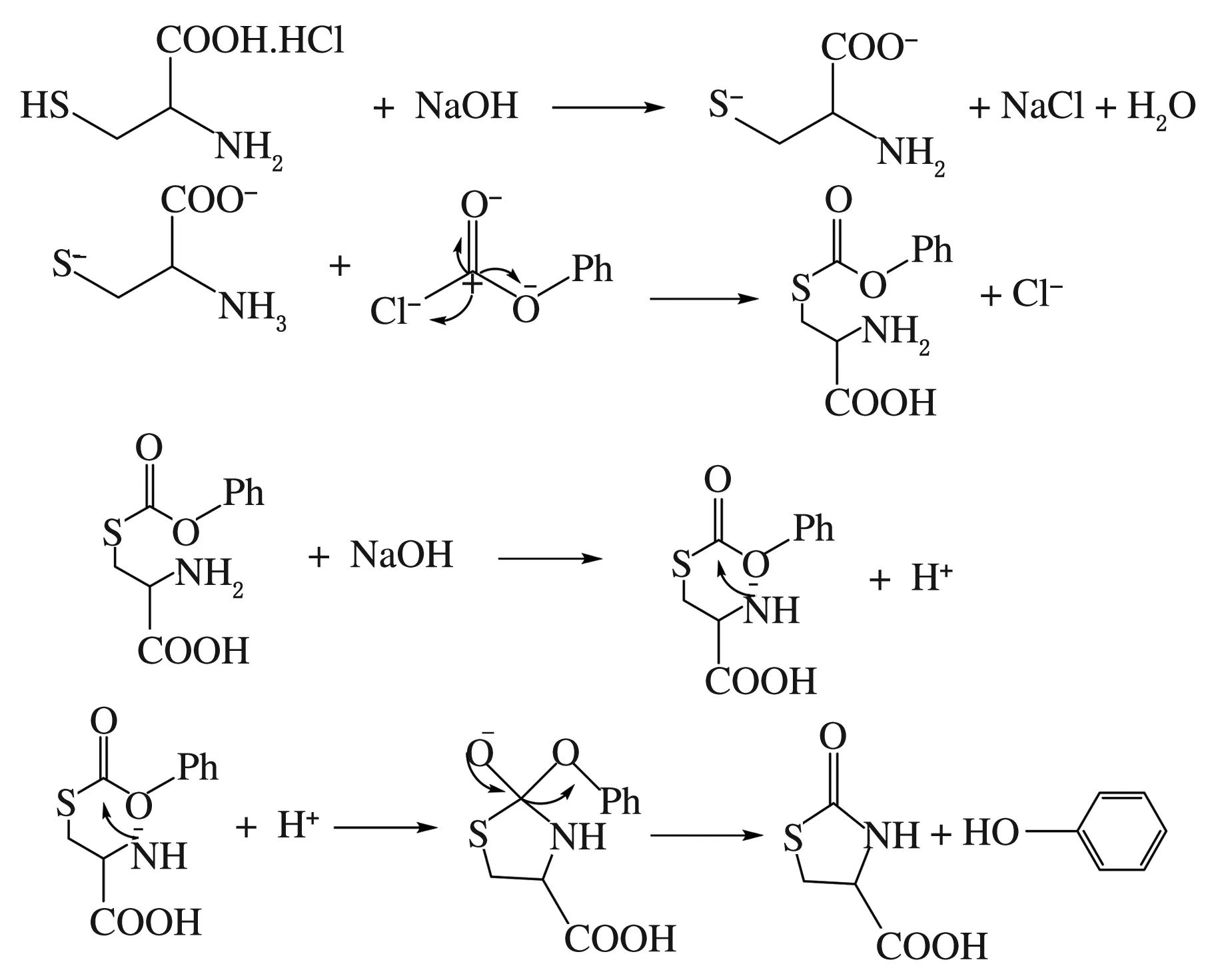
图2 (L)-2-氧代四氢噻唑-4-羧酸合成反应机理
在碱性环境下,一部分氢氧化钠先中和L-半胱氨酸盐酸盐中的盐酸,同时巯基变为硫负离子,氯甲酸苯酯中羰基碳受电负性影响呈现正电性,与硫负离子结合形成巯酯,由于RNH2为亲核试剂,与分子内酯基发生分子内的亲核加成消除反应[6],从而得到产物。
2.2 不同实验条件对反应的影响
2.2.1 n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)对收率的影响
原料配比对实验结果影响较大,在反应温度38 ℃,反应时间2h,pH=13的条件下,考察不同n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)对产物收率的影响,实验结果见图3。
由图3可见,随着n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)的增高,反应产率也在增高,在物质的量比达到1.6之后曲线变平缓,产率增加幅度变小,可能在此条件下,原料的利用率已达到饱和,继续增加物质的量比对原料转化率影响较小,所以,n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)=1.6即为较好的原料配比。

n(氯甲酸苯酯)∶ n(L-半胱氨酸盐酸盐)图3 n(氯甲酸苯酯)∶ n(L-半胱氨酸盐酸盐)对产物收率的影响
2.2.2 反应温度对收率的影响
温度对反应的影响比较直观,温度太低,反应可能不发生或转化率极低,而温度太高可能会有副产物生成甚至促成原料分解,所以合适的反应温度对反应来说至关重要。在n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)=1.6,反应时间2 h,pH=13的条件下,考察反应温度对产物收率的影响,结果见图4。

t/℃图4 反应温度对产物收率的影响
由图4可见,在相同的反应时间内,10 ℃时产物的收率只有5.3%,随着温度的提高,产品的收率也在提高。在40 ℃时达到60%以上。继续将温度升高,则产品收率开始下降。这是由于过高的温度导致了副反应的发生或者反应产物开始分解,虽然原料转化率在提高,但是反应的选择性在下降,最终导致了产物收率的下滑。结果表明:40 ℃是较好的反应温度。
2.2.3 反应时间对收率影响
在最佳反应温度40 ℃,n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)=1.6,反应pH=13,不同反应时间下进行反应,得到反应时间对收率的影响,结果见图5。
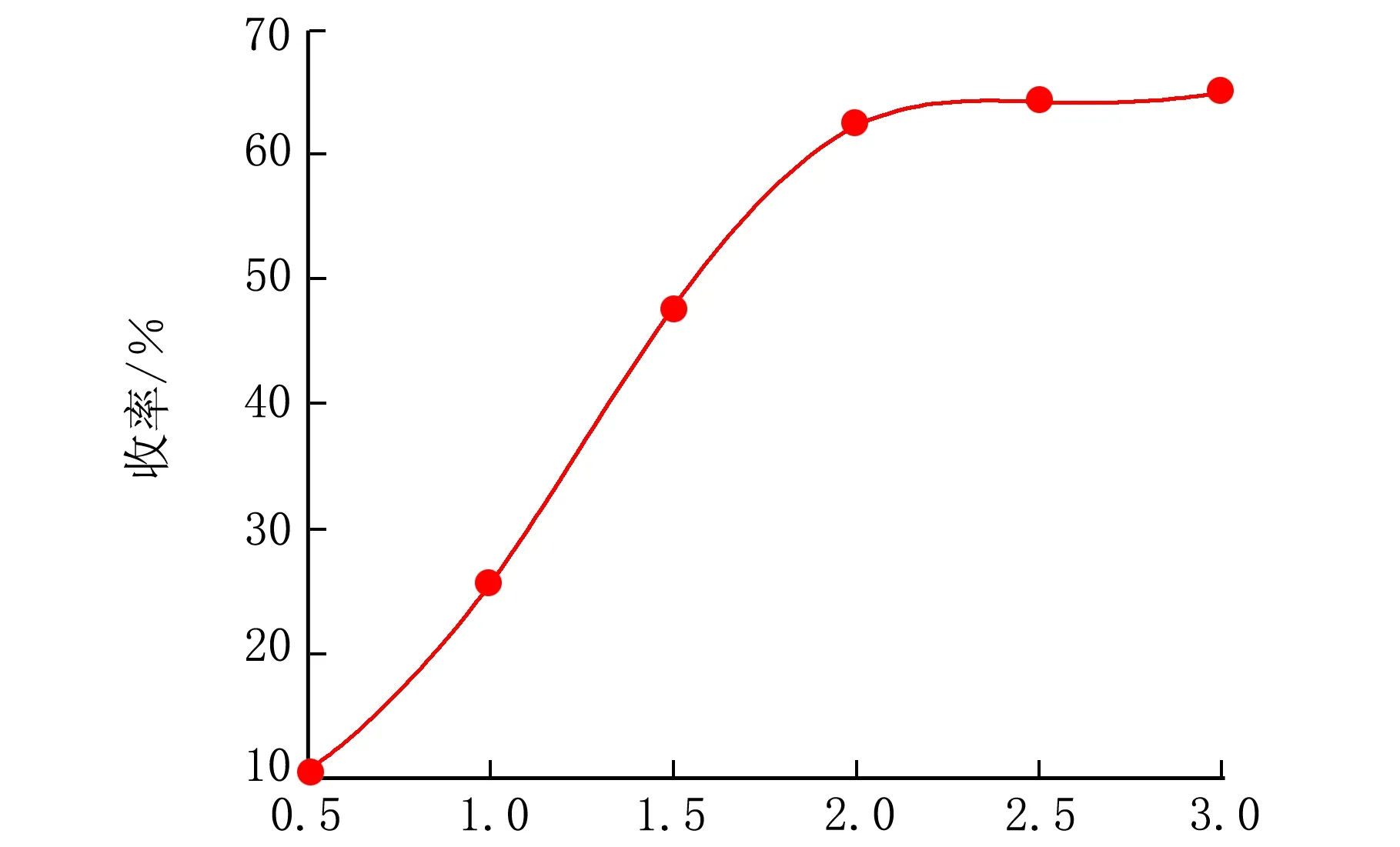
t/h图5 反应时间对产物收率的影响
由图5可见,随着反应时间的延长,产物收率也在上升,前段收率上升较快,后段上升较缓,这是由于反应产物分解或副产物生成使产物收率变小。总之,反应时间2 h较为合适。
2.2.4 不同的碱性环境对反应收率影响
对于大多数反应来说,不同的pH值对反应快慢及反应转化率有很大影响,作为催化剂,碱性试剂能降低反应活化能,使反应更容易进行。在用碱性试剂考察反应收率时,反应原料配比、反应时间和温度设定为最佳条件,即n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)=1.6,时间2 h,温度40 ℃,考察不同pH值对反应收率的影响,结果见表1。

表1 pH对产物收率的影响
由表1看见,不同的碱性环境下收率不同,pH=13~14时,反应收率最高,pH=11~12收率次之,pH=7~8收率最低。
2.2.5 正交实验结果分析
以(L)-2-氧代四氢噻唑-4-羧酸的收率为考察指标,采用L9(34)安排正交实验,选取溶液的pH值(A)、反应温度(B)、反应原料n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)(C)和反应时间(D),正交实验因素水平表见表2。

表2 正交实验因素水平表
按正交实验计划表安排实验,结果见表3。

表3 正交实验结果
从极差分析可以看出,各反应因素对产物收率影响规律是A>D>C>B,最佳反应条件是A1B2C2D2,即反应温度40 ℃,n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)=1.6,反应时间2 h,反应液pH=13~14。
按最佳反应条件进行实验,得出(L)-2-氧代四氢噻唑-4-羧酸的收率可达65%~67%。
2.3 检测
(L)-2-氧代四氢噻唑-4-羧酸的定性是用核磁共振检测,用DMSO溶解进行1H谱检测,结果见图6。

δ图6 (L)-2-氧代四氢噻唑-4-羧酸的1HNMR谱
文献值为1H NMR (400 MHz,[D6]DMSO):δ=13.22 (br s,1H),8.45 (s,1H),4.40 (ddd,J=1.3,3.4,8.6 Hz,1H),3.72 (dd,J=8.6,11.4 Hz,1H),3.46(dd,J=3.4,11.4 Hz,1H)。所做核磁图谱与文献值对应出峰时间吻合。

熔点检测为169~171 ℃,与文献值168~170 ℃接近。
3 结 论
研究了(L)-2-氧代四氢噻唑-4-羧酸的合成,得到较佳的反应条件:n(氯甲酸苯酯)∶n(L-半胱氨酸盐酸盐)=1.6,反应温度40 ℃,反应时间2 h,pH=13~14,产品收率65%~67%。
核磁检测结果与文献值接近,旋光度和熔点检测证明纯度较高。
[ 参 考 文 献 ]
[1] 李叶芝,郭纯孝,胡学山.(R)-四氢噻唑-2-硫酮-4-羧酸的合成及其晶体结构[J].高等学校化学学报,1997,18(6):898-901.
[2] 莱雅公司.新L-2-氧代噻唑烷-4-羧酸衍生物及其用于护理皮肤的用途:CN,11594447[P].1996-12-21.
[3] Masahiko Seki,Masanori Hatsuda,Yoshikazu Mori,et al.A practical synthesis of (+)-biotin fromL-cysteine[J].Chem,2004,10:6102-6110.
[4] d'Ischia M,Prota G,Rotteveel R C.A facile synthesis of 2-oxothiazolidines of biological interest[J].Synthetic Communications,1987,17:1577-1585.
[5] Falb Eliezer,Nudelman Abraham.A convenient synthesis of chiral oxazolidin-2-ones and thiazolidin-2-onesa-sand an improved preparation of triphosgene[J].Synthetic Communications,1993,23:2839-2844
[6] Adelwoehrer Christian,Yoneda Yuko.Synthesis of the perdeuterated cellulose solvents N-methylmorpholine N-oxide (NMMO-d11) and N,N-dimethylacetamide (DMAc-d9)[J].Journal of Labelled Compounds and Radiopharmaceuticals,2008,51:28-32.
