大黄游离蒽醌对糖尿病大鼠心肌纤维化的作用
2015-06-09王栋栋何素梅张冠英陈丽娟魏群利么焕开
王栋栋,何素梅,张冠英,尹 弟,黄 欣,陈丽娟,陈 肖,魏 彤,魏群利,2,么焕开,3
(徐州医学院 1. 江苏省新药研究与临床药学重点实验室,2. 临床药理学教研室,3. 中药教研室,江苏 徐州 221004)
大黄游离蒽醌对糖尿病大鼠心肌纤维化的作用
王栋栋1,何素梅1,张冠英1,尹 弟1,黄 欣1,陈丽娟1,陈 肖1,魏 彤1,魏群利1,2,么焕开1,3
(徐州医学院 1. 江苏省新药研究与临床药学重点实验室,2. 临床药理学教研室,3. 中药教研室,江苏 徐州 221004)
目的 探讨大黄游离蒽醌(free anthraquinone from rhubarb, FAR)对糖尿病大鼠心肌CTGF和collagen表达及间质纤维化的影响。方法 健康♂SD大鼠一次性腹腔注射STZ制备糖尿病大鼠模型,2周后随机分为模型对照组(DCM组)和大黄游离蒽醌干预组(FAR组),同时设立正常对照组(CON组);干预8周后检测大鼠空腹血糖;心脏质量指数;Masson染色观察心肌纤维化程度;RT-PCR法检测CTGF、procollagen Ⅰ和collagen Ⅲ mRNA表达;免疫组化法检测CTGF蛋白含量;ELISA法检测collagen Ⅰ和collagen Ⅲ胶原含量。结果 与CON组相比,DCM组大鼠空腹血糖、心脏质量指数、心肌纤维化程度以及CTGF、collagen I和collagen Ⅲ表达均明显升高;与DCM相比,FAR组心脏质量指数、心肌纤维化程度以及CTGF、collagen Ⅰ和collagen Ⅲ表达均明显下降。结论 大黄游离蒽醌可通过调低糖尿病大鼠心肌组织CTGF的表达,减少心肌间质中collagen I和Ⅲ 合成及沉积,从而改善糖尿病心肌病大鼠早期的心肌纤维化。
大黄游离蒽醌;糖尿病;心肌病;CTGF;纤维化;Ⅰ型、Ⅲ型胶原蛋白
糖尿病性心肌病(diabetic cardiomyopathy, DCM)是糖尿病的慢性并发症之一,其中心肌纤维化在糖尿病性心肌病的发生发展中起着重要的作用[1]。机体的高糖环境是糖尿病性心肌病的始动因素[2],其病理学表现为心脏成纤维细胞数量的增加,心肌间质中胶原沉积增多、各型比例失调和排列紊乱,其中主要是collagen Ⅰ和collage Ⅲ明显增多[3-4]。
大黄为蓼科多年生草本植物掌叶大黄、唐古特大黄或药用大黄的干燥根及根茎,其主要活性成分是蒽醌类衍生物。其中,游离的羟基蒽醌类化合物有大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚等。近年来研究发现,大黄游离蒽醌具有治疗糖尿病肾病的作用[5-8]。然而大黄游离蒽醌对糖尿病大鼠心肌间质纤维化的影响鲜见报道,本实验通过链脲佐菌素(STZ)诱导的糖尿病大鼠模型,观察大黄游离蒽醌对DCM心肌间质纤维化的影响,并探讨其减轻DCM心肌间质纤维化的机制。
1 材料与方法
1.1 实验动物健康SD大鼠30只,♂,体质量(250±20) g,SPF级,购自徐州医学院实验动物中心,使用许可证号:SYXK(苏)2010-0011。
1.2 药品与仪器链脲佐菌素(streptozotocin,STZ,Sigma公司,批号:wxbb2432v);大黄游离蒽醌(南京泽朗医药科技有限公司,批号:ZL20140522DH);超敏兔两步法检测试剂盒(北京中杉金桥,批号:K142716D);DAB显色试剂盒(北京中杉金桥,批号:K146909E);兔抗CTGF 多克隆抗体(武汉博士德生物工程有限公司,批号:941246);大鼠I型胶原酶联免疫分析试剂盒(美国R & B公司,批号:201409);大鼠Ⅲ型胶原酶联免疫分析试剂盒(美国R & B公司,批号:201408);Masson三色染色液(上海源叶生物科技有限公司);CTGF、procollagen I、collagen Ⅲ及β-actin引物(生工生物工程(上海)股份有限公司)。One Touch 血糖仪(美国强生医疗器材有限公司);BX43F型正置荧光显微镜(日本Olympus公司);GL2200Pro型凝胶成像系统(美国Carestream公司)。
1.3 分组与给药♂SD大鼠30只,随机分为正常对照组(CON组,8只)和造模组(22只),造模组腹腔注射60 mg·kg-1STZ,正常对照组注射等体积的枸橼酸缓冲液。注射后72 h尾静脉测定空腹血糖,血糖 ≥ 16.7 mmol·L-1且稳定2周者为造模成功,共16只。将成模大鼠随机分为糖尿病心肌病模型组(DCM组,8只)及大黄游离蒽醌组(FAR组,8只)。每日上午9 ∶00时灌胃给药1次,大黄游离蒽醌于质量分数为1%的羧甲基纤维素钠中配成混悬液,给药剂量为50 mg·kg-1,正常对照组和糖尿病心肌病模型组给予等体积的羧甲基纤维素钠灌胃,连续给药8周。
1.4 观察指标
1.4.1 血糖测定 干预8周后,禁食不禁水8 h,经尾静脉测空腹血糖。
1.4.2 心脏质量指数的测定 处死大鼠前称量大鼠的体重;乙醚麻醉大鼠,迅速取出心脏,冰盐水冲洗,滤纸吸干,称量心脏质量,计算心脏质量指数(心脏质量/体质量,mg/g)。
1.4.3 心肌组织Masson染色 取左心室心肌组织,用4%多聚甲醛固定,常规石蜡包埋,制作切片,连续切片(厚4 μm),每5张取1张,每个标本取3张切片。脱蜡后行Masson染色,光镜下观察心肌细胞呈红色,胶原纤维呈蓝绿色,每张切片在400倍光学显微镜下观察并随机选取4个视野拍照,用Image-Pro Plus 5.0 图像处理系统测量胶原纤维阳性区占所观察视野的面积比。
1.4.4 RT-PCR法检测心肌组织中CTGF、procollagen Ⅰ和collagen Ⅲ mRNA表达 于-80 ℃ 冰箱取出心肌组织,按TRIzol试剂说明书方法提取心肌组织总RNA。取1 μg进行RT-PCR反应。所用 RT-PCR扩增引物见Tab 1(β-actin为内参照)。每个前胶原蛋白分子的N端和C端分别含有1个前肽,成熟时前胶原蛋白分子经胞吐作用被分泌至细胞外,受前胶原肽酶的作用,去除N端和C端的前肽,形成胶原。因此,collagen I的表达水平可以用心肌组织Ⅰ型前胶原蛋白(procollagen Ⅰ)水平表示。CTGF及β-actin变性、退火和延伸温度分别为94 ℃、60 ℃、72 ℃,反应时间分别为30、30、60 s;procollagen Ⅰ及collagen Ⅲ变性、退火和延伸温度分别为94 ℃、55 ℃、72 ℃,反应时间分别为30、30、60(30 s),共40个循环。循环完毕再72 ℃延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳分析,用GL2200Pro型凝胶成像系统对每一标本的PCR产物扩增的特异性片段进行灰度扫描,用CTGF、procollagen Ⅰ及collagen Ⅲ的灰度值与β-actin的比值表示目的基因CTGF、procollagen Ⅰ及collagen Ⅲ的相对表达量。

Tab 1 Primer sequences for RT-PCR
1.4.5 免疫组化法检测心肌组织CTGF蛋白的含量 取左心室常规石蜡包块制作切片,连续切片(厚4 μm),每5张取1张,每个标本取3张切片。采用免疫组织化学法检测心肌组织中CTGF含量,具体操作按照试剂盒说明书进行。抗体按1 ∶100 的方法稀释,以 PBS 替代一抗作为阴性对照,将切片置于200倍光学显微镜下观察并随机选取4个视野拍照,阳性区出现棕黄色颗粒,用Image-Pro Plus 5.0 图像处理系统测量CTGF的平均积分吸光度。
1.4.6 ELISA法检测心肌组织collagen Ⅰ和collagen Ⅲ胶原含量 采用ELISA法检测心肌组织中CTGF含量,具体操作按照试剂盒说明书进行。

2 结果
2.1 大鼠空腹血糖和心脏质量指数与CON组相比,DCM组大鼠心脏质量指数升高(P<0.01)。与DCM组相比,FAR组心脏质量指数下降(P<0.01)。表明糖尿病大鼠已出现心肌肥厚,大黄游离蒽醌可减轻糖尿病所致心肌肥厚(Tab 2)。
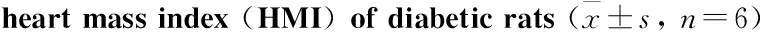

GroupBloodglucose/mmol·L-1HMI/mg·g-1CON4.46±0.423.50±0.32DCM24.03±4.67**4.12±0.29**FAR22.65±5.813.63±0.14##
**P<0.01vsCON group;##P<0.01vsDCM group
2.2 心肌组织Masson染色各组心肌组织Masson染色,见Fig 1。CON组大鼠左心室心肌间血管和心肌间质可见少许胶原纤维沉积。DCM大鼠的胶原纤维沉积更加明显。FAR组胶原沉积有所减轻。用Image-Pro Plus 5.0 图像处理系统测量胶原纤维阳性区占所观察视野的面积比。结果发现:与CON组相比,DCM组大鼠心肌间质胶原纤维明显增多(P<0.01);与DCM比,FAR组大鼠心肌间质胶原纤维明显减少(P<0.05)。

Fig 1 Effects of FAR on myocardial fibrosis in
**P<0.01vsCON group;#P<0.05vsDCM group.
2.3 心肌组织RT-PCR结果与CON组相比,DCM组大鼠心肌组织CTGF、procollagen I和collagen Ⅲ mRNA表达均明显升高(P<0.05);与DCM相比较,FAR组大鼠心肌组织CTGF、procollagen I和collagen Ⅲ mRNA表达均明显降低(P<0.05),说明FAR有抑制CTGF、procollagen Ⅰ和collagen Ⅲ mRNA表达的作用,见Fig 2。

Fig 2 Effects of FAR on expressions of CTGF, procollagen Ⅰ and collagen Ⅲ mRNA in myocardial tissues of diabetic ±s,n=6)
*P<0.05vsCON group;#P<0.05vsDCM group.
2.4 免疫组化法检测心肌组织CTGF蛋白的含量CON组大鼠左心室心肌组织CTGF低表达,阳性颗粒散在,染色较浅;DCM组高表达,棕黄色信号强,融合成片,而FAR组表达明显降低,见Fig 3。用Image-Pro Plus 5.0 图像处理系统分别测量每张切片CTGF的平均积分吸光度,结果如下:与CON组相比,CTGF的表达在DCM组中明显升高(P<0.05);与DCM组相比,FAR组的CTGF表达明显降低(P<0.05)。
2.5 ELISA法检测心肌组织collagen Ⅰ和collagen Ⅲ胶原含量与CON组相比,DCM组的collagen Ⅰ及collagen Ⅲ的含量增加(P<0.01);与DCM组相比,FAR组的collagen Ⅰ及collagen Ⅲ的含量有所下降,见Fig 4。
3 讨论
糖尿病性心肌病是糖尿病常见的并发症之一,以舒张功能不全为早期临床表现,晚期以收缩功能障碍为主[9-10],最终可导致心力衰竭。有研究表明,左心室舒张功能降低、泵血功能异常与其心肌间质纤维化有关[4,11]。正常心肌细胞外基质中的胶原主要为I型及Ⅲ型,I型约占心肌胶原总数的80%,纤维粗,有较大的僵硬度和很强的抗牵拉特性而用于保持室壁的强度;Ⅲ型胶原约占11%,纤维较细,伸展性和弹性大,与室壁弹性有关。异常增多且比例失调的胶原纤维使心室壁的顺应性下降,僵硬度增加,舒张期充盈受限;如果心肌纤维化进一步加重,势必损害心肌的收缩功能[12]。

Fig 3 Effects of FAR on expression of CTGF protein in myocardial tissues of diabetic ±s,n=6)
*P<0.05vsCON group;#P<0.05vsDCM group.

Fig 4 Effects of FAR on depositions of collagen type I and collagen type Ⅲ in myocardial tissues of diabetic ±s,n=6)
**P<0.01vsCON group;#P<0.05,##P<0.01vsDCM group.
CTGF是一类能够调节机体有关组织生长的细胞因子。CTGF基因属即刻早期基因,启动子含转化生长因子TGF-β应答元件,可被TGF-β选择性诱导激活,它通过促进细胞增殖,直接诱导胶原生成,促进细胞黏附等自身的生物学效应参与纤维化的发生与发展,因此CTGF是检测体内纤维化的有效指标[13-16]。
我们研究证实糖尿病大鼠心肌纤维化同时伴随CTGF的高表达,与Way等[17]和Hagendomm等[18]研究一致。在本实验中,Masson 染色示糖尿病大鼠心肌间质纤维增生,心肌组织中procollagen Ⅰ和collagen Ⅲ mRNA表达明显增强,Ⅰ/Ⅲ型胶原纤维的含量亦明显升高,提示糖尿病大鼠已存在心肌纤维化。大黄游离蒽醌干预8周后,糖尿病大鼠心肌纤维化程度有所改善,心肌CTGF、Ⅰ/Ⅲ型胶原纤维的表达亦明显减少,提示大黄游离蒽醌的抗心肌纤维化可能与抑制CTGF的表达进而减少Ⅰ/Ⅲ型胶原纤维的合成有关。
综上所述,糖尿病心肌纤维化与心肌CTGF过度表达有关,FAR可通过下调糖尿病大鼠心肌组织CTGF的表达,减少心肌间质中collagen Ⅰ和Ⅲ 合成及沉积,从而改善糖尿病心肌病大鼠早期的心肌纤维化。
[1] 乔 进, 窦志华, 吴 锋, 等. 灵芝多糖联合二甲双胍对2型糖尿病大鼠心肌AGEs及CTGF的影响及其机制[J]. 中国药理学通报, 2014, 30(4): 536-41.
[1] Qiao J, Dou Z H, Wu F, et al. Effect of combination of ganoderma lucidum polysaccharide and metformin on AGEs and CTGF of cardiac muscle in type 2 diabetic rats and the mechanism[J].ChinPharmacolBull, 2014, 30(4): 536-41.
[2] 周庆峰, 王洪新, 王桂君, 等. 高糖对去甲肾上腺素诱导的心肌细胞肥大的促进作用 [J]. 中国药理学通报, 2003, 19(9):1054-7.
[2] Zhou Q F, Wang H X, Wang G J, et al. Accelerating effects of high glucose on NE-induced cardiac hypertrophy of the cultured myocardial cells [J].ChinPharmacolBull, 2003, 19(9): 1054-7.
[3] 王 婧, 符丽娟, 闫 睿. 曲尼司特对糖尿病大鼠心肌纤维化的作用 [J]. 中国药理学通报, 2013,29(6): 837-41.
[3] Wang J, Fu L J, Yan R. Effects of tranilast on myocardial fibrosis of diabetic rats [J].ChinPharmacolBull, 2013,29(6): 837-41.
[4] Maya L, Villarreal F J. Diagnostic approaches for diabetic cardiomyopathy and myocardial fibrosis [J].JMolCellCardiol, 2010, 48(3): 524-9.
[5] Zheng J M, Zhu J M,Li L S, et al. Rhein reverses the diabetic phenotype of mesangial cells over-expressing the glucose transporter (GLUT1) by inhibiting the hexosamine pathway [J].BrJPharmacol, 2008, 153(7): 1456-64.
[6] Li X, Liu W,Wang Q,et al. Emodin suppresses cell proliferation and fibronectin expression via p38MAPK pathway in rat mesangial cells cultured under high glucose [J].MolCellEndocrinol,2009, 307(1-2): 157-62.
[7] Gao J,Wang F,Wang W,et al. Emodin suppresses hyperglycemia-induced proliferation and fibronectin expression in mesangial cells via inhibiting cFLIP [J].PLoSOne, 2014, 9(4): e93588.
[8] Gao Q,Qin W S,Jia Z H,et al. Rhein improves renal lesion and ameliorates dyslipidemia in db/db mice with diabetic nephropathy [J].PlantaMed,2010, 76(1): 27-33.
[9] Schannwell C M, Schneppenhei M, Perimgs S, et al. Left ventricular diastolic dysfunction as an early manifestation of diabetic cardiomyopathy [J].Cardiology, 2002, 98(1-2): 33-9.
[10] Sajad A H, billal P, Rajdeep S, et al. Diabetic cardiomyopathy: mechanisms, diagnosis and treatment [J].ClinSci, 2004, 107: 539-57.
[11] de Souza R R. Aging of myocardial collagen [J].Biogerontology, 2002, 3(6): 325-35.
[12] 高淑卿, 朱鹏立. 心肌纤维化的研究进展 [J]. 医学综述, 2009, 15(11): 1627-9.
[12] Gao S Q, Zhu P L. Research advance of myocardial fibrosis [J].MedRecap, 2009, 15(11): 1627-9.
[13] Kothapalli D, Grotendorst G R. CTGF modulates cell cycle progression in cAMP-arrested NRK fibroblasts [J].JCellPhysiol, 2000, 182(1):119-26.
[14] Gore-Hyer E, Shegogue D, Markiewicz M, et al. TGF-β and CTGF have overlapping and distinct fibrogenic effects on human renal cells [J].AmJPhysiolRenalPhysiol, 2002, 283(4): 707-16.
[15] Dendooven A, Gerritsen K G, Nguyen T Q, et al. Connective tissue growth factor (CTGF/CCN2) ELISA: a novel tool for monitoring fibrosis [J].Biomarkers, 2011, 16(4): 289-301.
[16] Khankan R, Oliver N, He S, et al. Regulation of fibronectin-EDA through CTGF domain-specific interactions with TGFβ2 and its receptor TGFβRII [J].InvestOphthalmolVisSci, 2011, 52(8): 5068-78.
[17] Way K J, Isshiki K, Suzuma K, et al. Expression of connective tissue growth factor is increased in injured myocardium associated with protein kinase C beta2 activation and diabetes [J].Diabetes, 2002, 51(9): 2709-18.
[18] Hagendomm J, Padera T P, Yock T I, et al. Plateler-derived growth factor receptor-beta in Gorham s disease [J].MatClinPractOncol, 2006, 3(12): 693-7.
Effects of FAR on myocardial fibrosis of diabetic rats
WANG Dong-dong1, HE Su-mei1, ZHANG Guan-ying1, YIN Di1, HUANG Xin1, CHEN Li-juan1,CHEN Xiao1, WEI Tong1, WEI Qun-li1,2, YAO Huan-kai1,3
(1.JiangsuKeyLaboratoryofNewDrugResearchandClinicalPharmacy,XuzhouMedicalCollege,XuzhouJiangsu221004,China;2.DeptofClinicalPharmacology,XuzhouMedicalCollege,XuzhouJiangsu221004,China; 3.DeptofTraditionalChineseMedicine,XuzhouMedicalCollege,XuzhouJiangsu221004,China)
Aim To study the effects of Free Anthraquinone from Rhubarb (FAR) on myocardial CTGF and collagen expression and interstitial fibrosis in diabetic rats. Methods The male SD rats were randomly divided into normal group (CON), diabetic cardiomyopathy group (DCM) and FAR treatment group (FAR). Streptozocin was intraperitoneally injected into the animals in the latter 2 groups to induce diabetic rat model. The model was expected to be stable for 2 weeks before the treatment. At the end of the 8th week in treatment, fasting plasma glucose and heart mass index were measured. Masson staining was used to observe the myocardial fibrosis. RT-PCR was used to detect the mRNA levels of CTGF, procollagen type Ⅰ and collagen type Ⅲ. Immunohistochemical method was used to detect the content of CTGF. ELISA was used to detect the depositions of collagen type I and collagen type Ⅲ. Results Compared with CON group, fasting plasma glucose, heart mass index, the degree of myocardial fibrosis, and the expressions of CTGF, collagen type I and collagen type Ⅲ in left ventricular myocardial tissue of DCM group were significantly increased. However, compared with DCM group, fasting plasma glucose, heart mass index, the degree of myocardial fibrosis, and the expressions of CTGF, collagen type I and collagen type Ⅲ in left ventricular myocardial tissue of FAR-treated rats were significantly decreased. Conclusion FAR retards the process of myocardial fibrosis in diabetic rats by down-regulating the expression of CTGF, reducing the synthesis and depositions of collagen type I and collagen type Ⅲ.
Free Anthraquinone from Rhubarb; diabetes; cardiomyopathy; CTGF; fibrosis; collagen Ⅰ, Ⅲ
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.022.html
2014-11-14,
2015-02-22
国家自然科学基金资助项目(No 81302744); 江苏省研究生创新计划(No CXLX13_999); 江苏省大学生创新计划(No 201410313024Z); 徐州医学院药学院研究生创新计划(No 2014YKYCX013)
王栋栋 (1990-),男,硕士生,研究方向: 内分泌药理学及临床药学,E-mail:1084214752@qq.com; 魏群利(1962-),男,博士,教授,主任医师,硕士生导师,研究方向:内分泌药理学及临床药学,通讯作者,Tel:0516-83262134,E-mail:weiqunli@126.com; 么焕开(1979-),男,博士,副教授,研究方向:活性天然产物化学与生物学,通讯作者,Tel:0516-83262140,E-mail:hkyao@xzmc.edu.cn
10.3969/j.issn.1001-1978.2015.04.014
A
1001-1978(2015)04-0509-05
R-332;R284.1;R322.11;R587.2;R542.2
