氧化苦参碱对高糖毒性下血管内皮细胞的保护作用
2015-06-09黄莉萍梁尚栋
易 云,吴 琴,黄莉萍,梁尚栋,高 云
(1.南昌大学第二附属医院, 2.南昌大学基础医学院生理教研室,江西 南昌 330006)
氧化苦参碱对高糖毒性下血管内皮细胞的保护作用
易 云1,2,吴 琴2,黄莉萍2,梁尚栋2,高 云2
(1.南昌大学第二附属医院, 2.南昌大学基础医学院生理教研室,江西 南昌 330006)
目的 研究氧化苦参碱对A2B受体介导高糖毒性下人脐带静脉血管内皮细胞(HUVEC)保护作用。方法 采用传代细胞系培养方法培养人脐静脉血管内皮细胞,细胞分组如下: 5.5 mmol·L-1对照糖组(Control),22.2 mmol·L-1高糖组 (22.2 mmol·L-1), 44.4 mmol·L-1高糖组 (44.4 mmol·L-1);对照糖 + 氧化苦参碱组(control+ OMT), 22.2 mmol·L-1高糖+ 氧化苦参碱组 (22.2 mmol·L-1+ OMT), 44.4 mmol·L-1高糖+ 氧化苦参碱组 (44.4 mmol·L-1+ OMT)。采用MTS法观察高糖和氧化苦参碱保护效应;结合蛋白印迹、 RT-PCR等方法观察HUVEC中A2B受体的表达变化。结果 高糖培养可引起HUVEC受损和活性下降。氧化苦参碱(OMT)可明显减少高糖性HUVEC损伤和活性下降,并对A2B的表达有明显抑制作用。结论 氧化苦参碱对高糖条件下的HUVEC有保护作用,此作用可能通过抑制A2B的表达而实现。
氧化苦参碱;HUVEC;高糖;细胞毒性;A2B受体;糖尿病
内皮细胞功能紊乱已经成为2型糖尿病及其血管并发症发生发展的重要使动和关键因素,而2型糖尿病长期存在的糖毒性、脂毒性和高血压又进一步加重内皮细胞功能紊乱[1-2]。腺苷 (adenosine)是人体内的一种重要的生物活性物质,它是腺嘌呤核苷酸的前体和代谢产物,在全身各处组织都可以产生,其中血管内皮组织是产生腺苷较多的组织。腺苷通过4种膜受体A1、A2A、A2B和A3来调节许多生理过程。生理状态下,基础水平的腺苷主要激活 A2A受体,当腺苷水平上升并超过生理水平或达到病理水平时 A2B才被激活。A2B受体与腺苷及其类似物结合后,通过跨膜信号传递途径激活腺苷酸环化酶,使环磷酸腺苷(cAMP)形成增加,进而扩张血管平滑肌和抑制中性粒细胞的毒性作用,激活肥大细胞等炎症细胞释放细胞因子及炎症介质[3]。有研究发现,A2B受体在血管内皮细胞有表达,并可能对内皮细胞功能有着调节作用。目前对腺苷A2B受体与糖尿病血管内皮功能紊乱的研究非常少。
氧化苦参碱(oxymatrine, OMT) 是从豆科槐属植物苦参(sophora flavescens Ait.) 等中提取的生物碱,具有四环的喹嗪啶类结构。氧化苦参碱具有抗炎、抗肿瘤、抗病毒、抗心律失常等作用。可产生抗炎和扩血管作用[4-6],提示其可能对高糖、高脂引起的血管内皮损伤可能产生保护作用。
本实验以D-Glucose合并无糖培养基建立高糖模型,研究在高糖条件下,氧化苦参碱对人脐静脉血管内皮细胞(HUVECS)的细胞毒性和保护作用及其作用机制,以进一步阐述氧化苦参碱对A2B受体在高糖条件介导的保护作用机制,为由血管内皮功能紊乱引起的各种糖尿病并发症的防治探寻新靶点,也为氧化苦参碱用于糖尿病及其并发症的预防和治疗提供新的实验依据和理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞 人脐带静脉血管内皮细胞(HUVECS),购自江苏南京,实验采用第3~9代。
1.1.2 氧化苦参碱 氧化苦参碱购自中国药品生物制品检定所。
1.1.3 试剂 RPMI 1640培养基(批号:11875,Gibco,美国);胎牛血清(批号:12483020,Invitrogen,英国);0.25%胰酶(批号:T1300-100,Solarbio,中国);cell Titer96(批号:G3582,Promega,美国);二甲基亚砜(DMSO) (批号:0231,Amresco,中国);总RNA提取试剂盒(批号:DP419,TIANGEN,中国);RT试剂盒(批号:AT301,TransGEN,中国);荧光定量试剂盒(批号:RR820A,TaKaRa,日本);其他试剂均为国产分析纯,水为自制超纯水。
1.2 方法
1.2.1 细胞培养 HUVECS细胞培养于RPMI 1640培养液中,其中含10%胎牛血清,青霉素100 kU·L-1,链霉素100 mg·L-1,37℃,5% CO2培养箱中培养。
1.2.2 实验设计及分组 将HUVECS细胞分成6个组,5.5 mmol·L-1对照糖组(Control),22.2 mmol·L-1高糖组 (22.2 mmol·L-1), 44.4 mmol·L-1高糖组 ( 44.4 mmol·L-1);对照糖 + 氧化苦参碱组(control+ OMT), 22.2 mmol·L-1高糖+ 氧化苦参碱组 (22.2 mmol·L-1+ OMT), 44.4 mmol·L-1高糖+ 氧化苦参碱组 (44.4 mmol·L-1+ OMT)。
1.2.3 MTS法检测氧化苦参碱对HUVECS细胞活性的影响 水浴37℃解冻MTS试剂,96孔板中每孔加入20 μl的MTS试剂,37℃,5% CO2孵育1~4 h,如为了延长检测时间,每孔加入25 μl 10%SDS来终止反应,等到后续检测,多功能酶标仪选取490 nm波长进行检测。
1.2.4 实时荧光定量核酸扩增(qPCR) 按说明书完成总RNA的提取和cDNA的合成。本实验选用GAPDH作为内参,引物序列如下:
Primer A2B产物长度为83bp
F 5′-ACCGAGACTTCCGCTACACTT-3′
R 5′-CTGACCATTCCCACTCTTGAC-3′
Primer GAPDH 产物长度为138bp
F 5′-CAGGAGGCATTGCGTATGAT-3′
R 5′-GAAGGCTGGGGCTCATTT-3′
A2B和GAPDH扩增体系分别如下:GoTaq@qPCR Master Mix,2× 10 μL,上游引物(10 μmol·L-1) 0.4 μL,上游引物(10 μmol·L-1) 0.4 μL,cDNA 2 μL,ROX 0.2 μL,无RNase水 7 μL。PCR反应条件:95℃×2 min;95℃×15 s,60℃×60 s,共40个循环;72℃×5 min。将PCR反应板放入ABI7500系统,设置好运行程序,运行完后保存结果分析。
1.2.5 Western blot 将6孔板从培养箱取出,放到冰上静置,移除培养基,用灭菌的PBS清洗两遍( 去除酚红),每孔加1 mL 细胞裂解液(含10%PMSF),在冰上充分裂解30 min后,转移至1.5 mL离心管,以12 000 r·min-1于4℃离心15 min,按比例加入5×loading buffer和DTT,混匀后煮沸5 min,使蛋白变性,取上清,分装于0.5 mL离心管中,并置于-20℃保存。SDS-PAGE电泳,转膜。一抗(1 ∶1 000)4℃孵育过夜,TBST清洗3次,二抗(1 ∶2 000)室温震荡孵育,TBST清洗3次。膜加ECL发光剂反应,X光胶片显影定影后光密度分析。通过Image-J图像分析软件读取目的条带在X光胶片上测得的光密度扫描值,以各组β-actin条带的扫描值标化其相应组A2B的蛋白表达量。
2 结果
2.1 MTS检测HUVECs细胞活性确定OMT浓度从加OMT后培养d 3检测HUVECs细胞活性发现,10和30 μmol·L-1组与Control组、1和3 μmol·L-1组相比细胞活性明显降低,且差异有显著性 (P<0.01,见Fig 1)。结果表明,1和3 μmol·L-1组对细胞活性影响不大,根据参考文献,我们选定OMT细胞干预浓度为3 μmol·L-1。
2.2 MTS测定高糖对HUVECs细胞毒性和OMT对其的保护作用从加高糖后培养d 3 MTS检测高糖对细胞毒性以及OMT后发现, 22.2和44.4 mmol·L-1组与Control组相比细胞活性明显降低,且差异有显著性 (P<0.01),但是Control组、Control+OMT组、22.2和44.4 mmol·L-1+OMT组三者之间相比差异无显著性 (P>0.05,见Fig 2)

Fig 1 Viability of HUVECs in different oxymatrine
The HUVECs in 1,3,10 μmol·L-1and 30 μmol·L-1groups were given different concentrations of OMT for 3 days from d1 after seeding the cells in 6 cells plate,**P<0.01vscontrol group.

Fig 2 Effect of oxymatrine on viability of HUVECs
The HUVECs were given different concentrations of glucose or 3 μmol·L-1OMT for 3 days from d1 after seeding the cells in 6 cells plate.**P<0.01vscontrol group.
2.3 qPCR检测A2B受体情况A2BqPCR结果表明:22.2、44.4 mmol·L-1组中A2B受体mRNA表达水平较Control组明显增加(P<0.01);22.2 mmol·L-1+OMT组A2B受体mRNA表达水平较22.2 mmol·L-1组明显降低(P<0.01);44.4 mmol·L-1+OMT组A2B受mRNA表达水平较44.4 mmol·L-1组明显降低(P<0.05,见Fig 3)。
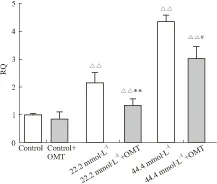
Fig 3 Effect of oxymatrine on expression of A2B receptor in human umbilical vein endothelial cells (HUVECs) cultivated
A2Bexpression in mRNA level was detected by qPCR.△△P<0.01, 22.2 and 44.4 mmol·L-1vscontrol group;**P<0.01vs22.2 mmol·L-1group;#P<0.05vs44.4 mmol·L-1group.
2.4 Western blot应用ImageJ系统软件分析A2B受体蛋白印迹结果如下:22.2、44.4 mmol·L-1组中A2B受体蛋白表达水平较Control组明显增加(P<0.01); 22.2 mmol·L-1+OMT组A2B受体蛋白表达水平较22.2 mmol·L-1组明显降低(P<0.05);44.4 mmol·L-1+OMT组A2B受体蛋白表达水平较44.4 mmol·L-1组明显降低(P<0.05,见Fig 4)。
3 讨论
2型糖尿病(diabetes mellitus,DM)是胰岛素分泌绝对或相对不足,并以高血糖、高血脂为特征的代谢紊乱综合征,其中大血管病变直接影响糖尿病患者的预后与生存[7-8]。在糖尿病心血管并发症中,血管内皮细胞起着关键的作用。血管内皮细胞可通过分泌一系列生物活性物质,如前列环素、血管内皮舒张因子、内皮素及血管性假血友病因子等,参与炎症及免疫反应,也参与肿瘤转移、血栓形成、血管壁病变等病理过程[9-10]。高血糖环境下,血管内皮细胞发生病变,其分泌活性随之改变[11]。
腺苷 (adenosine)是人体内的一种重要的生物活性物质,对细胞的功能起到重要调节作用[12-13]。其受体被分为4个亚型:A1、A2A、A2B和A3,其中的A2B受体被发现在血管内皮细胞有表达,并可能参与调节血管内皮细胞促炎症反应[14-16]。Figler等[14]研究表明,糖尿病状态下血管内皮细胞A2B受体表达出现增强,导致炎症因子IL-6分泌增多。A2B受体发挥促炎作用已被证明存在于小鼠肺部炎症模型以及受哮喘或慢性阻塞性肺病患者[18-20]。A2B受体可促进慢性肺部疾病病理过程的多种促炎介质(如IL-4、IL-6、IL-8、IL-13、IL-19和单核细胞趋化蛋白1)的表达和释放[21-22]。以上研究都表明A2B受体可能对血管内皮细胞功能具有重要调节作用[23-24]。我们实验室的实验显示,高糖引起人脐静脉内皮细胞(HUVECs)A2B受体表达明显增高,此结果和Figler等结果相一致。

Fig 4 Effect of oxymatrine on expression of A2B receptor in HUVECs cultivated in glucose ±s,n=6)
A2Bexpression in protein level was detected by Western blot. The stain values (integrated optical density) of A2Bprotein expression (normalized to each β-actin internal control) were determined by image analysis.△△P<0.01, 22.2 mmol·L-1and 44.4 mmol·L-1vscontrol group;*P<0.05vs22.2 mmol·L-1group;#P<0.05vs44.4 mmol·L-1group.
血管内皮功能紊乱是糖尿病血管并发症发生的基础[25]。对于糖尿病患者治疗的最终目的是预防和延缓糖尿病各种慢性并发症,而改善内皮细胞功能,已成为治疗糖尿病患者的目标之一。氧化苦参碱(oxymatrine, OMT) 是从豆科槐属植物苦参(Sop hora flavescens ait.) 等中提取的生物碱,具有四环的喹嗪啶类结构。氧化苦参碱具有抗炎、抗肿瘤、抗病毒、抗心律失常等作用[26-27],可产生抗炎和扩血管作用[28-29],提示其可能对高糖、高脂引起的血管内皮损伤产生保护作用。本实验显示,高糖培养3 d能引起人脐静脉内皮细胞(HUVECs)的活性下降,用氧化苦参碱(3 μmol·L-1)干预后能明显改善,实验表明人脐静脉血管内皮细胞(HUVECs)在高糖毒性下腺苷A2B受体表达与正常对照组比较存在明显差异,提示腺苷A2B受体与糖尿病血管内皮功能病变有关。用氧化苦参碱干预发现干预组腺苷A2B受体表达与高糖组比较存在明显差异,qPCR和蛋白印迹结果显示:随着高糖浓度的增高,A2B受体表达水平明显增强,氧化苦参碱干预后,A2B受体表达下降,细胞活性明显要比高糖处理的细胞活性要好,提示氧化苦参碱对腺苷A2B受体在高糖条件介导的人血管内皮细胞具有一定的保护作用。
本实验通过细胞及分子水平相结合的研究,观察到氧化苦参碱对在高糖条件下人血管内皮细胞有保护作用,可能通过抑制A2B受体表达的升高产生保护作用。相信通过深入了解氧化苦参碱对A2B受体在高糖条件介导的保护作用机制,能够为因血管内皮功能紊乱引起的各种糖尿病并发症的防治探寻新靶点,为氧化苦参碱用于糖尿病及其并发症的预防和治疗提供新的实验依据和理论基础。
[1] Canivell S, Gomis R. Diagnosis and classification of autoimmune diabetes mellitus[J].AutoimmunRev, 2014, 13(4-5): 403-7.
[2] American Diabetes Association. Diagnosis and classification of diabetes mellitus[J].DiabetesCare, 2013, 36(Suppl 1): S67-74.
[3] Jolly S E, Noonan C J, Roubideaux Y D, et al. Albuminuria among Alaska Natives--findings from the Genetics of Coronary Artery Disease in Alaska Natives (GOCADAN) study[J].NephronClinPract, 2010,115(2): p. c107-13.
[4] 黄彩云, 黄胜英,谢世荣,等.氧化苦参碱抗心律失常作用的实验研究[J].大连医科大学学报,2001,23(4):262-263,269
[4] Hang C Y, Huang S Y, Xie S R, et al. Experimental study oantiarrhythmic effects of oxymatrine[J].JDalianMedUn,2001,23(4):262-263,269.
[5] 孙宏丽, 徐超千,李 哲,等.氧化苦参碱对豚鼠单个心室肌细胞胞浆[Ca2+]i的影响[J]. 中国药学杂志,2004, 39(4):264-6.
[5] Sun H L, Xu C Q,Li Z, et al. Effect of oxymatrineon[Ca2+]iinsingle ventricular myocyte of guineapigs[J].ChinPharmacolJ,2004,39(4):264-6.
[6] 程 钢,秦媛媛,程 迪,等.氧化苦参碱对大鼠局灶性脑缺血损伤的保护作用及其抑制凋亡的作用机制[J]. 中国药理学通报,2013,29(3):387-92.
[6] Cheng G,Qin Y Y,Cheng D,et al.Protection of oxymatrine on focal crerebral ischemic injury in rats and its mechanism of inhibition of opoptosis[J].ChinPharmacolBull,2013,29(3):387-92.
[7] Liu S.Prevalence of diabetes and impaired fasting glucose in Chinese adults, China National Nutrition and Health Survey, 2002[J].PrevChronicDis, 2011, 8(1): A13.
[8] Consoli C, Martelli E, D'Adamo M, et al. Insulin resistance affects gene expression in endothelium[J].ArteriosclerThrombVascBiol, 2008,28(2): e7-9.
[9] Tan K C, Chow W S, Tam S C, et al. Atorvastatin lowers C-reactive protein and improves endothelium-dependent vasodilation in type 2 diabetes mellitus[J].JClinEndocrinolMetab, 2002,87(2):563-8.
[10] Tan K C, Wat N M, Tam S C, et al. C-reactive protein predicts the deterioration of glycemia in chinese subjects with impaired glucose tolerance[J].DiabetesCare, 2003,26(8):2323-8.
[11] Stehouwer C D, Gall M A, Twisk J W, et al., Increased urinary albumin excretion, endothelial dysfunction, and chronic low-grade inflammation in type 2 diabetes: progressive, interrelated, and independently associated with risk of death[J].Diabetes, 2002,51(4):1157-65.
[12] Bibli S I, Iliodromitis E K, Lambertucci C, et al. Pharmacological postconditioning of the rabbit heart with non-selective, A, A2Aand A3adenosine receptor agonists[J].JPharmPharmacol, 2014.
[13] Mehta A A, Gupta A S, Ahmed S, et al. Diagnostic utility of adenosine deaminase in exudative pleural effusions[J].LungIndia, 2014,31(2):142-4.
[14] Trincavelli M L, Giacomelli C, Daniele S, et al. Allosteric modulators of human A2B adenosine receptor[J].BiochimBiophysActa, 2014,1840(3):1194-203.
[15] Eltzschig H K, Bonney S K,Eckle T. Attenuating myocardial ischemia by targeting A2Badenosine receptors[J].TrendsMolMed, 2013, 19(6): 345-54.
[16] Nishida K, Dohi Y, Yamanaka Y, et al. Expression of adenosine A2b receptor in rat type Ⅱ and Ⅲ taste cells[J].HistochemCellBiol, 2014,141(5):499-506.
[17] Figler R A, Wang G, Srinivasan S, et al. Links between insulin resistance, adenosine A2B receptors, and inflammatory markers in mice and humans[J].Diabetes, 2011,60(2): 669-79.
[18] Kolachala V, Ruble B,vijay-kumar M,et al. Blockade of adenosine A2Breceptors ameliorates murine colitis[J].BrJPharmacol, 2008, 155(1): 127-37.
[19] Li J, Li J, Yue Y, et al. Genistein suppresses tumor necrosis factor alpha-induced inflammation via modulating reactive oxygen species/Akt/nuclear factor kappaB and adenosine monophosphate-activated protein kinase signal pathways in human synoviocyte MH7A cells[J].DrugDesDevelTher, 2014,8:315-23.
[20] Antonioli L, Fornai M, Awwad O, et al. Role of the A(2B) receptor-adenosine deaminase complex in colonic dysmotility associated with bowel inflammation in rats[J].BrJPharmacol, 2014,171(5):1314-29.
[21] Elsherbiny N M,Al-Gayyar M M. Adenosine receptors: new therapeutic targets for inflammation in diabetic nephropathy[J].InflammAllergyDrugTargets, 2013,12(3):153-61.
[22] Antonioli L, Blandizzi C, Pacher P, et al. Immunity, inflammation and cancer: a leading role for adenosine[J].NatRevCancer, 2013,13(12): 842-57.
[23] Ponnoth D S,Jamal Mustafa S. Adenosine receptors and vascular inflammation[J].BiochimBiophysActa, 2011,1808(5):1429-34.
[24] Csoka B,Hasko G. Adenosine, inflammation pathways and therapeutic challenges[J].JointBoneSpine, 2011,78(1):4-6.
[25] Csóka B, Koscsó B, Töro G, et al. A2B adenosine receptors prevent insulin resistance by inhibiting adipose tissue inflammation via maintaining alternative macrophage activation[J].Diabetes, 2014,63(3):850-66.
[26] Zhu B, Yang J R, Chen S F, Jiang Y Q. The Attenuation of Lung Ischemia Reperfusion Injury by Oxymatrine[J].CellBiochemBiophys, 2014,70(1):333-6.
[27] Zhang Y, Sun S, Chen J, et al. Oxymatrine induces mitochondria dependent apoptosis in human osteosarcoma MNNG/HOS cells through inhibition of PI3K/Akt pathway[J].TumourBiol, 2014,35(2):1619-25.
[28] Guo C, Han F, Zhang C, et al. Protective effects of oxymatrine on experimental diabetic nephropathy[J].PlantaMed, 2014,80(4): p. 269-76.
[29] Wang S B,Jia J P. Oxymatrine attenuates diabetes-associated cognitive deficits in rats[J].ActaPharmacolSin, 2014, 35(3): 331-8.
Protective effect of oxymatrine on vein endothelial cell from glucose toxicity
YI Yun1,2, WU Qin2, HUANG Li-ping2, LIANG Shang-dong2, GAO Yun2
(1.TheDepartmentofScienceandTechnology,TheSecondAffiliatedHospitalofNanchangUniversity,2.DeptofPhysiology,BasicMedicalCollege,NanchangUniversity,Nanchang330006,China)
Aim To study the effect of oxymatrine (OMT) on protecting human umbilical vein endothelial cells (HUVECs) from toxicity induced by high glucoseinvitro. Methods The HUVECs were cultured with medium containing different concentrations of glucose or OMT. The cells were randomly divided into 6 groups: 5.5 mmol·L-1control group(Control), 22.2 mmol·L-1high glucose (22.2 mmol·L-1), 44.4 mmol·L-1high glucose (44.4 mmol·L-1), control + OMT(control+ OMT), 22.2 mmol·L-1high glucose + OMT(22.2 mmol·L-1+ OMT), 44.4 mmol·L-1high glucose+OMT (44.4 mmol·L-1+ OMT). The protective effect of oxymatrine was assessed by MTS assays. The expression of A2Bin HUVECs was detected by Real-time quantitative PCR (qPCR) and Western Blot methods. Results The glucose was shown to have caused cytotoxicity in HUVECs. Oxymatrine (3 μmol·L-1) was found to have protected HUVECs from glucose toxicity effectively, and reduced the expression of A2Bsignificantly. Conclusion Oxymatrine can obviously protect HUVECs from cytotoxicity induced by high glucose and the effect is performed partly by decreasing A2Bexpression.
oxymatrine; human umbilical vein endothelial cells (HUVECs); high glucose; cytotoxicity; A2Breceptor; diabetes
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.020.html
2014-12-12,
2015-02-24
国家自然科学基金资助项目(No 81100829, 81360136);江西省青年科学家培养计划资助项目(No 2BCB22001);江西省主要学科学术和技术带头人培养计划资助项目(No 2BCB22001)
易 云(1985-),男,硕士,研究方向:生理学和药理学,E-mail: yiyun.2010@163.com; 吴 琴(1985-),女,硕士,研究方向:生理学和药理学,共同第一作者,E-mail: 271872335@qq. com; 高 云(1973-),女,博士,教授,博士生导师,生理学硕导,研究方向:神经药理学,通讯作者,E-mail:gaoyun90 @163.com
10.3969/j.issn.1001-1978.2015.04.012
A
1001-1978(2015)04-0499-05
R284.1;R322.12;R329.24;R392.11;R587.1
