通心络胶囊抑制p38 MAPK磷酸化抑制糖尿病周围神经病变小鼠氧化应激
2015-06-09张会欣邢邯英
王 超, 张会欣, 邢邯英, 王 杏, 刘 敏, 张 哲
(1. 河北省人民医院老年医学重点实验室,河北 石家庄 050051;2. 河北以岭医药研究院药理室,河北 石家庄 050035)
◇复方药物药理学◇
通心络胶囊抑制p38 MAPK磷酸化抑制糖尿病周围神经病变小鼠氧化应激
王 超1, 张会欣2, 邢邯英1, 王 杏1, 刘 敏1, 张 哲1
(1. 河北省人民医院老年医学重点实验室,河北 石家庄 050051;2. 河北以岭医药研究院药理室,河北 石家庄 050035)
目的 观察通心络胶囊对糖尿病周围神经病变(DPN)小鼠氧化应激的作用并探讨其机制。方法 KK/Upj-Ay小鼠分为模型组、通心络高、中、低剂量组,另设C57BL/6小鼠为对照组。灌胃给药12周,测定热痛觉阈值和运动神经传导速度(MNCV);比色法测定血液中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)含量;荧光定量PCR和Western blot测定坐骨神经血红素氧合酶-1(HO-1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)表达;Western blot测定坐骨神经p38 MAPK、p-p38 MAPK、JNK、p-JNK、ERK、p-ERK蛋白表达。结果 与模型组比较,通心络组小鼠痛觉阈值升高,MNCV明显增快(P<0.05,P<0.01);SOD、GSH-Px活性明显上升,MDA含量上升(P<0.01);HO-1、γ-GCS mRNA和蛋白表达明显升高(P<0.05,P<0.01);p-p38 MAPK表达明显下降(P<0.05)。结论通心络胶囊可通过抑制p38 MAPK磷酸化水平而发挥其抗DPN小鼠氧化应激损伤的作用。
通心络胶囊;糖尿病周围神经病变;氧化应激;MAPK;p38 MAPK;KK/Upj-Ay小鼠
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)是糖尿病患者最为常见慢性并发症之一,也是足溃疡、感染及坏疽的主要致病因素。大量研究表明,糖尿病时氧化应激可通过多种途径损害神经,如MAPK通路,MAPK是重要的信号传导系统,氧化应激能够激活MAPK通路调节Ⅱ相酶超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和表达,引起机体发生病理生理改变[1-2]。通心络胶囊在治疗DPN患者临床研究中显示了很好的疗效[3-4]。我们采用KK/Upj-Ay小鼠为DPN动物模型,KK/Upj-Ay小鼠是常用的一种自发性2型糖尿病动物模型,研究表明,12周龄的KK/Upj-Ay小鼠即可出现周围无髓神经纤维空泡化、轴索闭锁等明显的DPN的病理特征[5]。本实验从氧化应激角度观察通心络胶囊对DPN小鼠的作用,并进一步研究其对丝裂原活化蛋白激酶(MAPK)的调控作用。
1 材料与方法
1.1 动物SPF级C57BL/6 ♂小鼠,25~30 g,10只;SPF级KK/Upj-Ay ♂小鼠,30~40 g,40只;均购于北京华阜康生物公司,动物合格证号:SCXK-(京)2009-0004。
1.2 药品与试剂通心络胶囊[由人参、水蛭、全蝎、赤芍、蝉蜕、土鳖虫、蜈蚣、檀香、降香、乳香(制)、酸枣仁(炒)、冰片组方,石家庄以岭药业股份有限公司生产,批号20110501];丙二醛(malondialdehyde,MDA)、SOD、GSH-Px试剂盒购自南京建成生物研究所;γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase,γ-GCS)和血红素氧合酶-1(heme oxygenase-1,HO-1)引物由上海生工生物技术公司合成;兔抗HO-1多克隆抗体、兔抗γ-GCS多克隆抗体、兔抗p38 MAPK多克隆抗体、兔抗p-p38 MAPK多克隆抗体、兔抗p-JNK多克隆抗体、兔抗JNK多克隆抗体、兔抗p-JNK多克隆抗体、兔抗ERK多克隆抗体购自美国Abcam公司。
1.3 仪器PowerLab生理记录仪购自AD Instrument公司;SpectraMax M2酶标分析仪购自美国分子仪器公司;凝胶成像分析仪购自Biorad公司;7300荧光定量PCR仪购自ABI公司。
1.4 动物分组与给药将40只♂ KK/Upj-Ay小鼠按空腹血糖值(FBG)分为模型组、通心络高剂量组(TXL-H)、通心络中剂量组(TXL-M)和通心络低剂量组(TXL-L),另设C57BL/6小鼠为对照组,每组10只动物。通心络高、中、低剂量组分别灌胃给予生药4、2、1 g·kg-1的通心络胶囊,模型组和对照组灌胃给予等体积的纯水,每日1次,连续12周。
1.5 热痛觉阈值测定和坐骨神经传导速度(MNCV)测定给药结束后,将小鼠放在恒温(55℃)热板仪上,以小鼠舔后足反应的潜伏期为痛觉阈值。运动神经传导速度测定时,连接PowerLab生理记录仪,将刺激电极插入小鼠右侧坐骨切迹,将2个记录电极分别插入小鼠踝部和左足底第2趾间,记录双通道复合动作电位。MNCV=两对记录电极间距离除以两通道复合动作电位潜伏期之差。
1.6 FBG、SOD、GSH-Px活性和MDA含量测定末次给药结束后,禁食,取血,血糖仪测定FBG;按试剂盒说明书比色法测定SOD、GSH-Px活性和MDA含量。
1.7 荧光定量PCR方法测定γ-GCS、HO-1 mRNA的表达实验结束后处死小鼠,取坐骨神经组织,提取总RNA,按试剂盒说明加样进行逆转录反应,荧光定量qPCR仪扩增。γ-GCS引物:上游:5′-GCACATCTACCACGCAGTCA-3′,下游:5′-CAGAGTCTCAAGAACATCGCC-3′,产物片段142bp;HO-1引物:上游:5′-GCTGGTGATGGCTTCCTTGT-3′,下游:5′-ACTGGGTTCTGCTTGTTGCG-3′,产物片段75bp;内参照GAPDH引物:上游:5′-TGCTGAGTATGTCGTGGAGTC-3′,下游:5′-TGCTGAGTATGTCG TGGAGTC-3′,产物片段143 bp。用仪器自带的分析软件,将对照组设定为1,以相对定量值RQ用于统计分析。
1.8 Western blot法检测γ-GCS、HO-1、p-p38 MAPK、p38 MAPK、p-ERK、ERK、p-JNK、JNK蛋白的表达实验结束后处死小鼠,取坐骨神经组织,提取总蛋白,半干法电泳转移至PVDF膜,用脱脂奶粉封闭,加入γ-GCS、HO-1、p38 MAPK、p-p38 MAPK、JNK、p-JNK、ERK、p-ERK和GAPDH一抗,后加入相应的二抗,化学发光法显影。对条带进行扫描,用软件分析条带中吸光度值,以目的蛋白γ-GCS、HO-1、p-p38 MAPK、p38 MAPK、p-ERK、ERK、p-JNK、JNK和GAPDH内参照吸光度值的比值用于统计分析。

2 结果
2.1 各组小鼠FBG、痛觉阈值及MNCV变化与对照组比较,模型组小鼠FBG值明显升高,痛觉阈值明显降低,MNCV明显减慢(P<0.01);通心络组FBG与模型组比较有下降的趋势,但差异无统计学意义(P>0.05)。通心络中、高剂量组与模型组比较痛觉阈值明显升高,MNCV明显增快(P<0.05,P<0.01)。见Tab 1。

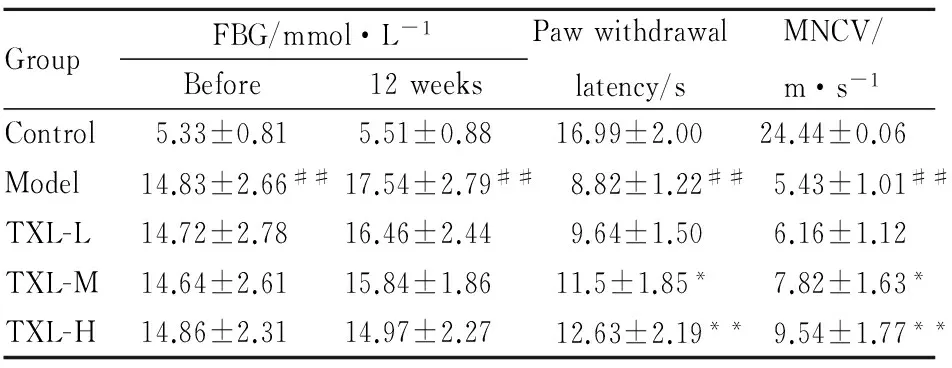
GroupFBG/mmol·L-1Before12weeksPawwithdrawallatency/sMNCV/m·s-1Control5.33±0.815.51±0.8816.99±2.0024.44±0.06Model14.83±2.66##17.54±2.79##8.82±1.22##5.43±1.01##TXL-L14.72±2.7816.46±2.449.64±1.506.16±1.12TXL-M14.64±2.6115.84±1.8611.5±1.85*7.82±1.63*TXL-H14.86±2.3114.97±2.2712.63±2.19**9.54±1.77**
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
2.2 各组小鼠血液中SOD、GSH-Px及MDA含量的变化与对照组比较,模型组SOD、GSH-Px活性明显下降,MDA含量明显升高(P<0.01);与模型组比较,通心络组SOD活性上升、MDA含量降低(P<0.01),中、高剂量组GSH-Px活性上升(P<0.01)。见Tab 2。
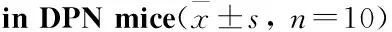

GroupSOD/kU·L-1GSH-Px/kU·L-1MDA/μmol·L-1Control72.5±7.9191.56±9.707.81±1.33Model40.33±4.43##45.73±5.63##12.29±1.19##TXL-L52.32±6.77**48.97±5.849.26±1.40**TXL-M59.98±7.15**56.16±5.83**9.81±1.56**TXL-H65.10±6.99**61.74±5.72**8.86±1.75**
##P<0.01vscontrol group;**P<0.01vsmodel group
2.3 各组坐骨神经HO-1、γ-GCS表达的变化与对照组比较,模型组HO-1、γ-GCS表达有升高的趋势,但差异无统计意义(P>0.05);与模型组比较,通心络组HO-1、γ-GCS mRNA表达明显上升(P<0.01),中、高剂量组HO-1、γ-GCS蛋白表达明显上升(P<0.05,P<0.01)。见Fig 1。

Fig 1 Effects of TXL on HO-1,γ-GCS mRNA(A) and protein (B) expression
1.Control;2.Model;3.TXL-L;4. TXL-M;5. TXL-H;*P<0.05,**P<0.01vsmodel group
2.4 各组坐骨神经MAPK通路的变化与对照组比较,模型组p38 MAPK蛋白磷酸化水平明显升高(P<0.01);通心络中、高剂量组p38 MAPK蛋白磷酸化水平明显低于模型组(P<0.05);p38 MAPK、p-JNK、JNK、p-ERK、ERK蛋白在各组表达差异无统计意义。见Fig 2。
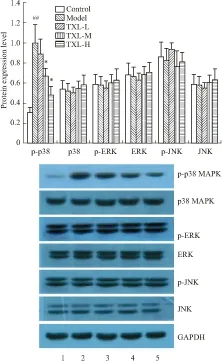
Fig 2 Effects of TXL on MAPK expression in DPN mice
1.Control;2.Model;3.TXL-L;4. TXL-M;5. TXL-H;##P<0.01vscontrol group;*P<0.05vsmodel group.
3 讨论
通心络胶囊是已上市的中药复方制剂,临床上用于治疗心绞痛、冠心病等心脑血管性疾病。近期临床陆续报道了通心络胶囊可以提高DPN患者传导速度、改善DPN体征[3-4]。我们实验也证实通心络胶囊能提高DPN小鼠痛觉阈值、提高神经传导速度,但并没有显示出明显的降糖作用,表明通心络胶囊的改善DPN作用是独立于降糖作用之外的其他机制。
大量研究证实,超氧化物阴离子的过量产生导致的氧化应激可损伤糖尿病动物的神经和血管组织的 DNA、脂质及蛋白质,导致神经传导速度下降,产生DPN[6-7]。HO-1和γ-GCS是体内重要的氧自由基清除剂和抗氧化剂,中药通过上调HO-1和γ-GCS表达预防和治疗DPN也有大量文献报道[8]。本实验结果显示,通心络胶囊给予灌胃12周后能降低MDA含量,提高SOD、GSH-Px活性,表明通心络胶囊改善DPN与有效减低DPN小鼠的氧化应激损伤有关。我们同时还观察到通心络胶囊能明显升高DPN小鼠坐骨神经HO-1、γ-GCS mRNA和蛋白表达,其中HO-1的活性直接影响到抗氧化损伤的能力的变化[9]。谷胱甘肽GSH是一种重要的抗氧化剂[10],谷氨酰半胱胺酸合成酶(γGCS)为其关键限速酶,坐骨神经HO-1、γ-GCS表达的升高与血液中MDA含量下降,SOD、GSH-Px活性升高二者互相印证,提示了通心络胶囊对DPN小鼠的抗氧化应激作用。
MAPK家族是引起细胞生物学反应(如细胞增殖、分化、转化及凋亡等)的重要信号传导系统,MAPK分为细胞外信号调节激酶(ERK)、c-Jun 氨基端激酶(JNK) 和p38 MAPK三类。其中p38 MAPK信号转导通路参与了神经病变的发生和发展[11]。Agthong等[12]报道了应用p38 MAPK抑制剂SB239063可防治糖尿病大鼠感觉神经元的传导障碍。我们观察了DPN小鼠MAPK通路的变化,研究发现坐骨神经中p38 MAPK磷酸化被激活,通心络胶囊灌胃给药12周能明显降低p38 MAPK磷酸化水平,表明通心络胶囊可通过抑制p38 MAPK磷酸化抑制DPN小鼠氧化应激。
通心络胶囊可通过抑制p38 MAPK途径,抑制DPN小鼠的氧化应激,从而保护神经细胞免受氧化应激损伤,提高神经传导速度,这可能是其保护 DPN 的作用机制之一。通心络胶囊为中药复方制剂,组方中的人参具有降糖、扩血管的作用,文献报道人参炔醇和人参环氧炔醇同时具有神经保护和神经营养作用,但是否在DPN中发挥作用尚需进一步研究。
[1] 王 萌, 王瑞英, 王素星. 氧化应激与糖尿病周围神经病变[J]. 临床荟萃, 2009, 24(5): 449-51.
[1] Wang M, Wang R J, Wang S X. Oxidation and diabetic peripheral neuropathy[J].ClinFocus, 2009, 24(5): 449-51.
[2] Al-Nimer M S, Al-Ani F S, Ali F S. Role of nitrosative and oxidative stress in neuropathy in patients with type 2 diabetes mellitus[J].JNeurosciRuralPract, 2012, 3(1):41-4.
[3] 葛近峰, 林育红, 汪 莹, 等. 通心络胶囊治疗糖尿病周围神经病变临床疗效评价[J]. 中国中医基础医学杂志, 2011, 17(10): 1121-3.
[3] Ge J F, Lin Y H, Wang Y, et al. Clinical efficacy evaluation of Tongxinluo capsule in diabetes peripheral neuropathy[J].ChinJBasicMedTraditChinMed, 2011, 17(10): 1121-3.
[4] 赵进东, 舒仪琼, 吴吉萍, 等. 通心络胶囊对糖尿病性周围神经病变患者神经传导速度作用的系统评价[J]. 世界中医药, 2014, 9(10): 1381-4.
[4] Zhao J D, Shu Y Q, Wu J P, et al. Systematical review on effect of Tongxinluo capsule on nerve conduction velocity of patients with diabetes peripheral neuropathy[J].WorldChinMed, 2014, 9(10): 1381-4.
[5] 张会欣, 王 超, 朱慧明, 等. 周络通胶囊激活转录因子Nrf2抑制糖尿病周围神经病变小鼠氧化应激[J].中国药理学通报, 2013,29(1):136-9.
[5] Zhang H X, Wang C, Zhu H M, et al. Zhouluotong capsule inhibits oxidative stress in diabetic perpheral ueuropathy mice by upregulating the activity of Nrf2[J].ChinPharmacolBull, 2013,29(1):136-9.
[6] Liu F, Ma F, Kong G, et al. Zinc supplementation alleviates diabetic peripheral neuropathy by inhibitingoxidative stress and upregulating metallothionein in peripheral nerves of diabeticrats[J].BiolTraceElemRes, 2014, 158(2):211-8.
[7] Kasznicki J, Kosmalski M, Sliwinska A, et al. Evaluation of oxidative stress markers in pathogenesis of diabetic neuropathy[J].MolBiolRep, 2012, 39(9):8669-78.
[8] 常 庚, 孙大勇, 常风云, 等. 益气通络法对糖尿病周围神经病变大鼠坐骨神经细胞凋亡和 HO-1 表达的影响[J]. 天津中医药大学学报, 2014,33(4):216-8.
[8] Chang G, Sun D Y, Chang F Y, et al. Effects of Yiqi Tongluo formula on cell apoptosis and the expression of anti-oxidant of HO-1 in sciatic nerve on diabetic peripheral neuropathy[J].JTianjinUnivTraditChinMed, 2014, 33(4): 216-8.
[9] Nath K A. Heme oxygenase-1 and acute kidney injury[J].CurrOpinNephrolHypertens, 2014, 23(1):17-24.
[10]Vlahos R1, Bozinovski S. Glutathione peroxidase-1 as a novel therapeutic target for COPD[J].RedoxRep, 2013,18(4):142-9.
[11]Kumphune S, Chattipakorn S, Chattipakorn N. Roles of p38-MAPK in insulin resistant heart: evidence from bench to future bedside application[J].CurrPharmDes, 2013,19(32):5742-54.
[12]Agthong S1, Tomlinson D R. Inhibition of p38 MAP kinase corrects biochemical and neurological deficits in experimentaldiabetic neuropathy[J].AnnNYAcadSci, 2002, 973(11):359-62.
Tongxinluo capsule inhibits oxidative stress in diabetic peripheral neuropathy mice by inhibiting the activity of p-p38 MAPK
WANG Chao1, ZHANG Hui-xin2, XING Han-ying1, WANG Xing1, LIU Min1, ZHANG Zhe1
(1.KeyLaboratoryofGeriatrics,HebeiGeneralHospital,Shijiazhuang050051,China;2.DeptofPharmacology,HebeiYilingMedicineInstitute,Shijiazhuang050035,China)
Aim To investigate the effects of Tongxinluo capsule on oxidative stress in diabetic peripheral neuropathy (DPN) mice and its mechanisms. Methods KK/Upj-Ay mice were divided into model, Tongxinluo low-dose group, Tongxinluo middle-dose group and Tongxinluo high-dose group. C57BL/6 mice were selected as control group. Mice were given drugs intragastrically for 12 weeks. Paw withdrawal latency, motor nerve conduction velocity (MNCV) were detected. Activity of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and content of malondialdehyde (MDA) in blood were detected by colorimetric method. The expression of heme oxygenase-1(HO-1), γ-glutamyl cysteine synthetase (γ-GCS) of sciatic nerve was examined by real time PCR and Western blot. The protein expression of p38 MAPK,p-p38 MAPK,JNK,p-JNK,ERK,p-ERK was examined by Western blot. Results Compared with model group, paw withdrawal latency was increased and MNCV was faster in Tongxinluo group (P<0.05,P<0.01). SOD and GSH-Px contents significantly increased, MDA content decreased (P<0.01). HO-1, γ-GCS mRNA and protein expression significantly increased (P<0.05,P<0.01) in Tongxinluo group. p-p38 MAPK protein expression decreased in Tongxinluo group (P<0.05). Conclusion Tongxinluo can inhibit oxidative stress in DPN of mice via suppressing the phosphorylation of p38 MAPK.
Tongxinluo capsule;diabetic peripheral neuropathy;oxidative stress;MAPK;p38 MAPK;KK/Upj-Ay mice
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.026.html
2015-02-24,
2015-03-28
国家科技部 “重大新药创制”科技重大专项(No 2011ZX09101-004-02);河北省中医药管理局科研计划项目(No 2014155)
王 超(1975- ),男,博士,副研究员,研究方向:老年病学, E-mail: cwyx163@163.com; 张会欣(1976- ),女,博士,正高级工程师,研究方向:糖尿病微血管病,通讯作者,E-mail:hxzhang76@sohu.com
10.3969/j.issn.1001-1978.2015.05.026
A
1001-1978(2015)05-0726-05
R-332;R287;R349.1;R587.2;R745