FFJ-5下调PKM2抑制MCF7生长及逆转MCF7/DOX细胞耐药性的研究
2015-06-09王天晓魏晓利李登云
王天晓,魏晓利,李登云
(河南大学中药研究所, 河南大学药学院, 河南 开封 475004)
FFJ-5下调PKM2抑制MCF7生长及逆转MCF7/DOX细胞耐药性的研究
王天晓,魏晓利,李登云
(河南大学中药研究所, 河南大学药学院, 河南 开封 475004)
目的 探讨 FFJ-5 对人乳腺癌细胞 MCF7 及其耐药细胞 MCF7/DOX 的作用及其机制。方法 采用 MTT 法检测 FFJ-5 对 MCF7 及 MCF7/DOX 细胞的增殖抑制作用及其对柔红霉素(doxorubicin, DOX)在耐药细胞MCF7/DOX中化疗敏感性的影响;Western blot 检测 FFJ-5 对EGFR、p-EGFR、Akt、p-Akt、PKM2、caspase-3、cleaved caspase-3、PARP、cleaved PARP及P-gp蛋白表达的影响;DNA ladder 分析检测FFJ-5对细胞基因组DNA的影响; RT-PCR检测低剂量 FFJ-5 对多药耐药基因MDR1 mRNA 水平的影响。结果 FFJ-5抑制了MCF7 细胞生长,降低了MCF7 细胞中EGFR、Akt 的表达及活性,下调了PKM2 水平;FFJ-5 可激活caspase-3、促使基因组DNA断裂;同时FFJ-5也能抑制耐药细胞MCF7/DOX 生长,并增强 DOX 在MCF7/DOX细胞中的活性,同时降低了MCF7/DOX细胞中EGFR、p-EGFR 及PKM2水平,但对MDR1 mRNA水平无影响。 结论 FFJ-5 可通过抑制 EGFR-Akt-PKM2 通路及激活线粒体凋亡相关因子 caspase-3 来抑制MCF7细胞生长,并诱导其凋亡,并可逆转MCF7/DOX的耐药性。
FFJ-5;丙酮酸激酶M2;EGFR;Akt;细胞凋亡;细胞耐药性;信号通路
乳腺癌是女性多发恶性肿瘤之一,手术、放疗及化疗仍是目前常采用的治疗方法,然而,化疗耐药性的产生严重阻碍了乳腺癌的有效治疗。因此,寻找新的化疗药物及治疗靶点或加以辅助手段减少传统化疗药物的用量并提高其疗效具有重要意义。肿瘤细胞与正常细胞代谢上的区别在于即使在供氧充足的条件下,肿瘤细胞的糖酵解产物也很少经过氧化磷酸化过程,肿瘤细胞主要依靠糖酵解的中间产物来合成生物大分子并提供能量,而丙酮酸激酶M2 (pyruvate kinase M2,PKM2) 则触发了肿瘤细胞有氧酵解的这一代谢过程[1-2]。研究发现,PKM2在多种肿瘤细胞中过表达,还可激活两个糖酵解基因GLUT1和LDHA,从而促进葡萄糖的消耗以及乳酸的生成,增加了肿瘤的酸性微环境,促进了肿瘤的发生发展,使得肿瘤细胞产生耐药性,逃避化疗药物[3]。下调PKM2的表达及活性可抑制肿瘤细胞的生长[4]。表皮生长因子受体(epidermal growth factor receptor, EGFR)过表达与肿瘤细胞的转移、侵润、预后差有关,PI3K/Akt通路是EGFR下游的主要信号转导通路之一。有研究发现,在宫颈癌细胞中抑制Akt的磷酸化可使PKM2水平降低[5]。因此,EGFR/Akt通路可能与PKM2的表达有关。FFJ-5为抗癌中药茜草提取物的结构修饰物,本研究拟以乳腺癌MCF7及其耐药细胞MCF7/DOX为实验对象,研究FFJ-5对EGFR/Akt/PKM2表达的影响,探讨FFJ-5的抗肿瘤活性及其作用机制。
1 材料与方法
1.1 试剂RPMI 1640培养基及新生牛血清购于Invitrogen公司; MTT购于Sigma公司; RT-PCR试剂盒为北京全式金生物公司产品; EGFR(18986-1AP)、p-EGFR(Tyr1068)(1H12)、Akt(11E7)、p-Akt(Ser473)(D9E)、PKM2(D78A4)、caspase-3(8G10)、cleaved caspase-3(Asp175)(5A1E)、PARP(46D11)、cleaved PARP(Asp214)(D64E10)一抗为Cell Sgnaling Technology 公司产品; P-gp(TC3.A.1.201)、β-actin(66009-1-lg)一抗及HRP标记二抗购于Protein Technology;Hoechst 33342及DNA ladder抽提试剂盒为碧云天产品;多柔比星(doxorubicin, DOX)为浙江海正药业有限公司产品;FFJ-5为茜草提取物的结构修饰物,由河南大学药学院康文艺老师馈赠。
1.2 细胞培养人乳腺癌细胞MCF7及其耐药细胞MCF7/DOX购于中国医学科学院血液学研究所,用含10 %血清、100 kU·L-1青霉素、100 mg·L-1链霉素的RPMI 1640培养基在37℃、5% CO2,饱和湿度条件下培养至对数生长期。MCF7/DOX细胞用终浓度为1.84 μmol·L-1DOX维持其耐药性,实验前2周换用无DOX的培养基培养。
1.3 细胞增殖检测采用MTT方法。FFJ-5的终浓度分别为0、6.75、13.5、27、54、108 μmol·L-1。DOX的使用终浓度分别为0、0.46、0.92、1.84、3.68、7.36 μmol·L-1(在MCF7细胞中)和0、9.2、18.4、36.8、73.6 μmol·L-1(在MCF7/DOX细胞中)。作用48 h后应用酶标仪检测各孔在490 nm波长下的吸光值(A值),计算细胞抑制率。
1.4 DNA ladder 分析收集经不同浓度FFJ-5处理48 h 的MCF7 及MCF7/DOX 细胞,用DNA ladder 抽提试剂盒(碧云天产品)提取基因组DNA,然后经1% 琼脂糖凝胶电泳分析以检测细胞凋亡。胰酶消化后,PBS或生理盐水洗1次,1 000~2 000×g离心1~2 min,弃上清,收集细胞。胰酶消化后,PBS或生理盐水洗1次,1 000~2 000×g离心1~2 min,弃上清,收集细胞。
1.5 Western blot收集经FFJ-5处理48 h后的MCF7及MCF7/DOX细胞,加入RIPA细胞裂解液, 冰上裂解30 min 后, 超声匀浆提取细胞总蛋白并定量。总蛋白经SDS-PAGE 胶电泳分离后, 转移至PVDF 膜上, 室温下5% 脱脂牛奶封闭l h, 加入EGFR、p-EGFR、Akt、p-Akt、PKM2、caspase-3、cleaved caspase-3、PARP、cleaved PARP及P-gp一抗4 ℃过夜, 洗膜3 次后, 加入辣根过氧化物酶标记的二抗室温孵育1 h, 再洗膜3 次, 经化学发光系统(Alpha, USA)检测蛋白表达水平。β-actin为内参蛋白。
1.6 RT-PCR经0、13.5、27 μmol·L-1FFJ-5处理48 h后的MCF7/DOX细胞,应用TRIzol 试剂提取细胞总RNA,利用RT-PCR试剂盒扩增MDR1 mRNA。MDR1-Forward primer: 5′-CCCATCATTGCAATAGCAGG-3′, Reverse primer :5′-GTTCAAACTTCTGCTCCTGA-3′ ,Product length:157 bp。GAPDH为内参,Forward primer 5′-CAAGGTCATCCATGACAA CTTTG-3′,Reverse primer 5′-GTCCACCACCCTGTTGCTGTAG-3′ ,Product length: 496 bp。PCR产物经1% 琼脂糖凝胶电泳检测。

2 结果
2.1 FFJ-5抑制MCF7及MCF7/DOX细胞生长MTT结果显示,FFJ-5作用48 h后,其对MCF7细胞的IC50为65.79 μmol·L-1,其在MCF7/DOX细胞中的IC50为66.66 μmol·L-1,MCF7及MCF7/DOX细胞的生长受到明显抑制,并呈剂量依赖性 (Fig 1)。

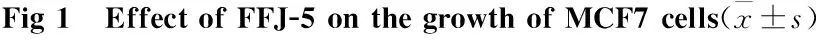
2.2 FFJ-5抑制MCF7细胞EGFR-Akt-PKM2通路Western blot结果显示,FFJ-5可剂量依赖性抑制MCF7中PKM2的表达(Fig 2A)。而膜受体酪氨酸激酶(RTKs)-PI3K/Akt- mTOR信号通路在控制细胞的生长、增殖、存活、营养和能量代谢等生命过程中起着重要作用。有研究发现,mTOR通过上调PKM2促进肿瘤细胞有氧糖酵解。因此本研究检测了FFJ-5对EGFR-Akt-PKM2通路的影响,发现FFJ-5可抑制MCF7细胞中EGFR-Akt的表达和活性(Fig 2B)。可见FFJ-5可能通过抑制EGFR-Akt-PKM2通路来抑制MCF7细胞生长。
2.3 FFJ-5激活caspase-3并引起MCF7细胞基因组DNA断裂在细胞内凋亡途径中,诱发线粒体释放细胞色素C,级联激活caspase-3,降解底物可促使细胞凋亡。聚ADP核糖多聚酶(PARP)为caspase-3的作用底物,是一种DNA修复相关分子,被酶解失活后细胞的功能和形态发生变化,表现为细胞固缩,与邻近细胞分离,同时染色质聚集,核碎裂,最后细胞分裂为凋亡小体。本研究显示,FFJ-5可激活caspase-3,促进PARP裂解(Fig 3A)。DNA ladder 分析结果显示,FFJ-5可引起MCF7细胞基因组DNA发生断裂 (Fig 3B)。

Fig 2 Effect of FFJ-5 on expression of EGFR-Akt-PKM2 pathway in MCF7 cells
Western blot was used to detect the levels of PKM2(A), EGFR, p-EGFR, Akt, p-Akt (B) protein. Results showed that FFJ-5 inhibited the pathway of EGFR-Akt-PKM2.*P<0.05,**P<0.01vscontrol group.
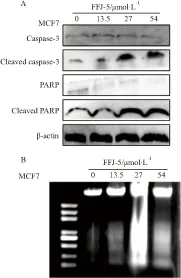
Fig 3 FFJ-5 activated caspase-3 and induced genomic DNA fragmentation
A: The effect of FFJ-5 on caspase-3 and PARP in MCF7 cells. Western blot was used to detect the levels of caspase-3, cleaved caspase-3, PARP and cleaved PARP. Results showed that FFJ-5 could activate caspase-3 and consequently promote the cleavage of PARP; B: DNA fragmentation analysis. Genomic DNA was extracted from cells exposed to FFJ-5 for 48 h, then DNA ladder analysis was performed. Results showed that FFJ-5 could induce the change of cell apoptotic morphology and DNA fragmentation in MCF7.
2.4 FFJ-5在柔红霉素耐药的MCF7/DOX细胞中的作用我们首先对MCF7/DOX的耐药特征进行鉴定,以阿霉素作为化疗药物,其耐药倍数为27.90(Fig 4A),而且MCF7/DOX细胞有多药耐药蛋白P-gp的高表达(Fig 4B),表明MCF7/DOX细胞具有耐药表型及耐药特征。由此,我们以MCF7/DOX细胞为实验对象,研究FFJ-5在耐药细胞中的作用。我们发现,13.5 μmol·L-1和27 μmol·L-1FFJ-5对MCF7/DOX细胞的生长抑制率小于20%(Fig 4C),分别以13.5 μmol·L-1和27 μmol·L-1FFJ-5与DOX 合用后,可使DOX在MCF7/DOX细胞中的IC50分别降低21.21%和42.19%,增强了DOX在MCF7/DOX中的敏感性(Fig 4D)。同时我们也检测了13.5 μmol·L-1和27 μmol·L-1FFJ-5 对MCF7/DOX 细胞中MDR1 mRNA水平的影响,结果显示,13.5 μmol·L-1和27 μmol·L-1FFJ-5 不会影响MDR1 mRNA的表达(Fig 4E)。但13.5 μmol·L-1和27 μmol·L-1FFJ-5可抑制EGFR的表达及活性,并降低了MCF7/DOX细胞中PKM2的水平(Fig 4F)。上述结果表明,FFJ-5可能不是通过影响MDR1基因表达的方式来增强DOX的敏感性,可能通过其它途径比如抑制EGFR-PKM2通路来逆转MCF7/DOX细胞耐药性。

Fig 4 Roles of FFJ-5 in MCF7/DOX cells
A: IC50of DOX in MCF7 and MCF7/DOX cells; B: The expression of P-gp in MCF7 and MCF7/DOX cells; C: FFJ-5 inhibited the growth of MCF7/DOX cells; D: FFJ-5 increased the activity of DOX in MCF7/DOX cells. All data were expressed as mean±standard deviation (SD); E: The effect of FFJ-5 on MDR1 mRNA in MCF7/DOX. RT-PCR assay was used to detect the mRNA level; F: The effect of FFJ-5 on expression of EGFR and PKM2 in MCF7/DOX cells.
3 讨论
中药茜草为茜草科植物茜草的根及根茎,具有凉血、化瘀、止血之功效。现有研究显示中药茜草提取物具有抗肿瘤活性[6-7]。FFJ-5是中药茜草提取物的结构修饰物,本研究显示FFJ-5可明显抑制人乳腺癌MCF7细胞的生长,并可诱导其凋亡。
肿瘤细胞的有氧糖酵解对肿瘤细胞的增殖和凋亡具有重要意义。与线粒体的氧化磷酸化相比,糖酵解可以更加迅速地产生能量,而且糖酵解的许多中间产物可被肿瘤细胞利用合成蛋白质、核酸及脂类,从而满足肿瘤迅速生长的需要[8-10]。Gatenby和Gillies[11-12]提出,在有氧条件下持续地将葡萄糖向乳酸转化是肿瘤在形成早期对间歇性缺氧的一种适应性行为,这种转化使细胞周围环境酸化,增加了细胞的侵袭性和转移力,使细胞对放射疗法和化学疗法产生抵抗效应,从而也促进了肿瘤细胞耐药性的产生。因此,抑制肿瘤细胞的糖酵解过程则会抑制其生长、促进其凋亡。肿瘤细胞的糖酵解过程受多个酶的调节,这为肿瘤治疗提供了很多潜在的靶点。
PKM2作为糖酵解途径的关键酶之一,在肿瘤细胞中高表达,触发了肿瘤细胞有氧酵解的代谢过程,从而为肿瘤细胞的生长提供物质及能量的需求,促进肿瘤细胞的增殖。PKM2现已成为肿瘤治疗的有效靶点,以PKM2为靶点,筛选PKM2抑制剂,对肿瘤治疗及抗肿瘤新药研发具有重要意义。
本研究结果显示,FFJ-5可下调PKM2表达,而且可能通过抑制EGFR通路来调控PKM2的表达,从而抑制乳腺癌MCF7细胞的生长。也有研究显示,PKM2与线粒体的细胞凋亡密切相关[13]。本研究显示,FFJ-5可激活caspase-3,促进PARP裂解,并引起基因组DNA断裂,从而诱导MCF7 细胞发生凋亡。
本研究也探讨了FFJ-5在耐药细胞MCF7/DOX中的作用,及其对DOX在MCF7/DOX细胞中作用的影响。结果显示FFJ-5也可抑制耐药细胞MCF7/DOX的生长,且13.5 μmol·L-1和27 μmol·L-1FFJ-5降低了DOX对MCF7/DOX细胞的IC50,增强了DOX在MCF7/DOX细胞的敏感性。同时对其增强DOX化疗敏感性的机制进行初步探讨,发现FFJ-5不会影响MCF7/DOX细胞中MDR1 mRNA的表达,其可能通过其它途径比如EGFR-PKM2通路来增强DOX的敏感性,还有待进一步研究。
综上,FFJ-5可通过EGFR通路下调PKM2表达,抑制人乳腺癌MCF7细胞生长,并可诱导其凋亡。同时FFJ-5还可增强DOX在耐药肿瘤细胞中的敏感性,逆转肿瘤的耐药性。PKM2可能成为肿瘤治疗的有效靶点,FFJ-5有望发展成为一种有效的抗肿瘤候选药物。
[1] Xu Q, Liu X, Zheng X, et al. PKM2 regulates Gli1 expression in hepatocellular carcinoma[J].OncolLett, 2014,8(5):1973-9.
[2] Iqbal M A, Gupta V, Gopinath P, et al. Pyruvate kinase M2 and cancer: an updated assessment[J].FEBSLett, 2014,588(16):2685-92.
[3] Yang W, Zheng Y, Xia Y, et al. ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect[J].NatCellBiol, 2012, 14(12):1295-304.
[4] Liu J, Wu N, Ma L, et al. Oleanolic acid suppresses aerobic glycolysis in cancer cells by switching pyruvate kinase type M isoforms[J].PLoSOne, 2014,9(3):e91606.
[5] 陈昆仑,刘 莹,李明利,等. PTEN通过AKT 介导的细胞代谢途径抑制宫颈癌细胞的增殖[J]. 西安交通大学学报,2013,34(5):563-7.
[5] Chen K L, Liu Y, Li M L, et al. PTEN inhibits proliferation of cervical cancer cells by AKT mediated cell metabolism[J].JXi’anJiaotongUniv, 2013,34(5): 563-7.
[6] Shilpa P N, Sivaramakrishnan V, Niranjali Devaraj S. Induction of apoptosis by methanolic extract of Rubia cordifolia Linn in HEp-2 cell line is mediated by reactive oxygen species[J].AsianPacJCancerPrev, 2012,13 (6):2753-8.
[7] Shilpa P N, Venkatabalasubramanian S, Devaraj S N. Ameliorative effect of methanol extract of Rubia cordifolia in N-nitrosodiethylamine-induced hepatocellular carcinoma [J].PharmBiol, 2012, 50 (3):376-83.
[8] Alessandro A, Christian W. Glucose metabolism in cancer cells[J].CurrOpinClinNutrMetabCare, 2010, 13:(4) 466-70.
[9] Guido K, Jacques P. Tumor cell metabolism: cancer’s Achilles’ heel[J].CancerCell, 2008, 13(6): 472-82.
[10] Kaelin W G Jr, Thompson C B. Q&A: Cancer: clues from cell metabolism[J].Nature, 2010, 465(7298): 562-4.
[11] Gatenby R A, Gillies R J. Why do cancers have high aerobic glycolysis[J].NatRevCancer, 2004, 4(11): 891-9.
[12] Gillies R J, Gatenby R A. Adaptive landscapes and emergent phenotypes: why do cancers have high glycolysis [J]?JBioenergBiomembr, 2007, 39(3): 251-7.
[13] Pandita A, Kumar B, Manvati S, et al. Synergistic combination of gemcitabine and dietary molecule induces apoptosis in pancreatic cancer cells and down regulates PKM2 expression [J].PLoSOne, 2014, 9(9):e107154.
FFJ-5 inhibits growth of MCF7 cells and reverses drug resistance of MCF7/DOX cells via down-regulation of PKM2
WANG Tian-xiao,WEI Xiao-li,LI Deng-yun
(InstituteofChineseMateriaMedica,HenanUniversity,PharmaceuticalCollegeofHenanUniversity,KaifengHenan475004,China)
Aim To investigate the roles of FFJ-5 in human breast cancer MCF7 cells and drug-resistant MCF7/DOX cells and to explore its mechanisms. Methods MTT assay was used to detect the effect of FFJ-5 on MCF7 and MCF7/DOX cell proliferation and sensitivity of doxorubicin in MCF7/DOX cells. Western blot was used to investigate the effect of FFJ-5 on expression of EGFR, p-EGFR, Akt, p-Akt, PKM2, cleaved caspase-3, cleaved PARP and P-gp. DNA ladder analysis was performed to determine the effect of FFJ-5 on genomic DNA. RT-PCR was performed to detect the influence of FFJ-5 on multidrug resistance gene MDR1 mRNA levels. Results The results showed that FFJ-5 inhibited the growth of MCF7, inhibited the expression and activity of EGFR and Akt, and consequently reduced the expression of PKM2 in MCF7 cells; FFJ-5 activated caspase-3 and induced genomic DNA fragmentation; FFJ-5 also inhibited the growth of MCF7/DOX cells and enhanced the anti-tumor activity of doxorubicin in MCF7/DOX cells. Conclusion The results suggest that FFJ-5 could inhibit MCF7 cell growth and induce MCF7 cell apoptosis through inhibition of EGFR-Akt-PKM2 pathway and activation of apoptosis-related factors caspase-3, meanwhile FFJ-5 could also reverse the resistance of MCF7/DOX.
FFJ-5; PKM2; EGFR; Akt;cell apoptosis;drug resistant cells; cell signal pathway
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.024.html
2015-01-17,
2015-02-22
河南省科技厅重点攻关项目(No 122102310558);河南省教育厅自然科学研究项目 (No 2011A310001)
王天晓(1975-),女,博士,副教授,研究方向:抗肿瘤药物筛选及机制研究,通讯作者,Tel/Fax:0371-23880680,E-mail:wtx1975@126.com
10.3969/j.issn.1001-1978.2015.05.025
A
1001-1978(2015)05-0721-06
R329.24;R329.25;R345.57;R737.902.2;R979.1