组蛋白去乙酰化酶抑制剂对大鼠应激性心肌损伤的保护作用*
2015-06-09刘晓华王天辉段瑞峰周学思刘洪涛张志清
武 磊, 刘晓华, 王天辉, 段瑞峰, 周学思, 刘洪涛, 张志清
(军事医学科学院卫生学环境医学研究所, 天津 300050)
组蛋白去乙酰化酶抑制剂对大鼠应激性心肌损伤的保护作用*
武 磊, 刘晓华, 王天辉, 段瑞峰, 周学思, 刘洪涛, 张志清△
(军事医学科学院卫生学环境医学研究所, 天津 300050)
目的:观察组蛋白去乙酰化酶抑制剂在应激性心肌损伤发生过程中的作用。方法:健康雄性Wistar大鼠随机分为3组(n=6),用束缚应激方法建立慢性应激性心肌损伤模型,采用组蛋白去乙酰化酶抑制剂曲古抑菌素A (TSA)干预,观察TSA对应激性心肌损伤的保护作用。Western blot检测实验各组大鼠心肌的组蛋白乙酰化水平,采用分光光度法动态监测大鼠血清乳酸脱氢酶(LDH)和肌酸激酶同工酶-MB(CK-MB)活性以及心肌组织Caspase 3活性,Nagar Olsen染色观察心肌的早期损伤。结果:束缚应激可以显著降低大鼠心肌的组蛋白乙酰化水平(P<0.05),而TSA干预可以抑制应激所致的心肌组蛋白乙酰化水平降低(P<0.05);束缚应激可以引起大鼠血清LDH和CK-MB活性、心肌组织Caspase 3活性显著升高(P<0.05),发生心肌早期损伤,而TSA干预可显著降低束缚应激引起的LDH(P<0.05)、 CK-MB活性(P<0.05)、Caspase 3活性升高(P<0.05)。结论:组蛋白去乙酰化酶抑制剂TSA对应激性心肌损伤具有一定的保护作用。
组蛋白去乙酰化酶抑制剂;束缚应激;心肌损伤;大鼠
染色质DNA的组蛋白乙酰化修饰是真核细胞基因表观遗传调控的一种重要调节方式,组蛋白乙酰基转移酶(histone acetyltransferase,HAT) 和组蛋白乙酰化酶(histone deacetylase,HDACs)调节组蛋白的乙酰化状态,以控制基因转录。近年来发现组蛋白的乙酰化修饰在心血管疾病中也具有重要的生理和病理生理意义,组蛋白去乙酰化酶在心肌肥大、心肌损伤、血管重塑等心血管疾病中的表达显著升高,而组蛋白脱乙酰基酶抑制剂能够有效改善心肌肥大过程中的房性心律不齐和纤维化[1],并且能够降低小鼠心肌缺血/再灌注损伤[2],据此推测组蛋白去乙酰化酶抑制剂可能能够抑制应激性心肌损伤的发生。本研究采用组蛋白去乙酰化酶抑制剂曲古抑菌素A (trichostatin A,TSA)干预束缚应激大鼠,探讨其对应激性损伤的保护作用,为寻找应激性心肌损伤的药物靶标和防护措施提供科学依据。
1 材料与方法
1.1 实验动物
清洁级健康雄性Wistar大鼠,体重180~200 g,购自军事医学科学院卫生学环境医学研究所动物中心。
1.2 药品和主要试剂
血清乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、肌酸激酶同工酶-MB(creatine kinase isoenzymes, CK-MB)购自中国北京中生北控公司,Caspase 3活性购自中国碧云天生物科技有限公司,组蛋白去乙酰化酶抑制剂TSA购自sigma公司,组蛋白H3乙酰化(H3K9)、组蛋白H4乙酰化(H4K12)、以及组蛋白H3抗体均购自美国cell signaling technology公司。其他试剂均为国产分析纯。
1.3 动物分组及给药
大鼠18只,随机分为3组(n=6): 对照组、束缚应激组、束缚应激+TSA干预组。束缚应激组和束缚应激+TSA干预组采用自制的束缚仓进行束缚,束缚方法参照Galea LAM的方法[3],每天束缚6 h(9∶00-15∶00),共束缚3周。束缚应激+TSA干预组于每天束缚应激前1 h经静脉注射TSA 5 mg/kg。对照组与实验组饲养条件相同,不进行束缚。
1.4 血样采集
血样采集采用眼眶内眦采血。分别在束缚应激前、1周、2周、3周束缚结束后,眼眶内眦采血,采用肝素抗凝,4℃下3 000 r/min离心10 min, 取上清,-80℃保存。
1.5 心肌组织组蛋白乙酰化水平的检测
第3周束缚应激结束后,大鼠断头处死,剪取心尖部分,置于预冷的匀浆介质中匀浆。700×g,离心7 min,弃上清后加入等量的裂解液裂解40 min,12 000×g离心10 min,取上清。BCA法蛋白定量后,加入5×上样缓冲液,100℃煮沸5 min变性。各组蛋白样品进行SDS-PAGE电泳,转印至PVDF膜上,5%脱脂奶粉加一抗孵育过夜、二抗室温孵育1 h,X光胶片压片曝光、显影、定影。
1.6 大鼠血清乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)活性检测
乳酸脱氢酶(LDH)试剂盒(试剂ⅠNAD 6.5 mol/L;试剂ⅡTris100 mmol/L pH 8.9;KCl 100 mmol/L;L-乳酸锂52 mmol/L),采用生物化学法测定。LDH值计算:LDH活性(U/L)=△A/min×8095。
肌酸激酶同工酶(CK-MB)活性测定采用生物化学法,按照试剂盒要求测定。 CK-MB的计算参见公式:CK-MB(U/L)=△A/min×1605。
1.7 心肌组织Caspase 3活性检测
采用分光光度法检测组织裂解液中Caspase 3酶活性。按照每10 mg组织加入100 μl裂解液的比例加入裂解液,在冰浴上用玻璃匀浆器匀浆,把匀浆液转移到1.5 ml离心管中,冰浴再裂解5 min,4℃ 16 000~20 000×g离心10~15 min,把上清转移到冰浴预冷的离心管中,立即测定Caspase 3的酶活性,同时取少量样品用BCA法测定蛋白浓度。
1.8 大鼠心肌Nagar Olsen染色的光镜观察
大鼠心肌石蜡切片制备:束缚3周实验结束后,处死大鼠,取心肌固定在4%甲醛中固定24 h,酒精梯度脱水,酒精/二甲苯(体积比1∶1)15 min,二甲苯I 15 min,二甲苯II 15 min依次透明,石蜡包埋,切片,常规脱蜡,复水,染色。
Nagar Olsen染色:该方法为可以显示心肌早期损伤的苏木素碱性复红苦味酸染色法。切片浸入明矾苏木素液10~30 s,自来水冲洗5 min,碱性复红染色液染色3 min,蒸馏水洗5~10 s,纯丙酮洗5 s,1%苦味酸纯丙酮液迅速分化5~15 s,纯丙酮脱水,二甲苯透明和中性树胶封固,光学显微镜下观察。
1.9 统计学处理
2 结果
2.1 心肌组织组蛋白乙酰化水平变化
Western blot结果显示,束缚应激组大鼠心肌组织组蛋白H3和H4的乙酰化水平较对照组显著降低至40%左右(P<0.05,图1),而用组蛋白去乙酰化酶抑制剂TSA干预后,心肌组织组蛋白乙酰化水平相对于应激组大鼠显著升高(P<0.05,图1)。结果表明,组蛋白去乙酰化酶在应激性心肌损伤中有重要作用,而组蛋白去乙酰化酶抑制剂TSA可以显著抑制HDACs的活性,抑制应激引起的组蛋白乙酰化水平降低。
2.2 心肌酶活性
心肌酶活性结果显示,束缚应激组大鼠血浆LDH和CK-MB的活性明显升高,而用TSA 干预的束缚应激+TSA组大鼠血浆LDH和CK-MB的活性较束缚应激组显著降低(表1、表2),表明TSA干预能够降低束缚应激所造成的心肌酶活性升高。
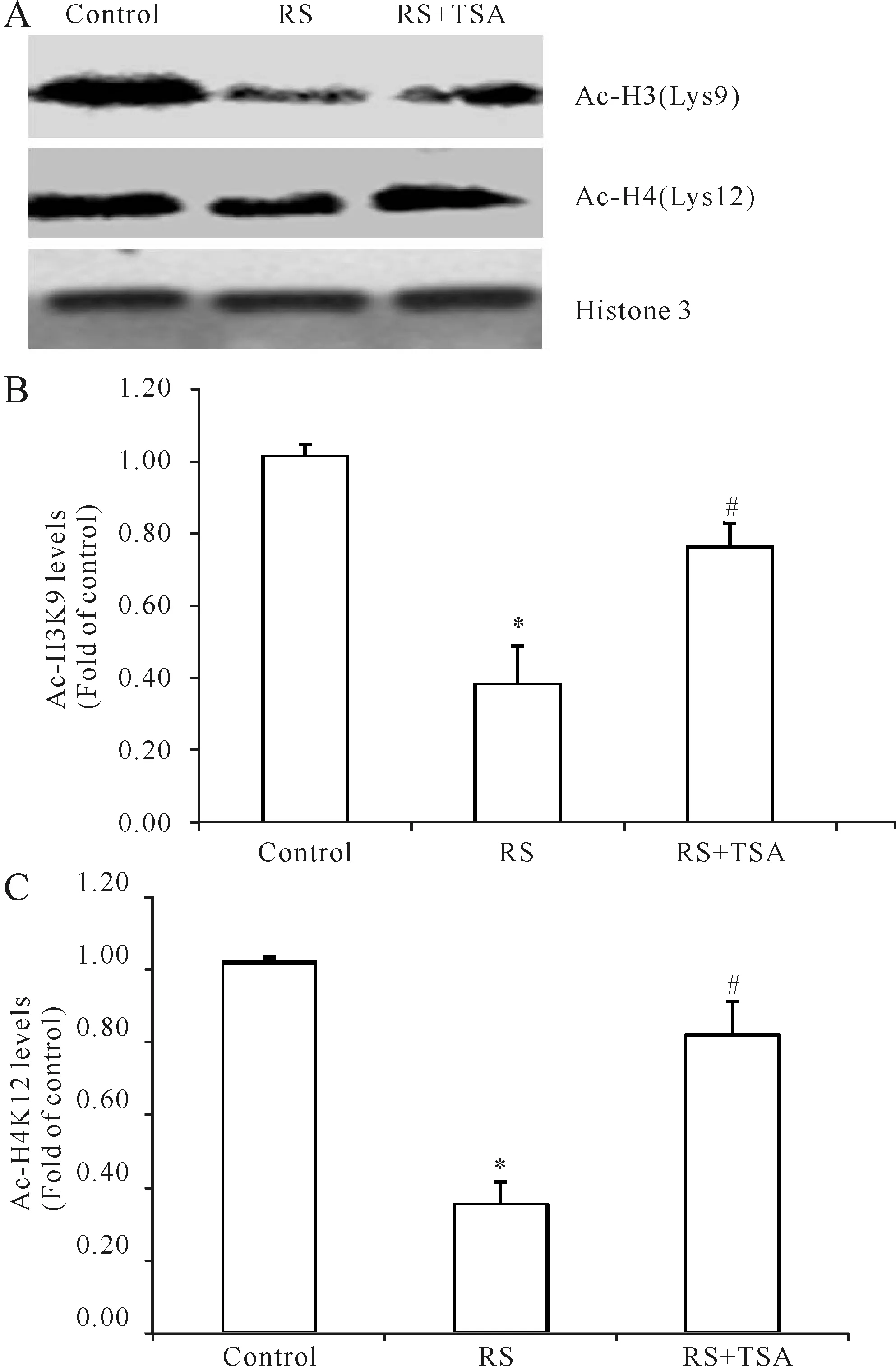
Fig. 1 Effect of TSA intervention on the levels of histone acetylation in myocardial tissue B: Ac-H3K9 levels; C: Ac-H4K12 levels; RS: Restraint stress; RS+TSA:Restraint stress with TSA treatment group; TSA: Trichostatin; Ac-H3K9: Acetylation-Histone 3 lysine 9; Ac-H4K12: Acetylation-Histone 4 lysine 12*P<0.05vscontrol;#P<0.05vsRS group
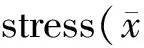

Group0week1week2week3weekControl51.12±12.5356.21±13.4554.65±14.2353.25±12.46RS52.26±11.6867.13±17.18146.51±18.48∗236.11±43.08∗RS+TSA47.31±8.8056.88±15.16111.48±9.12#166.68±26.09#
RS: Restraint stress group; RS+TSA: Restraint stress with TSA treatment group; TSA: Trichostatin; LDH: Lactate dehydrogenase
*P<0.05vscontrol;#P<0.05vsRS group
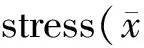
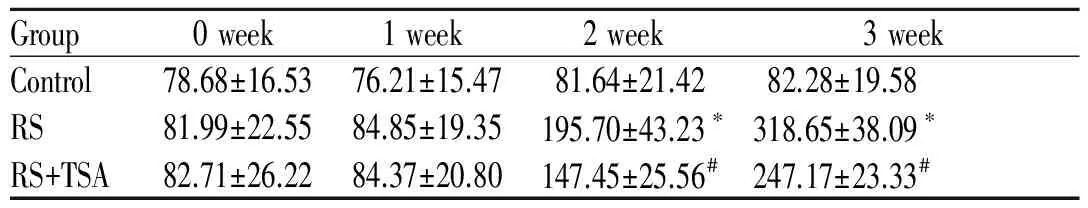
Group0week1week2week3weekControl78.68±16.5376.21±15.4781.64±21.4282.28±19.58RS81.99±22.5584.85±19.35195.70±43.23∗318.65±38.09∗RS+TSA82.71±26.2284.37±20.80147.45±25.56#247.17±23.33#
RS: Restraint stress group; RS+TSA: Restraint stress with TSA treatment group; TSA: Trichostatin; CK-MB: Creatine kinase isoenzymes
*P<0.05vscontrol;#P<0.05vsRS group
2.3 心肌组织Caspase 3活性
Caspase 3 是凋亡发生过程中所需要的一种重要的蛋白酶,同时也是凋亡发生的标志酶。为了进一步确认TSA干预对束缚应激所致心肌损伤的影响,本研究测定了大鼠心肌组织裂解物Caspase 3的活性。结果如图所示,束缚应激组大鼠心肌组织Caspase 3活性(1063.89±121.66)较对照组大鼠心肌组织Caspase 3活性(204.05±67.86)显著增高(P<0.05,图2),而TSA干预组心肌组织Caspase 3活性(693.63±118.09)较束缚应激组显著降低(P<0.05,图2),结果表明TSA干预可以显著降低束缚应激引起的心肌组织细胞凋亡。

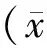
2.4 心肌组织Nagar Olsen染色
Nagar Olsen染色能反映心肌的早期损伤。用特异碱性复红染色方法使早期损伤的心肌细胞着色,损伤心肌呈红色,正常心肌呈黄色或黄棕色,细胞核呈蓝色。染成红色的组织为损伤部位,红色范围的大小及颜色的轻重可以代表损伤程度。如图所示,Nagar-Olsen染色结果表明,大鼠经过6 h/d的束缚应激,3周后心肌红色染色范围明显增加,表明出现明显的心肌损伤(图3B)。而用TSA干预束缚应激大鼠,心肌损伤程度明显减弱,结果表明,TSA干预可以降低束缚应激引起的心肌损伤(图3C)。

Fig. 3 Effect of TSA intervention on the stress-induced myocardial injury (Nagar olsen ×200) A: Control group; B: Restraint stress group; C: TSA intervention during restraint stress
3 讨论
应激(stress)是机体对生存环境中多种不利因素适应过程中,实际上或认知上的要求与适应和应付能力之间不平衡导致的心身紧张状态及其反应。适度应激可以提高机体对不良外界因素的抵抗能力,并实现机体对外界环境的代偿性的适应;而长期或过高强度应激则会使机体发生适应不良,引起多种疾病的发生。目前的研究已经证实,高强度的心理应激可以引起神经精神疾病、心脑血管疾病、自身免疫性疾病、肿瘤及内分泌疾病等多种重大致死性疾病的发生[4-6]。因此,研究应激致心肌损伤的机制及其保护性干预措施对于预防应激性疾病的发生具有重要意义。
表观遗传学(epigenetics)是不涉及DNA 序列改变的可遗传的基因表达变化研究, 包括DNA甲基化、组蛋白共价修饰、非编码RNA等。在表观修饰的各种形式中, 组蛋白的共价修饰具有重要作用,它能够调节基因的表达调控。组蛋白的共价修饰包括组蛋白的磷酸化、乙酰化、甲基化修饰等,组蛋白乙酰化及去乙酰化修饰是组蛋白共价修饰的最重要的方式,组蛋白的乙酰化水平可以直接影响相关基因的表达调控[1],这种可逆的组蛋白的动态修饰是由组蛋白乙酰基转移酶( HAT) 和组蛋白乙酰化酶(HDACs)共同催化。组蛋白的乙酰化程度与转录活性密切相关:转录活动区域核心组蛋白的乙酰化密度高,而不活动区域乙酰化密度低[1]。HAT能够促进染色体的解聚,激活转录;而HDACs则封闭DNA抑制转录过程。研究表明,组蛋白去乙酰化酶在心肌肥大、心肌损伤、血管重塑等心血管疾病中有重要调节作用,而组蛋白去乙酰化酶抑制剂可以显著改善这些心血管疾病的发生。本研究发现组蛋白的乙酰化水平在应激致心肌损伤过程中显著降低,提示组蛋白去乙酰化酶在应激性心肌损伤中具有重要作用,而用组蛋白去乙酰化酶的广谱抑制剂TSA干预束缚应激大鼠, TSA可以显著抑制应激性心肌损伤过程中的组蛋白乙酰化水平降低,进而抑制束缚应激所引起的心肌损伤的发生,结果表明,组蛋白去乙酰化酶在应激所致的心肌损伤中有重要作用。
以前有研究表明,心肌酶活性是心肌损伤的重要特征[7],而本课题组以往的研究表明,线粒体介导的细胞凋亡也是应激所致心肌损伤的重要特征[8-10]。据报道,组蛋白去乙酰化酶抑制剂TSA可以抑制线粒体凋亡为特征的Caspase 3酶活性升高,表明组蛋白去乙酰化酶抑制剂TSA可以抑制以线粒体介导的细胞凋亡为特征的心肌损伤,本研究证实TSA可以抑制应激引起的以线粒体为特征的心肌损伤的发生。可能原因在于:应激可以引起机体神经内分泌的变化,过度分泌的相关激素通过一系列信号转导机制引起心肌组蛋白乙酰化和去乙酰化的失衡,引起相关基因表达的紊乱,进而引起心肌功能的失调,引发心肌损伤。
本研究初步证实了组蛋白去乙酰化酶抑制剂TSA可以抑制以线粒体介导的细胞凋亡为特征的线粒体损伤,为应激性心肌损伤的防护提供了一种新的可能的干预措施。但是,究竟是哪种组蛋白去乙酰化酶在应激所致心肌损伤中发挥作用,这种组蛋白去乙酰化酶在应激所致心肌损伤的作用机制是什么,都有待进一步研究阐明。
[1] Liu F, Levin MD, Petrenko NB,etal. Histone-deacetylase inhibition reverses atrial arrhythmia inducibility and fibrosis in cardiac hypertrophy independent of angiotensin [J].JMolCellCardiol, 2008, 45(6): 715-723.
[2] Granger A, Abdullah I, Huebner F,etal. Histone deacetylase inhibition reduces myocardial ischemia-reperfusion injury in mice [J].FASEBJ, 2008, 22(10): 3549-3560.
[3] Galea LA, McEwen BS, Tanapat P,etal. Sex differences in dendritic atrophy of CA3 pyramidal neurons in response to chronic restraint stress [J].Neurosci, 1997, 81(3): 689-697.
[4] 冯 红, 刘 卫, 战 锐, 等. NGFI-B 在应激损伤心肌细胞中的亚细胞定位及其生物学效[J]. 中国应用生理学杂志, 2011, 27(3): 289-193.
[5] Silverman MN, Deuster PA. Biological mechanisms underlying the role of physical fitness in health and resilience [J].InterfaceFocus, 2014, 4(5): 20140040.
[6] Wei J, Rooks C, Ramadan R,etal. Meta-analysis of mental stress-induced myocardial ischemia and subsequent cardiac events in patients with coronary artery disease [J].AmJCardiol, 2014, 114(2): 187-192.
[7] 王福文, 赵敬国, 王 燕, 等. 力竭性运动后大鼠血清CK、CK-MB 活性和心肌组织形态学的动态改变[J]. 中国应用生理学杂志, 2011, 27(1): 52-55.
[8] Qian L, Song X, Ren H,etal. Mitochondrial mechanism of heat stress-induced injury in rat cardiomyocyte [J].CellStressChaperones, 2004, 9(3): 281-293.
[9] Mei Z, Wang X, Liu W,etal. Mitochondrial adaptations during myocardial hypertrophy induced by abdominal aortic constriction [J].CardiovascPathol, 2014, 23(5): 283-288.
[10]Wang X, Gong J, Liu X,etal. Expression of uncoupling protein 3 in mitochondria protects against stress-induced myocardial injury: a proteomic study [J].CellStressChaperones, 2010, 15(6): 771-779.
Protective effects of histone deacetylase inhibitor on stress-induced myocardial injury in rats
WU Lei, LIU Xiao-hua, WANG Tian-hui, DUAN Rui-feng, ZHOU Xue-si, LIU Hong-tao, ZHANG Zhi-qing△
(Institute of Health and Environmental Medicine, Academy of Military Medical Sciences, Tianjin 300050, China)
Objective: To observe the protective effects of histone deacetylase inhibitor on stress-induced myocardial injury. Methods: Healthy male Wistar rats were randomly divided into 3 groups(n=6), and the stress-induced myocardial injury model was established with chronic restraint stress method. The protective effects of histone deacetylase inhibitor on stress-induced myocardial injury were observed with Trichostatin A (TSA) intervention. Histone acetylation levels in myocardium of rats were detected by Western blot method, spectrophotometry method was used to dynamically determine the activity of rat serum lactate dehydrogenase (LDH), serum creatine kinase isoenzyme -MB (CK-MB) and Caspase 3, and nagar Olsen staining were used to observe the early myocardial damage. Results: Restraint stress could significantly reduce the level of histone acetylation of myocardium in rats, and TSA intervention could inhibit the stress-induced reduction of myocardial levels of histone acetylation. Restraint stress could cause the significant increase of serum LDH activity (P<0.05), serum CK-MB activity (P<0.05), and the Caspase 3 activity of myocardial tissue (P<0.05), and early myocardial damage also occurred during restraint stress. TSA intervention could significantly reduce the serum LDH activity (P<0.05), the serum CK-MB activity (P<0.05), the activity of myocardial tissue caspase 3 induced by restraint stress (P<0.05), and the stress-induced myocardial injury was also attenuated by TSA intervention. Conclusion: The histone deacetylase inhibitor TSA can protect stress-induced myocardial injury.
histone deacetylase inhibitor; restraint stress; myocardial injury; rat
国家自然科学基金青年项目(81302415);天津市应用基础及前沿技术研究计划(12JCYBJC15800)
2014-11-18
2015-02-26
R331.3
A
1000-6834(2015)03-193-04
10.13459/j.cnki.cjap.2015.03.001
△【通讯作者】Tel: 13752585610; E-mail: camelhuifeng@126.com
