肾移植术后抗磷脂酶A2受体抗体阳性的复发性膜性肾病
2015-06-08程东瑞倪雪峰陈惠萍
程东瑞 倪雪峰 陈惠萍
·临床集锦·
肾移植术后抗磷脂酶A2受体抗体阳性的复发性膜性肾病
程东瑞 倪雪峰 陈惠萍
40岁男性患者,既往临床表现肾病综合征,自体肾活检诊断膜性肾病(MN),抗磷脂酶A2受体(PLA2R)抗体滴度阳性,起病后7年进入慢性肾衰竭行血液透析(HD)治疗,HD治疗5个月后接受亲属活体肾移植,术前抗PLA2R抗体阳性。移植术后6个月尿蛋白阳性,抗PLA2R抗体滴度升高,移植肾活检提示MN复发。以抗CD20单克隆抗体(美罗华)375 mg/m2治疗后,患者蛋白尿转阴,抗PLA2R抗体滴度下降。
肾移植 膜性肾病复发 抗磷脂酶A2受体抗体 利妥昔单抗
病史摘要
现病史 40岁男性,因“肾移植术后6个月,发现蛋白尿1个月”2014-09-11入院。
患者2014-03-18因“膜性肾病(MN)、慢性肾功能不全(CKD 5D期)、维持性血液透析治疗中”在我院行亲属活体肾移植术,哥哥为其捐肾(52岁),供肾活检未见明显异常(图1A),免疫荧光见IgA+及C3++弥漫阳性(图1B),供肾抗磷脂酶A2受体(PLA2R)抗体免疫荧光检查阴性。供受者术前检查未见明显手术禁忌症。患者术前抗PLA2R抗体阳性(ELISA法滴度227.8)。术前配型情况:FLOW-PRA阴性,淋巴细胞毒试验CDC 4%,供受者HLA基因位点6错配。免疫诱导方案为甲泼尼龙500 mg×3d+兔抗人胸腺细胞球蛋白(ATG) 50 mg×3d,术后免疫抑制方案采用吗替麦考酚酯(MMF)、他克莫司(FK506)联合泼尼松治疗,FK506浓度波动在5~8 ng/ml,术后1周血清肌酐(SCr)降至正常,术后随访期间SCr波动于106.1~132.4 μmol/L(图2)。术后复查尿蛋白阴性,抗PLA2R抗体阳性,滴度稳定(3月20日滴度217.8,3月28日滴度220.9)。2014-08-22复查抗PLA2R抗体转为阴性。患者术后5月出现尿蛋白阳性,24h尿蛋白定量最高1.54 g/24h,收入院行移植肾活检明确诊断,同时复查抗PLA2R抗体由阴性转为阳性(9月16日滴度51.24)。
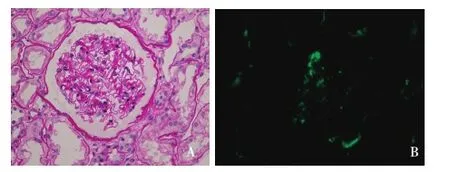
图1 供肾活检(2014-03-18)。A:肾小球系膜区增宽不明显,毛细血管袢开放欠好,肾小管上皮细胞刷状缘扁平(PAS,×400);B:C3++,呈颗粒状节段沉积于肾小球毛细血管袢及系膜区(IF,×400)
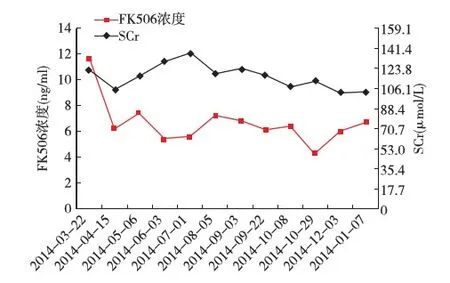
图2 肾移植术后SCr和FK506浓度变化SCr:血清肌酐;FK506:他克莫司
既往史 患者于2005-11-09劳累后出现双下肢、颜面部水肿,11月22日查尿蛋白定量1.48 g/24h,尿沉渣红细胞计数(RBC)计数3万/ml(多形型),血清白蛋白20.0 g/L,胆固醇8.04 mmol/L,SCr 61.9 μmol/L,尿素5.18 mmol/L,双肾B超:LK/RK 121/116 mm,皮质厚度不清。临床诊断为肾病综合征,于2005年11月行第一次肾活检(图3),诊断符合MN。治疗上给予雷公藤多苷片60~120 mg/d+泼尼松15~30 mg/d口服治疗,至2009-09-29,患者SCr波动于41.5~92.8 μmol/L,血清白蛋白21.4~28.6 g/L,尿蛋白定量2.79~13.95 g/24h,RBC 3~375万/ml,多形性。
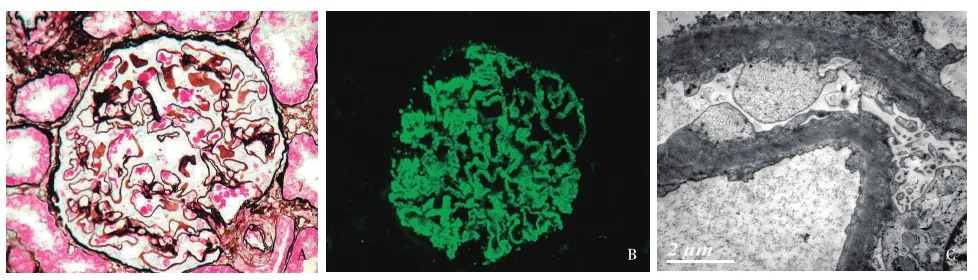
图3 第一次自体肾活检(2005-11)。A:肾小球节段系膜区增宽,外周袢扩张、僵硬,上皮侧较多嗜复红物沉积,节段钉突形成(PASM-Masson,×400);B:IgG++,细颗粒状弥漫分布于肾小球毛细血管袢(IF,×400);C:肾小球毛细血管袢基膜均匀一致性增厚,膜上见中等电子密度的致密物,肾小球足细胞足突呈板层样融合,较多微绒毛化(EM)
2009年患者因工作变动未按时门诊随访,自述药物治疗方案不变,当地尿检无改善,肾功能正常。2011年7月发现SCr轻度升高,停“泼尼松及雷公藤”,服“尿毒清颗粒、药用炭、α酮酸、金水宝”及纠正贫血等治疗,SCr仍持续缓慢上升。2012年6月查SCr 377.5 μmol/L,尿蛋白定量3.04 g/24h,血白蛋白35.4 g/L,血红蛋白98 g/L、尿糖++,抗PLA2R阳性。2012年6月入院行第二次自体肾活检为膜性病变及球性废弃(17/29)等病变(图4),临床未发现明确继发因素,给予保肾、纠酸、调整钙磷代谢等治疗。患者SCr波动于470.3~602 μmol/L,血白蛋白波动于35.8~37.8 g/L,尿蛋白定量波动于2.92~7.24 g/24h,RBC 2~24万/ml(多形性)尿糖+++。
2013年10月患者开始接受维持性血液透析治疗。
辅助检查
尿液 尿蛋白定量0.68 g/24h,尿RBC 1万/ml,NAG酶7.3 U/(g·cr),视黄醇结合蛋白 0.1 mg/L。
血液 白细胞计数7.8×109/L,血红蛋白125 g/L,血小板计数184×109/L,尿素17.4 mg/dL,SCr 115.8 μmol/L,钾4.18 mmol/L,钠140.2 mmol/L,钙2.23 mmol/L,磷1.03 mmol/L,总二氧化碳25.3 mmol/L。
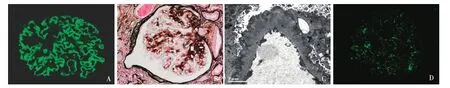
图4 自体肾重复肾活检(2012-06)。A:IgG++,呈颗粒状沿肾小球毛细血管袢分布(IF,×400);B:肾小球毛细血管袢钉突形成(PASM-Masson,×400);C:肾小球毛细血管袢基膜上皮侧电子致密物沉积,偶见电子致密物周吸收透亮区(EM);D:肾小球毛细血管袢抗磷脂酶A2受体抗体呈细颗粒状弥漫分布于肾小球毛细血管袢(IF,×400)
免疫学检查 CD4/CD8 253/187个/μl;AECA 阴性;FLOW-PRA 全阴性。抗PLA2R抗体阳性(9月16日滴度51.24)。
病原学检查 传染病四项阴性。
血药浓度 MMF血药AUC 23.64 mg·h/L、FK506血药浓度 6.42 ng/ml。
特殊检查 心脏超声:室间隔厚度11 mm,左心室内径48 mm,左室后壁厚度10 mm;LVEF:75%。移植肾血管彩色多普勒检查未见异常。移植肾MRA:肾移植术后改变,移植肾上部肾盏轻度扩张;移植肾动脉未见明显异常。
诊断分析及诊疗经过 40岁男性患者,肾移植术后6个月,蛋白尿1个月。既往原发病时表现肾病综合征,自体肾活检为MN,且自体肾重复活检时查抗PLA2R抗体阳性,供肾活检病理正常(图1),此次肾移植术后出现蛋白尿、抗PLA2R抗体再次阳性,移植肾活检提示膜性病变,且肾组织抗PLA2R抗体染色强阳性(图5),临床诊断为移植肾MN复发。9月20日给予利妥昔单抗600 mg静脉滴注治疗。复查尿蛋白定量降至0.19 g/24h,抗PLA2R抗体滴度降至27.13。
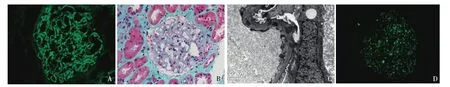
图5 移植肾活检(2014-09)。A:IgG++,呈颗粒状弥漫沉积于肾小球毛细血管袢(IF,×400);B:肾小球毛细血管袢上皮侧嗜复红物沉积(Masson三色,×400);C:肾小球毛细血管袢基膜膜内及上皮侧散在电子致密物沉积(EM);D:肾小球毛细血管袢抗磷脂酶A2受体抗体染色呈细颗粒状弥漫分布于肾小球毛细血管袢(IF,×400)
抗PLA2R抗体检测情况 患者术前抗PLA2R抗体阳性,术后复查抗PLA2R抗体阳性,滴度稳定。2014-08-22复查抗PLA2R抗体转为阴性。患者术后5月复查抗PLA2R抗体由阴性转为阳性,接受美罗华治疗后抗PLA2R抗体滴度下降(图6)。患者尿蛋白检测情况(图7)。
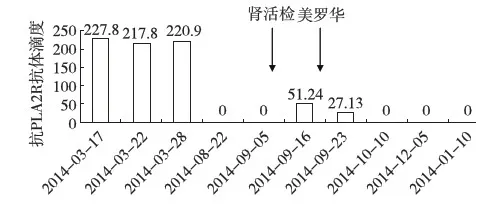
图6 肾移植后抗PLA2R抗体滴度变化PLA2R:磷脂酶A2受体
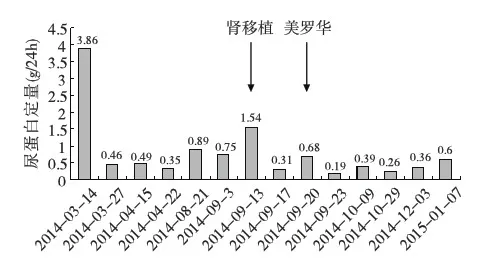
图7 肾移植术后尿蛋白变化
讨 论
MN系各种原因导致的免疫复合物在肾小球上皮下沉积致基膜出现病变的肾小球疾病。MN是成人肾病综合征的常见病因[1],约占成人肾病综合征的20%,且发生率仍不断上升。MN可分为特发性膜性肾病(IMN)(约占MN的70%~80%)和继发性MN。继发性MN的原因包括乙肝病毒、梅毒感染、系统性红斑狼疮及肿瘤和药物毒性等。尽管MN治疗方法不断改进,仍有约40%病例进展为肾功能不全[2]。MN患者接受肾移植术后存在复发风险,移植肾出现蛋白尿、移植肾功能不全最终导致移植肾失功。
Cosyns等[3]研究发现术后3年MN复发率约29%,其中50%的复发病例在10年内进展至终末期肾病。Dabade等[4]对19例原发病为MN的患者进行常规穿刺发现,移植后MN复发率为42%(8/19),但临床症状较轻,甚至无临床症状。
抗PLA2R抗体 IMN的病因并不明确。由于没有比较可靠的预测指标,只能通过对蛋白尿的长期随访,决定IMN患者是采取免疫抑制治疗,还是保守支持治疗[5,6]。免疫抑制剂的强度和疗程,也需要根据蛋白尿的变化决定,蛋白尿不能充分反映自身免疫性疾病的活动程度。2009年Beck等[7]发现MN患者外周血中有针对M型PLA2R的抗体,这些受体只在肾小球足细胞中表达。Qin等[8]对中国60例尿蛋白定量>3.5 g/24h的IMN患者进行研究发现,49例患者抗PLA2R抗体阳性,在调整检测试剂和检测方法后,其余11例患者中有10例可检测到抗PLA2R抗体低滴度阳性。研究证明抗PLA2R抗体和足细胞上的受体结合与IMN的发生相关[9]。Hoxha等[10]通过一项多中心开放的前瞻性研究进一步证实,抗PLA2R抗体与MN的预后相关。koberne等通过实验证明含抗PLA2R抗体患者的血清能在体外影响足细胞黏附于Ⅳ型胶原,从而影响足细胞的功能[11]。
抗PLA2R抗体在肾移植术后复发性MN中的作用尚需进一步观察。Debiec等[12]对肾移植术后复发性和新发MN患者抗PLA2R抗体作用进行评估,MN复发10例患者中有5例抗PLA2R抗体阳性,但肾移植术后新发的9例MN患者抗PLA2R抗体皆阴性。一部分因MN进展至终末期肾病且肾移植时抗PLA2R抗体阳性的患者,肾移植术后MN未复发。因此有研究者认为抗PLA2R抗体不总与MN复发相关,抗PLA2R抗体阳性不是肾移植手术的禁忌[12]。Larsen等[13]的研究也得到类似结果。提示肾移植术后复发性MN和新发MN在机制上存在不同。也有研究者认为对抗PLA2R抗体滴度监测可预测肾移植术后MN的复发[14]。我们报道的该例患者原发病经活检明确为MN,术前抗PLA2R抗体阳性,术后早期滴度不变,但术后5个月患者抗PLA2R抗体转阴,此期间蛋白尿阴性(图6)。但随后患者出现蛋白尿再次复查抗PLA2R抗体时则为低滴度阳性,移植肾活检也提示MN复发。在给予利妥昔单抗治疗后,患者抗PLA2R抗体滴度与尿蛋白均下降(图7)。因此,我们这例患者其MN的复发及临床症状与抗PLA2R抗体密切相关。
利妥昔单抗 由于MN是免疫性疾病,抗PLA2R抗体的发现提示抗原抗体复合物在基膜的沉积是起病的重要原因之一。由此,研究者们自然想到应用免疫抑制阻断抗原抗体反应。而利妥昔单抗是针对表达的CD20位点的B细胞单克隆抗体,最初用于治疗非霍奇金淋巴瘤。因在造血干细胞、浆细胞和正常组织中CD20位点不表达,所以利妥昔单抗可用于选择性地清除B细胞。Ruggenenti等应用利妥昔单抗(375 mg/m2×4周)治疗8例患者,随访1年,60%的患者尿蛋白减少,且仅有轻度的不良反应[15,16],肾脏组织学指标也有改善[17]。Bomback等[18]在一篇系统性回顾中总结道,应用利妥昔单抗作为初始免疫抑制剂治疗IMN,15%~20%患者完全缓解,部分缓解率35%~40%。
Gallon等[19]报道用利妥昔单抗治疗肾移植后MN复发的1例患者(375 mg/m2×4周),患者蛋白尿、血清白蛋白及胆固醇均有明显改善。Weclawiak等[20]应用的方案为375mg/m2×4周,随后每3个月追加1剂,随访42个月,患者仍完全缓解,微量白蛋白尿107 mg/d。Stahl等[21]报道应用利妥昔单抗治疗一例肾移植术后MN复发患者(375 mg/m2,2次/2周),患者尿蛋白及抗PLA2R抗体滴度明显下降[21]。本例患者经单剂利妥昔单抗即获得良好的治疗效果,后续仍需密切观察抗PLA2R抗体滴度及尿蛋白变化情况。
小结:抗PLA2R抗体可作为预测肾移植术后MN复发、观察疗效的指标;利妥昔单抗是治疗肾移植术后移植肾复发的有效方法,本例患者经单剂利妥昔单抗治疗,抗PLA2R抗体滴度下降,尿蛋白下降,未发生不良反应。
1 Li LS,Liu ZH.Epidemiologic data of renal diseases from a single unit in China:analysis based on 13,519 renal biopsies.Kidney Int,2004,66(3):920-923.
2 Maisonneuve P,Agodoa L,Gellert R,et al.Distribution of primary renal diseases leading to end-stage renal failure in the United States,Europe,and Australia/New Zealand:results from an international comparative study.Am J Kidney Dis,2000,35(1):157-165.
3 Cosyns JP,Couchoud C,Pouteil-Noble C,et al.Recurrence of membranous nephropathy after renal transplantation:probability,outcome and risk factors.Clin Nephrol,1998,50(3):144-153.
4 Dabade TS,Grande JP,Norby SM,et al.Recurrent idiopathic membranous nephropathy after kidney transplantation:a surveillance biopsy study.Am J Transplant,2008,8(6):1318-1322.
5 Cattran DC,Pei Y,Greenwood CM,et al.Validation of a predictive model of idiopathic membranous nephropathy:its clinical and research implications.Kidney Int,1997,51(3):901-907.
6 van den Brand JA,Hofstra JM,Wetzels JF.Prognostic value of risk score and urinary markers in idiopathic membranous nephropathy.Clin J Am Soc Nephrol,2012,7(8):1242-1248.
7 Beck LH Jr,Bonegio RG,Lambeau G,et al.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy.N Engl J Med,2009,361(1):11-21.
8 Qin W,Beck LH Jr,Zeng C,et al.Anti-phospholipase A2 receptor antibody in membranous nephropathy.J Am Soc Nephrol,2011,22(6):1137-1143.
9 Beck LH Jr,Salant DJ.Membranous nephropathy:recent travels and new roads ahead.Kidney Int.,2010,77(9):765-770.
10 Hoxha E,Thiele I,Zahner G,et al.Phospholipase A2 receptor autoantibodies and clinical outcome in patients with primary membranous nephropathy.J Am Soc Nephrol,2014,25(6):1357-1366.
12 Debiec H,Martin L,Jouanneau C,et al.Autoantibodies specific for the phospholipase A2 receptor in recurrent and De Novo membranous nephropathy.Am J Transplant,2011,11(10):2144-2152.
13 Larsen CP,Walker PD.Phospholipase A2 receptor (PLA2R) staining is useful in the determination of de novo versus recurrent membranous glomerulopathy.Transplantation,2013,95(10):1259-1262.
14 Seitz-Polski B,Payré C,Ambrosetti D,et al.Prediction of membranous nephropathy recurrence after transplantation by monitoring of anti-PLA2R1 (M-type phospholipase A2 receptor) autoantibodies:a case series of 15 patients.Nephrol Dial Transplant,2014,29(12):2334-2342.
15 Remuzzi G,Chiurchiu C,Abbate M,et al.Rituximab for idiopathic membranous nephropathy.Lancet,2002,360(9337):923-924.
16 Ruggenenti P,Chiurchiu C,Brusegan V,et al.Rituximab in idiopathic membranous nephropathy:a one-year prospective study.J Am Soc Nephrol,2003,14(7):1851-1857.
17 Ruggenenti P,Cravedi P,Sghirlanzoni MC,et al.Effects of rituximab on morphofunctional abnormalities of membranous glomerulopathy.Clin J Am Soc Nephrol,2008,3(6):1652-1659.
18 Bomback AS,Derebail VK,McGregor JG,et al.Rituximab therapy for membranous nephropathy:a systematic review.Clin J Am Soc Nephrol,2009,4(4):734-744.
19 Gallon L,Chhabra D.Anti-CD20 monoclonal antibody (rituximab) for the treatment of recurrent idiopathic membranous nephropathy in a renal transplant patient.Am J Transplant,2006,6(12):3017-3021.
20 Weclawiak H,Ribes D,Guilbeau-Frugier C,et al.Relapse of membranous glomerulopathy after kidney transplantation:sustained remittance induced by rituximab.ClinNephrol,2008,69(5):373-376.
21 Stahl R,Hoxha E,Fechner K.PLA2R autoantibodies and recurrent membranous nephropathy after transplantation.N Engl J Med,2010,363(5):496-498.
(本文编辑 心 平)
Recurrent membranous nephropathy with phospholipase A2 receptor antibody
CHENGDongrui,NIXuefeng,CHENHuiping
NationalClinicalResearchCenterofKidneyDiseases,NanjingUniversitySchoolofMedicine,JinlingHospital,Nanjing210016,China
A middle-aged male was admitted for nephritic syndrome, and diagnosed membranous nephropathy(MN)by renal biopsy of native kidney as well as phospholipase A2 receptor (PLA2R) antibody positive. There was no secondary available factor. Graft biopsy-proven recurrent MN developed at 5 months post-transplant. The levels of proteiniura and serum PLA2R antibody were decreased after the treatment of rituximab.
post renal transplantation proteinuria phospholipase A2 receptor antibodies rituximab
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-03-03
