有关高中化学的离子共存问题分析
2015-06-08徐迅
徐 迅
(湖南省宁乡县第一高级中学,湖南 宁乡 410600)
许多同学在进入到高中化学课程的学习后,对于“离子共存”问题感觉不会做,也即是判断溶液中离子可否共存的相关问题。有的时候哪怕是得出答案,但是也感觉没有底气,模模糊糊。但是,众所周知的是离子共存问题是高中化学最为常见的问题,也是近些年高考的常客。文章对有关高中化学的离子共存问题进行研究和探讨,不足之处,敬请指正。
1 离子共存判断类问题失分的原因分析
对近些年高考中有关离子共存问题进行研究,发现这些问题属于中等偏易的难度,但是数据调查却发现这类题目的区分度比较大。换言之,就是题目不难,考生在这类题目上能否拿到分数具有很大的差异,导致这种情况主要是因为考生在对元素、化合物等知识内容的学习过程中,没有对知识进行系统整理,未对这类知识内容进行有序存储,再次提取、辨认时,很容易出现错误或者障碍,也有可能记得不完整,掌握的不全面,物质之间的反应规律不太清楚。
2 离子共存判断类题目的解题依据
所谓离子共存类题目,也就是几种离子在同一溶液中可以大量共存,离子之间不会产生化学反应,如果离子之间可以发生化学反应,则表示其无法大量共存。离子在溶液之间发生的反应类型包括:复分解反应、双水解反应、氧化还原反应以及络合反应等,我们在对这类问题进行判断时必须要准确判断离子之间发生什么样的化学反应,以此可以快速解决此类题目。
2.1 是否发生复分解、氧化还原反应而导致无法共存
多种离子在同一溶液中发生复分解反应,或者是氧化还原反应而导致离子无法共存,这种情况可以细分为以下情况:
(2)生成沉淀。离子体系中非常多金属阳离子只能存在于酸性溶液环境下,当遇到碱性环境,或者是遇到阴离子,则会产生化学反应而生成沉淀,离子被大量消耗。比如 Ba2+、Ca2+、Ma2+等离子无法和及大量共存;MG2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等 无 法 和 OH-大 量 共存;Pb2+和 Cl-,Fe2+和 S2-,Ca2+和,Ag+和 I-等无法大量共存。比如,在溶液中如果Ba2+和大量相遇,则二者会产生化学反应而生成BaSO4沉淀,是以同比例消耗,具体化学方程式如下所示:Ba2++=BaSO4↓,高中化学课程中有关鉴定实验,Ba2+钡离子的作用就是检验溶液中是不是包含硫离子的一种标准检验方法。
(3)生成弱电解质。生成弱电解质和生成沉淀的原理具有一致性,生成弱电解质离子也无法共存,弱电解质生成的过程离子被大量消耗,唯一区别是脱离溶液体系。比如 说等无法和 H+共存;酸式弱酸根,包括等无法和 OH-共存;OH-无法和大量共存;比如说,CH3COOK和验算HCl可否共存为例进行判断,二者均在水中能够完全电解成离子状态,然而醋酸根离子CH3COO-和氢离子遇时会发生化学反应而生成醋酸CH3COOH分子,其化学工程式为H++CH3COO-=CH3COOH,这个醋酸CH3COOH分子实际上是一个弱电解质,换言之就是反应生成的弱酸分子无法电解除和反应消耗离子数量一致的离子,导致离子数量损耗,因此二者无法大量共存。
2.2 是否发生水解和络合反应而导致无法共存
(1)水解反应。一般来说,水解程度较大的阳离子和水解程度较大的阴离子在溶液中无法大量共存,比如Al3+和等 ;Fe3+和ClO-等无法大量共存。举例说明,Al3+会在水中发生水解反应而呈现出酸性,其化学方程式为:Al3++3H20=Al(OH)3+3H+,是因为在水中会发生水解而呈现出碱性,二者共存造成酸碱中和,会导致水解反应更加剧烈,两种离子因为水解反应而被大量消耗。除此之外,也有特殊情况,比如离子尽管在同一溶液中却可以大量共存。
(2)络合反应。溶液中离子可以发生络合反应,则表示其无法大量共存。比如Fe2+、Fe3+和SCN-无法大量共存,是因为离子Fe3+和离子SCN-在溶液中发生络合反应从而结合在一起,具体化学工程式为:Fe3++nSCN-=[Fe(SCN)n]3-n,造成两种离子按照一定比例消耗。
2.3 其他条件而造成无法共存
酸碱性条件对离子共存问题的影响非常大,举例说明Fe2+和无法共存,然而在强酸性环境下,也就是Fe2+、、H+相遇则无法共存,这是由于强酸环境下,和H+发生化学反应而形成HNO3,对二价铁离子进行氧化,生成三价铁离子,使得溶液的颜色也发生变化。中性和碱性、弱酸性环境下可以共存的是、Cl-离子,强酸性条件下H+和发生化学反应生成高锰酸HMnO4,使得Cl-离子被氧化成Cl2,因此这两种离子在强酸条件下无法大量共存。
3 有关离子共存的高考常考题型
离子共存在历年化学高考试卷中成为常客,纵观近些年的高考试题,发现尽管知识点的考查方式有所变化,但是一旦理解此类题目的基本规律,解题准确性将大幅度提升。本文对有关离子共存的高考常考题型进行分类和探讨。
(1)题干中没有隐含条件,这类离子共存问题直接考查。
[例1](2000年上海)下列各组离子在溶液中可以大量共存的是( )
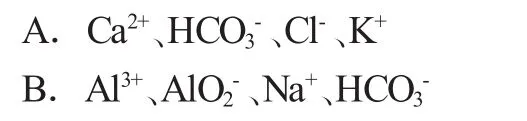

[本题解析]答案为A,分析本道题发现是直接考查离子共存的试题。按照题意得知B中Al3+和会发生双水解而无法共存;选项C中由于Fe2+会和发生化学反应而生成FeS,因此无法大量共存;选项D中Fe3+和SCN-会发生化学反应而生成Fe(SCN)3,因此无法大量共存。所以分析得知正确答案为A。
(2)题干中附加溶液表现为强酸性,或者是PH<7,考查隐含条件的离子共存问题。
[例2](2003年辽宁)强酸溶液中,下列各组离子可以大量共存的是( )

[本题解析]正确答案为C,按照题干中所得信息,强酸溶液中得知溶液中不可能有和H+氢离子发生反应的离子,因此对逐个选型进行分析即可得出正确答案。选型A中和H+氢离子会发生化学反应而生成二氧化碳;选型B中和H+氢离子以及H20会发生化学反应而生成沉淀物Al(OH)3;选型D中Fe2+会和H+氢离子及发生氧化反应;选型C中各个离子之间无法发生反应,和H+氢离子也无法发生反应,因此正确答案为C。
(3)题干中附加溶液表现出“无色透明”、“溶液酸碱性”等隐含条件,实际上需要综合考查对离子共存问题进行判断。
[例3](2002年上海)在PH=1的无色溶液中可以大量共存的离子组是( )

[本题解析]正确答案是A,对本题进行解答过程中要特别注意审题,一方面是注意PH=1,另一方面是无色溶液。选型B中OH-和选型D中AlO2-离子均无法在酸性条件下存在,因此排除B和D;选型C中Cu2+离子是有颜色的,在溶液中呈现出蓝色,因此和题干中“无色溶液”矛盾,因此排除选型C。则正确答案为A。
4 结语
总而言之,离子共存问题是高中化学离子相关知识点的重要考查方式,一方面反应学生对于离子反应的理解能力,另一方面也考查学生对于该部分知识点的掌握情况。在历年高考试题中已经得以体现,掌握离子共存这部分知识点,将对于化学反应条件的学生有所帮助,提升学生解决问题的能力。文章对有关高中化学的离子共存问题进行研究,提醒同学们在解题过程中注意溶液的酸碱性对于离子氧化还原反应会产生影响;弱酸的酸式根离子不可和H+大量共存,也无法和OH-离子大量共存,除此之外要注意对题目中隐含信息进行挖掘,同时排除一些无用的干扰信息,努力克服非智力因素而引起的失误,最后要注意题目中的敏感信息,比如“一定大量共存”、“可能大量共存”、“无法大量共存”等条件。
