超声引导和腹腔镜监视下子宫中隔切除术的手术疗效比较
2015-06-08杨淑玲
张 颖 杨 立 杨淑玲 赵 倩 谢 娅*
(1 郑州大学第一附属医院妇产科,河南 郑州450052;2 郑州大学第三附属医院妇产科,河南 郑州450052)
子宫中隔是临床最为常见的女性生殖道畸形,占子宫畸形的80%~90%[1],是引起不孕、不良孕产包括流产、早产、宫内胎儿生长受限的常见因素[2]。恢复宫腔正常形态是子宫中隔手术的目的和改善妊娠结局的前提。传统的经腹子宫成形术是经腹切开子宫,切除宫腔中隔,再予缝合,但其创伤大、恢复时间长、对以后的妊娠有影响。自1981年以来,经宫颈子宫中隔切除术(transcervical resection of septa,TCRS)以其安全、微创、易操作等显著优势逐渐得到普及并已成为治疗子宫中隔的标准术式[3]。在TCRS术中,除了要求熟练的宫腔镜操作技术,良好的监护方法是保证手术成功、减少围手术期及术后并发症的关键。临床上常用超声引导或腹腔镜监视,二者各有利弊,本文通过比较在两种监护方法下进行的TCRS手术效果,以期得到更理想的监护方式。
1 资料与方法
1.1 临床资料:选择2010年1月至2012年8月在郑州大学第一附属医院妇科内镜中心行TCRS治疗的子宫中隔患者126例作为研究对象,将其随机分为超声组(70例)和腹腔镜组(56例),本研究遵循的程序符合本院人体试验委员会所制定的伦理学标准,得到该委员会批准,分组征得受试对象本人的知情同意,并与之签署临床研究知情同意书。所有受试对象术前均经过三维超声及宫腔镜检查确诊子宫中隔并分类。两组患者临床资料具有可比性(两组患者年龄、中隔分型、孕产史差异均无显著性)(P>0.05)。见表1。所有患者均无其他合并症。

表1 两组患者临床资料分析
1.2 手术方法:所有患者均由经验丰富的医师进行手术,术前晚均阴道后穹隆放置米索前列醇400 μg。术中不全子宫中隔患者宫腔镜下针状或环状电极自隔尖横向左右交替分离或切割中隔组织至中隔基底部。完全子宫中隔自宫颈内口上方0.5 cm处切开中隔组织,使左右宫腔交通后,按不全中隔方法切除。超声组通过腹部超声实时监测电切镜的方向和切割深度,当切割端与宫底的浆膜层之间距离为1 cm、宫底厚度一致时,停止切割。腹腔镜组术中将宫腔镜置于一侧宫角隐窝时,通过腹腔镜观察到整个子宫透光均匀即停止手术。合并盆腔病变者腹腔镜下手术处理。术后所有患者宫腔均注入生物蛋白胶,并放置金属圆环预防宫腔粘连,给予雌孕激素序贯疗法(补佳乐1 mg,bid,po.×21 d,安宫黄体酮10 mg,qd,po,×5 d)3个周期,术后3个月行宫腔镜检查并取出宫内节育器。
1.3 观察指标:记录患者手术时间、术中并发症如子宫穿孔、水中毒等、首次下床时间、术后24 h NRS(numeric rating scale)值、术后住院日。术后3个月复诊,采用超声联合宫腔镜检查对子宫残留中隔进行诊断并测量。统计中隔残留(≥1 cm)的发生。术后随访6~24个月,记录其妊娠结局。记录者采用单盲法。
表2 两组手术情况比较(±s)

表2 两组手术情况比较(±s)
注:*P<0.05
组别 例数 手术时间(min) 首次下床时间(h) 术后24hNRS值 术后住院日(d)超声组 70 19.26±2.65 7.76±1.37 3.11±1.11 3.39±0.77腹腔镜组 56 48.91±6.79* 10.59±1.58* 4.55±1.09* 4.14±0.77*
1.4 统计学方法:本研究所得数据采用SPSS17.0统计学软件进行统计学分析。数据采用(±s)表示,计量资料比较采用t检验,计数资料比较采用Fisher's Exact Test或χ2检验。以P<0.05示差异有统计学意义。
2 结 果
2.1 两组患者手术情况比较:两组患者均顺利完成手术。从表2可以看出,超声组手术时间、首次下床时间、术后24hNRS值及术后住院日均明显少于腹腔镜组,差异有统计学意义(P<0.05)。
2.2 两组患者手术近远期并发症比较:两组患者均无子宫穿孔、水中毒等术中并发症及子宫破裂的发生。术后3个月复诊,超声组失访5例,无1例发生中隔残留,8例宫腔粘连(8/65)。腹腔镜组失访2例,5例发生中隔残留(5/54),残隔长度为1.0~2.3 cm,其中3例行二次TCRS。8例宫腔粘连(8/54)。两组中隔残留发生率差异有统计学意义(P<0.05),余手术近远期并发症发生率均无明显差异(P>0.05)。见表3。
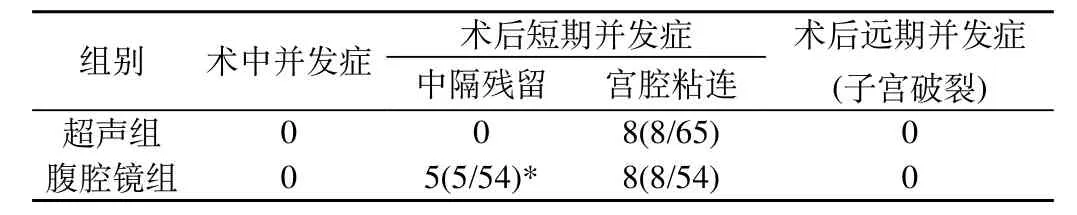
注:*P<0.05
在2年内的随诊中,超声组失访8例,妊娠44例(44/62),其中自然流产8例(8/44),早产3例(3/44),输卵管妊娠2例(2/44),足月分娩31例(31/44)。腹腔镜组失访5例,妊娠39例(39/51),其中自然流产9例(9/39),早产2例(2/39),输卵管妊娠1例,足月分娩27例(27/39)。两组的妊娠结局差异无统计学意义(P>0.05)。
3 讨 论
子宫的胚胎发生来源于苗勒管,从胚胎发育的4~6周起,双侧副中肾管开始融合,中间的隔膜吸收、退化,逐渐形成阴道和子宫。当隔膜不消失或消失不完全时就形成了程度不同的子宫中隔。子宫中隔破坏了宫腔的正常形态及体积,并造成子宫内膜腺体分化不规则从而使得孕卵着床不适或着床处蜕膜化不全,干扰了正常的生育功能,由此子宫中隔患者在临床上常常表现为不孕、反复流产及早产[4]。
手术切除子宫中隔、矫正宫腔形态是治疗子宫中隔患者最重要的手段。并非所有子宫中隔患者都需手术治疗,但对有不良孕产史及长期不孕史的中隔子宫畸形应予手术治疗[5]。宫腔镜下子宫中隔切除术(TCRS)是子宫腔的整复性微创手术[6-7],子宫中隔也是目前唯一可以单纯通过宫腔镜手术矫正的子宫畸形。TCRS有多种方法,如高频电切割分离法、机械剪除法、光纤激光分离法等。这些方法只是选用的能源不同,目的都是去除中隔组织,我国以高频电切割分离法较常用,此种方法对器械设备及手术医师熟练程度要求较高,更有赖于术中严密且指导性的监护。何时停止对中隔的切割,以避免肌层损伤引起术中并发症(如子宫穿孔)及术后并发症(如妊娠时子宫破裂),或切除不完全引起中隔残留非常重要。目前临床上常用的监护方法有超声引导和腹腔镜监护。两种监护方法各有利弊。超声可以实时监测操作的方向和宫底的厚度,增加手术的安全性。腹腔镜可以更准确的了解子宫外部轮廓,还可同时治疗盆腔病变。Fedele等认为只要术前诊断明确、术中操作终点易于确定,且患者无盆腔粘连可疑或不孕,可以不采用腹腔镜监护,选择无创、费用低的超声进行监护即可[8]。我们通过比较两种方法的临床资料,期望得到最安全、有效的监测方法。
我们从围手术期一些监测指标来看,由于超声监护的无创、操作方便,超声组的手术时间及术后首次下床时间、术后疼痛评分及住院时间明显小于腹腔镜组。由此可见,超声引导下的TCRS较腹腔镜监护更为简便、微创,且由于经济、器材要求低更容易临床推广开展。
子宫穿孔、水中毒、宫腔粘连、中隔残留、子宫破裂是TCRS相对较常见的手术并发症。从我们的研究可以看出,两组均无子宫穿孔、水中毒、子宫破裂的发生,说明两种方法均是较安全的。术后宫腔粘连的发生两组之间无明显差异,与术中监护方法无明显关系。值得一提的是,由于超声引导可以实时测量宫底的厚度,控制切割深度,超声组无1例发生中隔残留。腹腔镜监护则不能直观了解宫底的厚度,而是依赖术者的经验凭借透光试验粗略的估计,故术后有5例出现中隔残留,发生率显著高于超声组。其中3例还进行了2次TCRS。可以证明超声引导下的TCRS术后效果是优于腹腔镜监护的。
改善妊娠结局是TCRS的最终目的。从两组患者的妊娠结局来看,两组无明显差异,均大大提高了妊娠率和活产分娩率,与文献报道相似[5,9-10]。可以证实TCRS手术,无论是超声引导还是腹腔镜监护,都是对于子宫中隔疗效可靠的治疗方法。
综上所述,超声引导和腹腔镜监视下TCRS均是安全、有效的治疗子宫中隔的方法,但超声引导更简便、无创、经济、准确,对于术前检查盆腔无异常病变子宫中隔患者,我们更倾向于选择超声引导下TCRS。
[1] Kupesic S,Kurjak A,Skenderovic S,et al.Screening for uterine abnormalities by three- dimensional ultrasound improves perinatal outcome[J].J Perinat Med,2007,30(1):9-17.
[2] Sugiura-Ogasawara M,OzakiY,Katano K,et a1.Uterine anomaly and recurrent pregnancy loss[J].Semin Reprod Med,2011,29(6):514-521.
[3] Pace S,Cipriano L,Pace G,et al.Septate uterus: reproductive outcome after hysteroscopic metroplasty[J].Clin Exp Obstet Gynecol,2006,33(2):110-112.
[4] Dalkalitsis N,Korkontzelos I,Tsanadis G,et al.Unicornuate uterus and uterus didelphys indications and techniques for surgical reconstruction:a review[J].Clin Exp Obstet Gyneco,2005,30 (2/3):137-143.
[5] Roy KK,Singla S,Baruah J,et a1.Reproductive outcome following hysteroscopic septal resection in patients with infertility and recurrent abortions[J].Arch Gynecol Obstet,2011,283(2): 273-279.
[6] Saleh AM,Mahjoub MM,El-kurdy AM.Laparoscopy versus laparotomy management of tubal pregnancy[J].Saudi Med J,2001,22(9):771-775.
[7] Bangsgaard N,Lund CO,Ottesen B,et al.Improved fertelity following conservative surgical treatment of ectpic pregnency[J].BJOG,2004,111(6):635-636.
[8] Fedele L,Bianchi S,Fromino G.Septums andsynechise:approaches to surgical correction[J].Clin Obstet Gynecol,2006,49(4):767-788.
[9] Grynberg M,Gervaise A,Faivre E,et a1.Treatment of twenty-two patients with complete uterine and vaginal septum[J].J MinimInvasive Gynecol,2012,19(1):34-39.
[10] Nouri K,Ott J,Huberjc,et a1.Reproductive outcome after hysteroscopic septoplasty in patients with septate uterus:a retrospective cohort study and systematic review of the literature[J].Reprod Biol Endocrinol,2010,8(1):52-59.
