几种抗生素对蛋白核小球藻的时间毒性微板分析法
2015-06-05陈琼张瑾李小猛刘磊
陈琼,张瑾,李小猛,刘磊
安徽建筑大学环境与能源工程学院 安徽省水污染控制与废水资源化重点实验室,合肥 230601
几种抗生素对蛋白核小球藻的时间毒性微板分析法
陈琼,张瑾*,李小猛,刘磊
安徽建筑大学环境与能源工程学院 安徽省水污染控制与废水资源化重点实验室,合肥 230601
抗生素在不同的暴露时间可能具有不同的毒性变化规律。本文以蛋白核小球藻(C. pyrenoidosa)为受试生物,96孔微板为暴露实验载体,5种抗生素硫酸安普霉素、氯霉素、双氢链霉素、硫酸新霉素和硫酸链霉素为研究对象,通过在C. pyrenoidosa生长周期内选取6个暴露时间节点(即0、12、24、48、72和96 h),建立了抗生素在不同暴露时间对C. pyrenoidosa生长抑制毒性的微板测试方法(简称T-MTA),并应用T-MTA方法系统测定了5种抗生素对C. pyrenoidosa在不同暴露时间的生长抑制毒性。结果表明,抗生素对C. pyrenoidosa生长抑制毒性具有明显的时间依赖特征,即在开始的时候基本无毒性,而后毒性迅速增加,然后毒性增加速度减慢;不同抗生素的毒性随着暴露时间的延长增加速率不同;同一暴露时间内,5种抗生素对C. pyrenoidosa的毒性大小不同;且毒性顺序随着暴露时间延长而发生变化。
抗生素;蛋白核小球藻;时间依赖毒性;微板毒性分析
越来越多的研究表明,环境污染物的毒性不仅与暴露的剂量有关,暴露时间也是一个重要的因素[1]。如Zhu等[2]采用浓度-时间-效应曲面(CTES)研究发现6种三嗪类除草剂对发光菌Q67的毒性随着时间的延长而逐渐增加,但不同的毒物,其毒性增加的幅度不同。Hatano等[3]研究发现重金属对3种水生生物:三叶浮萍、虹鳟鱼和大型蚤的毒性均具有很强的时间依赖性。还有的作者发现部分污染物在不同暴露时间的浓度-效应曲线还具有不同的形状如离子液体对发光菌Q67的毒性效应随着时间的延长,由抑制发光效应逐渐转变为刺激发光效应[4-5]。这些研究表明,不同类型和不同结构的污染物可能具有不同的时间毒性规律和作用机制。因此,污染物毒性的检测不仅要关注其在某一特定时间对暴露生物的效应,更应该着眼于其对暴露生物随着时间而变化的动态效应[6]。这不仅有助于全面了解污染物的毒性效应,而且能更深入地了解污染物的毒理作用机制与途径。
绿藻作为生态系统中的初级生产者和水生食物链的基本环节,对维持生态系统的平衡起着重要作用。因其个体小、繁殖快、对毒物敏感、易于分离培养以及可直接观察细胞水平上的中毒症状,常被用于测定污染物的毒性。藻毒性测试已成为一种广泛应用的生物监测与标准方法,如国际标准化组织(ISO)[7]、经济合作与发展组织(OECD)[8]、美国环保署(USEPA)[9]以及中国国家环境保护总局均将藻类生长抑制毒性试验作为标准毒性测试方法[10]。蛋白核小球藻(C. pyrenoidosa)属于绿藻门,小球藻属,是游离单细胞藻,直径3~5 μm,球形或椭圆形,繁殖快,可以在较短时间内考察污染物对藻类世代和种群水平上的影响,便于培养和试验。此外,藻液分布均匀不易沉降,其与污染物的接触更充分。目前,C. pyrenoidosa已成为囯内外常用的污染物毒性测试的受试生物之一,如利用C. pyrenoidosa测定金属纳米颗粒物的毒性作用[11],研究十六烷基溴化铵等表面活性剂、商品氯氰菊酯农药以及药物等对C. pyrenoidosa的生长抑制效应[12-14],测试水中砷铬铅镉汞的急性毒性[15]。
然而,目前的藻毒性测试方法多采用三角玻璃瓶法,该方法的缺点:测试仪器不能同时测定大量平行样品,而且试液用量大,不仅费时、费力而且浪费试剂。因此,袁静等[16]建立了以酶标仪为检测仪器和96孔板为载体的藻毒性微板分析法,暴露时间为96 h。利用这一测试体系,研究了多个化合物及其混合物的毒性,包括重金属、农药和离子液体等化合物,获得了大量化合物的完整浓度-效应毒性信息。结果表明,藻微板毒性分析测试法具有操作简单、灵敏度高、重复性好、节省试剂及环境友好等优点。不幸的是,上述这些藻毒性测试方法只获得某一暴露时间终点如72 h或96 h的半数效应浓度EC50值,仍不能获得不同时间的污染物毒性效应变化规律。
医药品与个人护理品(pharmaceuticals and personal care products, PPCPs)由于对环境的持续污染和有害性已成为继POPs之后的又一类新型污染物[17]。抗生素由于使用量大、环境分布广泛、潜在危害大,是目前PPCPs中最为关注的一类物质[18]。研究发现,抗生素可改变环境中微生物种类,破坏生态系统的平衡[19];环境中抗生素残留的持续存在,将诱导出抗药菌株,通过食物等途径进入人体,对人类健康产生危害[20]。如Isidori等[21]研究了6种抗生素对非靶生物(水生生物)的急性、慢性和遗传毒性,发现急性毒性在mg·L-1水平,慢性毒性在μg·L-1水平,氯四环素具有遗传毒性。刘臻等[22]研究发现氯霉素、红霉素和四环素能引起热带爪蟾围心腔水肿、泄殖腔增大或拉长、肛门扩张和尾部弯曲等多种畸形现象。因此,研究抗生素类药物生态环境风险及其污染控制具有重要意义。
综上所述,本文拟以C. pyrenoidosa为受试生物,以5种抗生素硫酸安普霉素(apramycin sulfate, APR)、氯霉素(chloramphenicol, CHL)、双氢链霉素(dihydrostreptomycin sesquisulfate, DIH)、硫酸新霉素(neomycin sulfate, NEO)和硫酸链霉素(strepomycin sulfate, STS)为研究对象,建立基于C. pyrenoidosa的抗生素时间毒性微板分析法(time-dependent microplate toxicity analysis, T-MTA),并应用T-MTA系统测试5种抗生素对C. pyrenoidos的时间毒性。这不仅提供了上述5种抗生素在不同暴露时间的毒性基础数据,同时还为研究其他具有时间依赖毒性特征的污染物提供检测方法与数据分析手段。
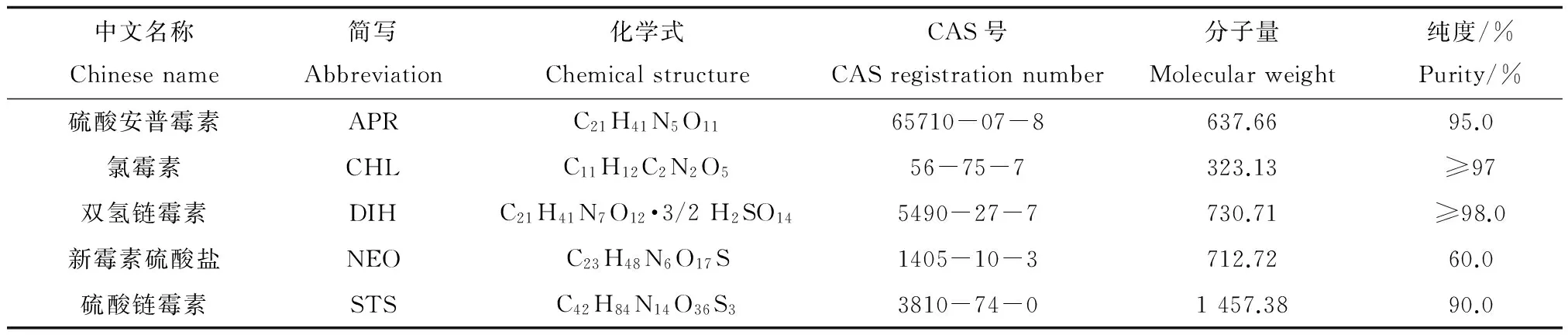
表1 5种抗生素的基本性质Table 1 Physical properties of five antibiotics
1 材料与方法(Materials and methods)
1.1 试剂与仪器
试剂:5种抗生素硫酸安普霉素(APR)、氯霉素(CHL)、双氢链霉素(DIH)、硫酸新霉素(NEO)和硫酸链霉素(STS)均购自上海原叶生物科技有限公司,其基本理化性质见表1。采用milli-Q水配制抗生素储备液,保存在棕色瓶中,置于4 ℃冰箱,备用。
主要仪器:BioRad酶标仪(美国Bio-Rad公司)、MGC-250型智能型光照培养箱(上海一恒科技有限公司)、BT25S型五位电子天平(赛多利斯科学仪器(北京)有限公司)、70SW-CJ-IF超净工作台(苏州佳宝净化工程设备有限公司)和Dragon-lab单道可调移液器(10~100 μL)(大龙兴创实验仪器有限公司)。
1.2 藻种与培养
蛋白核小球藻(C. pyrenoidosa)购自中国科学院典型培养物保藏委员会淡水藻种库(FACHB),编号为FACHB-5。
SE培养基配方:0.25 g NaNO3、0.075 g K2HPO4·3H2O、0.075 g MgSO4·7H2O、0.025 g CaC12·2H2O、0.175 g KH2PO4、0.025 g NaC1、0.05 mL FeC1·6H2O、1 mL EDTA-Fe、40 mL土壤浸出液和1 mL A5溶液。
EDTA-Fe:1 g Na2EDTA、81 mg FeC13·6H2O、50 mL 0.1 mol·L-1HC1和50 mL H2O。
A5溶液:286 mg H3BO3、181 mg MnC12·4H2O、22 mg ZnSO4·7H2O、7.9 mg CuSO4·5H2O、3.9 mg (NH4)6·Mo7O24·4H2O和100 mL H2O。
收到藻种后,稍松试管管盖,放入恒温光照振荡培养箱,于(25±1) ℃、照度5 000 lx、光暗比l4 h∶10 h条件下培养。每隔10~15 d按1∶2稀释转接藻种扩大培养,使之进入对数生长期。接种时间应在白天,藻类细胞代谢最旺盛时期(因傍晚至夜间藻类有细胞下沉现象)。整个过程要求绝对无菌操作。暴露试验前1~2 d转接处于对数生长期的藻种至新鲜培养基培养至690 nm波长下光密度(OD690)为0.2~0.3之间,备用。暴露试验中为避免挥发造成的误差,微板加上透明盖[16]。
1.3 微板设计与时间毒性测试
96孔透明微板中空白与污染物浓度梯度设计如图1所示。在96孔微板的4周共36个孔中均加入200 μL的蒸馏水防止产生边缘效应;第6,7列共12个孔(b)中分别加入100 μL milli-Q水作为空白对照;第2列6个孔(ci, i=1, 2, 3, 4, 5, 6)以及第4列共6个孔(ci, i=7, 8, 9, 10, 11, 12)分别加入按稀释因子设计的不同浓度污染物的溶液100 μL;第3和5列分别为第2列和第4列的平行试验;第8、9、10、11列为第2、3、4、5列的重复实验。最后在空白和处理孔共60个孔中分别加入密度均匀、吸光度OD690值为0.20~0.30的100 μL藻液,使各孔总体积为200 μL;加透明盖后置于温度为(25 ± 1) ℃、光照强度为5 000 lx、光暗比14 h:10 h的光照培养箱中培养,分别在暴露时间节点为0,12 h,24 h,48 h,72 h和96 h时将微板取出,并放入酶标仪中测定OD690。上述微板实验至少重复3板。
以污染物对C. pyrenoidosa的生长速率μ的抑制率(E)为毒性效应,计算不同暴露时间终点污染物的毒性:
Ei , j=(1-μi , j/μ0 , j)×100%
(1)
μj=(OD690, n-OD690, n-1)/OD690, n
(2)
式中,Ei, j为污染物浓度ci(i=1, 2, 3 ,…, 12)在暴露时间j(j=0, 12, 24, 48, 72, 96 h)对C. pyrenoidosa的生长速率抑制率;μi,j为微板中污染物浓度ci处理孔中C. pyrenoidosa在暴露时间j时的平均生长速率;μ0, j为微板空白孔中C. pyrenoidosa在暴露时间j(j=0 , 12, 24, 48, 72, 96 h)的平均生长速率;μj为微板孔中C. pyrenoidosa在某一暴露时间j(j= 0, 12, 24, 48, 72, 96 h)的平均生长速率;OD690,n为微板孔中C. pyrenoidosa在第n个暴露时间点(n=0, 1, 2, 3, 4, 5, 6)的平均吸光光度值;OD690,n-1为微板孔中C. pyrenoidosa在第n-1个暴露时间点的平均吸光光度值。

图1 时间毒性微板分析法中微板设计示意图注:b,空白;ci,第i个浓度。Fig. 1 Schematic diagram of the microplate design in a time-dependent toxicity microplate analysis where b refers to blank and ci to the concentration of the ith treatment
1.4 时间毒性数据处理
为了揭示不同暴露时间、不同浓度污染物对C. pyrenoidosa生长抑制毒性变化规律,需要对不同时间节点的浓度—效应数据进行非线性最小二乘拟合。对于浓度—效应曲线(concentration-response curve, CRC)的浓度—效应数据,采用两参数非线性函数Weibull和Logit进行拟合,选择拟合值与试验观测值之间的相关系数(correlation coefficient, R)与均方根误差(root mean square error, RMSE)评价CRC模型的拟合优度,R值越大、RMSE越小,拟合越好[23]。2个用于描述实验毒性数据的非线性函数Weibull和Logit如式(3)和(4)所示:
E=1/(1+exp(-α-βlog10(c)))
(3)
E=1-exp(-exp(α+βlog10(c)))
(4)
式中α、β是Weibull和Logit的位置与斜率参数,E为效应即污染物对绿藻C. pyrenoidosa的生长抑制率;c是污染物的浓度。
2 结果(Results)
2.1 同步生长速率曲线和测定波长选择
为了检测时间依赖毒性测试过程中C. pyrenoidosa是否处于对数生长期,我们在所有实验中,均单独设置一块96孔板同步测试C. pyrenoidosa在微孔中的生长曲线,其微板设计与时间依赖毒性测试类似:微板周边的36个微孔加入200 μL蒸馏水,在剩余60个孔中均加入体积100 μL的蒸馏水,再加入100 μL已培养好的藻液,使试液总体积达到200 μL。结果见图2(A),绿藻C. pyrenoidosa在微板中经短暂适应期后开始快速增长,36 h后C. pyrenoidosa生长速率快速增加,72 h后开始下降,96 h后几乎下降到初始生长速率,120 h后几乎不再生长。因此,时间依赖毒性实验的测试时间长度最长设置在96 h。
用1 cm比色皿、在波长350~850 nm范围内、按步长1 nm测定C. pyrenoidosa的紫外一可见吸收光谱图谱,结果见图2(B)。由图2(B)可见,在波长为446、504和690 nm处存在吸收峰,其中690 nm吸收峰最尖,光谱干扰较少,因此,绿藻C. pyrenoidosa的光密度OD值的测定选择690 nm波长处的吸收峰。
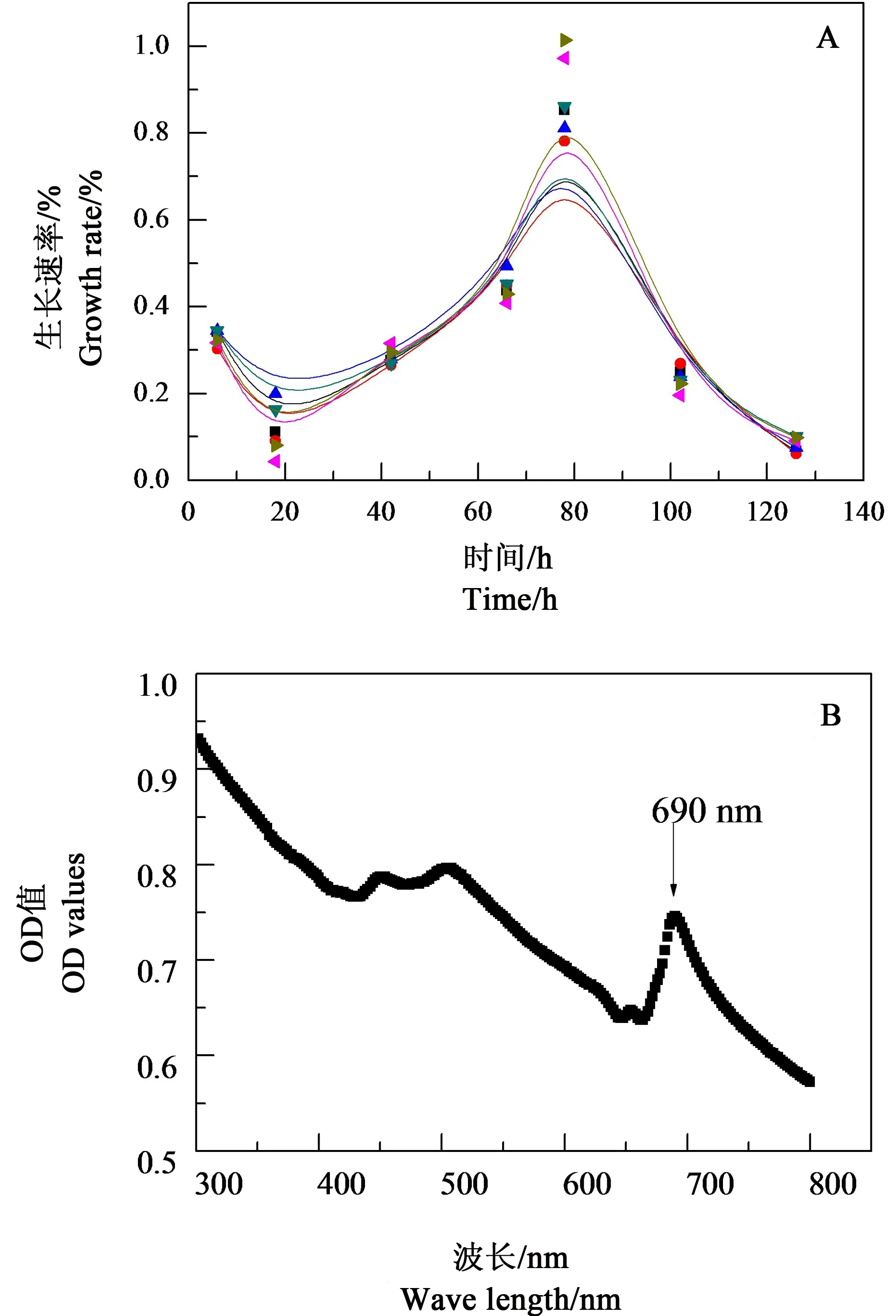
图2 C. pyrenoidosa的生长特性Fig. 2 Growth characteristic of Chlorella pyrenoidosa
2.2 浓度-效应曲线CRC
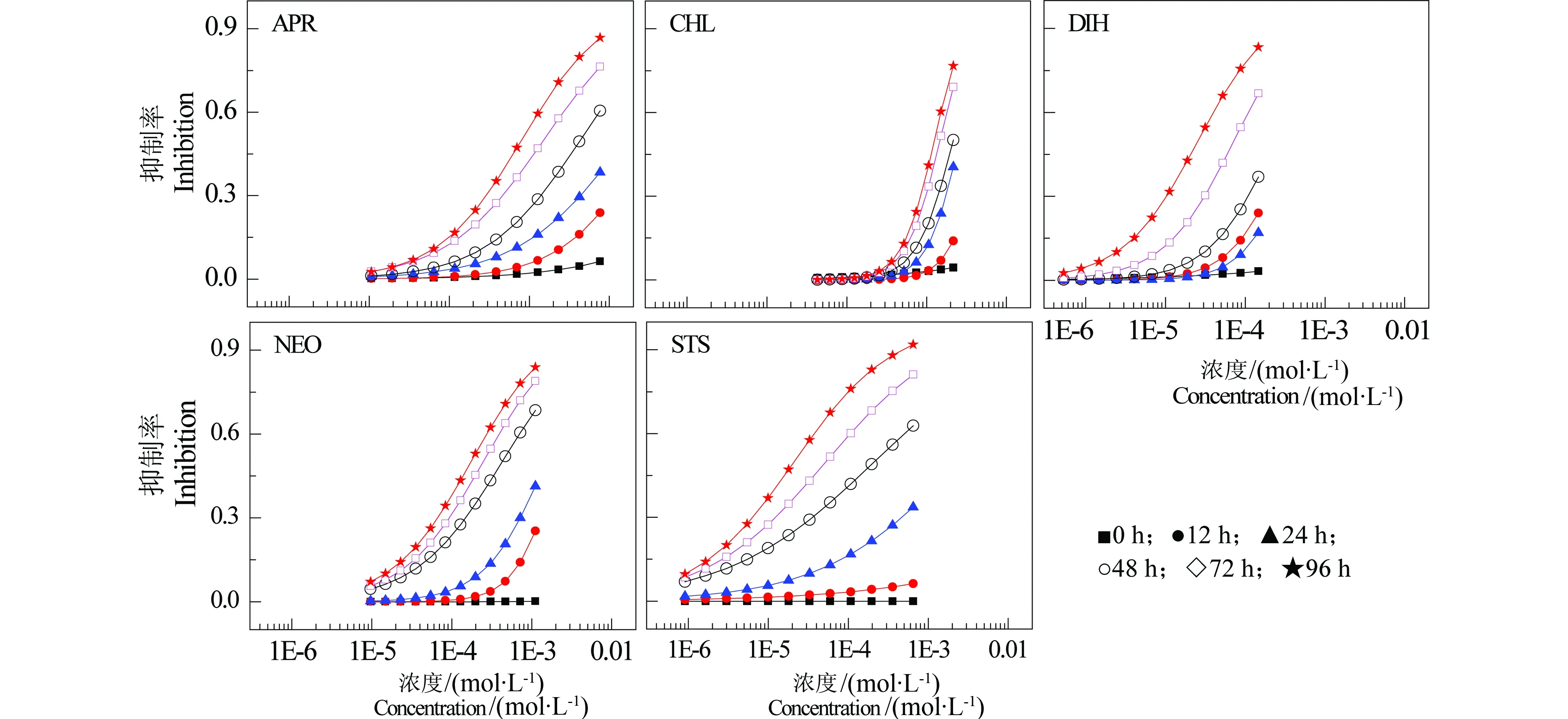
由时间毒性微板分析法测得的5种抗生素在不同暴露时间节点的浓度-效应数据(点)以及通过非线性最小二乘拟合方法得到的统计量与回归系数(位置参数α和斜率参数β)结果见表2,并将拟合所得的CRC曲线绘于图3。
从表2可看出,Logit函数对暴露时间在48~96 h的毒性数据拟合的结果较好(R>0.91, RMSE<0.1),但对暴露时间节点为24 h的浓度-效应数据拟合效果稍差,如CHL的浓度-效应数据的R值为0.6307,对0和12 h的浓度-效应数据不能有效拟合,可能因为在暴露时间24 h以内,藻的生长处于延迟期,数据不稳定造成的,也可能是拟合函数不太合适。以半数效应浓度(EC50)的负对数pEC50为毒性指标,5种抗生素的毒性均随着暴露时间的延长而在逐渐增强即具有典型的时间依赖特征。但不同抗生素在同一暴露时间的毒性不同,且毒性大小顺序随着时间延长而变化,如在暴露时间节点24 h时,5种抗生素的毒性大小顺序:CHL 表2 5种抗生素在6个时间点的拟合函数(Logit函数的α和β)、拟合统计量(R和RMSE)以及EC50和pEC50值Table 2 The regression parameters (α and β of Logit function), two statistics (R and RMSE), EC50 and pEC50 of five antibiotics at six time points 图3 5种抗生素在6个时间节点的浓度-效应曲线Fig. 3 Concentration-response curves of five antibiotics at six time points 图4 5种抗生素毒性随时间的变化曲线Fig. 4 Plot of pECx versus time for five antibiotics 图3也显示5种抗生素均表现出明显的时间依赖毒性特征:在0~24 h,5种抗生素对C. pyrenoidosa基本无毒性,然后随着暴露时间的延长,毒性逐渐增加,在24~48 h内毒性增加速度最快,此后毒性增加速度逐渐减慢。 环境污染物的毒性不仅与暴露的剂量有关,暴露时间也是一个重要的因素。已有研究表明污染物对发光菌Q67的毒性具有时间依赖特征[24-26]。本文中5种抗生素对绿藻C. pyrenoidosa的毒性也具有明显的时间依赖特征。为了进一步说明5种抗生素对C. pyrenoidosa的毒性具有明显的时间依赖特征,我们将每种药物的4个典型pECx值:pEC20、pEC30、pEC40和pEC50随着时间变化趋势绘成图4。如图4所示,5种抗生素的毒性值pEC20、pEC30、pEC40和pEC50均随着时间的延长而增加,但不同的抗生素增加规律不同。如APR、CHL和NEO的pEC20与pEC30值在0~12内几乎为0,在12~24 h内毒性迅速增加,然后增加速度减慢,而pEC40和pEC50值在0~24 h内几乎为0,在24~48 h内迅速增加,然后增加速度减慢。但是,CHL的4个毒性值pEC20、pEC30、pEC40和pEC50之间的差异较小。STS的pEC20值在0~12 h内几乎为0,在12~24 h内迅速增加,然后增加速度减慢,而pEC30、pEC40和pEC50值在0~24 h内几乎为0,在24~48 h内迅速增加,然后增加速度减慢。DIH的pEC20与pEC30值在0~24 h内几乎为0,在24~48 h内迅速增加,然后增加速度减慢,而pEC40和pEC50值在0~48 h内几乎为0,在48~72 h内迅速增加,然后增加速度减慢。这与林楠等所获的研究结论类似[24]。 上述研究结果显示,污染物的毒性大小及其变化规律也会随暴露时间延长出现变化,这就要求我们在进行污染物生态毒性评价时应进行实时分析,同时考虑浓度与时间2个因素,才能全面了解污染物的毒性效应,更深入的了解污染物的毒性作用机制与途径,更能体现实际环境中污染物暴露的现象和信息,同时提高生态风险评估的可信性[6]。 本文建立了不同暴露时间下污染物对绿藻C. pyrenoidosa的生长抑制毒性的微板测试分析方法,并成功地应用于环境中普遍存在的5种抗生素APR、STS、DIH、NEO和CHL对C. pyrenoidosa的时间依赖毒性测试。5种抗生素对绿藻C. pyrenoidosa的毒性均随着时间的延长而增加:在开始的24 h内基本无毒性,然后随着时间的延长,毒性迅速增加,而后毒性增加的速度逐渐减慢。5种抗生素对C. pyrenoidosa在同一暴露时间的毒性大小不同。且在不同的暴露时间节点,5种抗生素的毒性顺序也不同。以半数效应浓度(EC50)的负对数pEC50为毒性指标,在24 h暴露时间节点的毒性顺序:CHL [1] Yu M, Liu S S, Wang M C, et al. Mixture toxicities of three pesticides having different time- toxicity profiles [J]. Chinese Journal of Chemistry, 2014, 32(6): 545-552 [2] Zhu X W, Liu S S, Ge H L, et al. Comparison between the short-term and the long-term toxicity of six triazine herbicides on photobacteria Q67 [J]. Water Research, 2009, 43(6): 1731-1739 [3] Hatano A, Shoji R. A new model for predicting time course toxicity of heavy metals based on Biotic Ligand Model (BLM) [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2010, 151(1): 25-32 [4] Wang L J, Liu S S, Yuan J, et al. Remarkable hormesis induced by 1-ethyl-3-methyl imidazolium tetrafluoroborate on Vibrio qinghaiensis sp.-Q67 [J]. Chemosphere, 2011, 84(10): 1440-1445 [5] Zhang J, Liu S S, Yu Z Y, et al. Time-dependent hormetic effects of 1-alkyl-3-methylimidazolium bromide on Vibrio qinghaiensis sp.-Q67: Luminescence, redox reactants and antioxidases [J]. Chemosphere, 2013, 91(4): 462-467 [6] Newman M C, McCloskey J T. Time-to-event analyses of ecotoxicity data [J]. Ecotoxicology, 1996, 5(3): 187-196 [7] International Organization for Standardization. ISO8692-2012: Water quality-Fresh water algal growth inhibition test with unicellular green algae [S]. Genève: International Organization for Standardization, 2012 [8] OECD. Guidelines for the testing of chemicals, freshwater alga and cyanobacteria, growth inhibition test [S]. Paris: Economic Co-Operation and Development, 2004 [9] US EPA. Ecological Effects Test Guidelines OPPTS 850.5400, Algal Toxicity, Tiers I and II [S]. United States Environmental Protection Agency, 1996 [10] 国家标准化管理委员会. 21805—2008 G T. 化学品藻类生长抑制试验[S]. 北京: 中国标准出版社, 2008 [11] 汪静, 刘娅琛, 曲冰, 等. 金属纳米颗粒对蛋白核小球藻生长活性的影响[J]. 大连海洋大学学报, 2011, 26(5): 386-390 Wang J, Liu Y S, Qu B, et al. The effect of the metal nanoparticles (Fe/Ni) on growth in alga Chlorella pyrenoidosa [J]. Journal of Dalian Ocean University, 2011, 26(5): 386-390 (in Chinese) [12] 郑香娇, 周作明. 十六烷基三甲基溴化铵对蛋白核小球藻的毒性效应[J]. 湖南农业大学学报, 2012, 38(1): 27-31, 68 Zheng X J, Zhou Z M. Toxic effects of the cetyltrimethylammonium bromide on Chlorella pyrenoidosa [J]. Journal of Hunan Agricultural University: Natural Sciences, 2012, 38(1): 27-31, 68 (in Chinese) [13] 王朝晖, 谢骏, 姜珊, 等. 商品氯氰菊酯农药对蛋白核小球藻的毒性效应研究[J]. 环境科学学报, 2012, 32(5): 1192-1198 Wang Z H, Xie J, Jiang S, et al. Toxicological effects of commercial cypermethrin on Chlorella pyrenoidosa [J]. Acta Scientiae Circumstantiae, 2012, 32(5): 1192-1198 (in Chinese) [14] 聂湘平, 鹿金雁, 李潇, 等. 诺氟沙星(norfloxacin)对蛋白核小球藻(Chlorella pyrenoidosa)生长及抗氧化酶活性的影响[J]. 生态毒理学报, 2007, 2(3): 327-332 Nie X P, Lu J Y, Li X, et al. Toxic effects of norfloxacin on the growth and the activity of antioxidase of Chlorella pyrenoidosa [J]. Asian Journal of Ecotoxicology, 2007, 2(3): 327-332 (in Chinese) [15] 周世明, 赵清, 舒为群. 青海弧菌Q67新鲜培养菌液测试水中砷铬铅镉汞的急性毒性[J]. 预防医学情报杂志, 2008, 24(6): 403-406 Zhou S M, Zhao Q, Shu W Q. Use freshly prepared Vibrio qinghaiensis sp-Q67 suspension to detect acute toxicity of metal chemicals in water [J]. Journal of Preventive Medicine Information, 2008, 24(6): 403-406 (in Chinese) [16] 袁静, 刘树深, 王丽娟, 等. 蛋白核小球藻(Chlorella pyrenoidosa)微板毒性分析方法优化[J]. 环境科学研究, 2011, 24(5): 553-558 Yuan J, Liu S S, Wang L J, et al. Optimization of microplate toxicity analysis method based on Chlorella pyrenoidose [J]. Research of Environmental Science, 2011, 24(5): 553-558 (in Chinese) [17] 安婧, 周启星. 药品及个人护理用品(PPCPs)的污染来源、环境残留及生态毒性[J]. 生态学杂志, 2009, 28(9): 1878-1890 An J, Zhou Q X. Pollution sources, environmental residues, and ecological toxicity of pharmaceuticals and personal care products (PPCPs): A review [J]. Chinese Journal of Ecology, 2009, 28(9): 1878-1890 (in Chinese) [18] Gonzalez-Pleiter M, Gonzalo S, Rodea-Palomares I, et al. Toxicity of five antibiotics and their mixtures towards photosynthetic aquatic organisms: Implications for environmental risk assessment [J]. Water Research, 2013, 47(6): 2050-2064 [19] Costanzo S D, Murby J, Bates J. Ecosystem response to antibiotics entering the aquatic environment [J]. Marine Pollution Bulletin, 2005, 51(1): 218-223 [20] Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: A review of recent research data [J]. Toxicology Letters, 2002, 131(1-2): 5-17 [21] Isidori M, Lavorgna M, Nardelli A,et al. Toxic and genotoxic evaluation of six antibiotics on non-target organisms [J]. Science of the Total Environment, 2005, 346(1-3): 87-98 [22] 刘臻, 施华宏, 黄宏, 等. 3种抗生素对热带爪蟾胚胎发育的毒性影响[J]. 安全与环境学报, 2011, 11(5): 1-6 Liu Z, Shi H H, Huang H, et al. Study on the effects of chloramphenicol erythromycin and tetracycline on the growing Xenopus tropicalis embryos [J]. Journal of Safety and Environment, 2011, 11(5): 1-6 (in Chinese) [23] 刘树深, 张瑾, 张亚辉, 等. APTox: 化学混合物毒性评估与预测[J]. 化学学报, 2012, 70(14): 1511-1517 Liu S S, Zhang J, Zhang Y H, et al. APTox: Assessment and prediction on toxicity of chemical mixtures [J]. Acta Chimica Sinica, 2012, 70(14): 1511-1517 (in Chinese) [24] 林楠, 张晶, 刘树深. 污染物对青海弧菌Q67的时间依赖微板毒性分析[J/OL]. 中国科技论文在线精品论文, 2013, 6(24): 2321-2328 Lin N, Zhang J, Liu S S. Time-dependent microplate toxicity analysis (T-MTA) of pollutant to Vibrio qinghaiensis sp. Q67 [J/OL]. Science Paper Online, 2013, 6(24): 2321-2328 (in Chinese) [25] 王猛超, 刘树深, 陈浮. 拓展浓度加和模型预测三种三嗪类除草剂混合物的时间依赖毒性[J]. 化学学报, 2013, 72(1): 56-60 Wang M C, Liu S S, Chen F. Application of concentration addition into predicting the time-dependent toxicities of herbicide mixtures to Vibro qinghaiensis sp. Q67 [J]. Acta Chimica Sinica, 2013, 72(1): 56-60 (in Chinese) ◆ Time-dependent Microplate Toxicity Analysis (T-MTA) of Several Antibiotics toChlorellapyrenoidosa Chen Qiong, Zhang Jin*, Li Xiaomeng, Liu Lei Key Laboratory of Water Pollution Control and Wastewater Resource of Anhui Province, College of Environment and Energy Engineering, Anhui Jianzhu University, Hefei 230601, China 30 June 2014 accepted 14 August 2014 Antibiotics probably have different toxicity features in different exposure times. Selecting Chlorella pyrenoidosa (C. pyrenoidosa) as a test organism, 96-well microplate as exposure experiment carrier and five antibiotics, apramycin sulfate, chloramphenicol, dihydrostreptomycin sesquisulfate, neomycin sulfate and strepomycin sulfate, as test chemicals, a time-dependent microplate toxicity analysis (T-MTA) was developed. Using the T-MTA, the time-dependent toxicities of the five antibiotics on C. pyrenoidosa were determined at six exposure time points such as 0, 12, 24, 48, 72 and 96 h. The results showed that the toxicities of the antibiotics exhibited significant time-dependent features, i.e., they had almost no toxicities on C. pyrenoidosa at first, then their toxicities increased rapidly, and finally increased slowly. However, the antibiotics had different increasing rates for the time-dependent toxicities. The toxicities of five antibiotics were different at the same exposure time. Moreover, the orders of toxicity of the antibiotics at different exposure times were different. antibiotics; Chlorella pyrenoidosa; time-dependent toxicity; microplate toxicity analysis 国家自然科学基金(21207002);博士科研启动基金;大学生科技创新性实验(201310878060;AH201310878107) 陈琼(1988-),男,硕士,研究方向为污染物化学与毒理学,E-mail: 13093549315@163.com; *通讯作者(Corresponding author), E-mail: ginnzy@163.com 10.7524/AJE.1673-5897.20140630004 2014-06-30 录用日期:2014-08-14 1673-5897(2015)2-190-08 X13 A 张瑾(1978—),女,博士,副教授,近年主要从事有机污染物化学与毒理学研究,发表学术论文30余篇。 陈琼, 张瑾, 李小猛, 等. 几种抗生素对蛋白核小球藻的时间毒性微板分析法[J]. 生态毒理学报, 2015, 10(2): 190-197 Chen Q, Zhang J, Li X M, et al. Time-dependent microplate toxicity analysis (T-MTA) of several antibiotics to Chlorella pyrenoidosa [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 190-197 (in Chinese)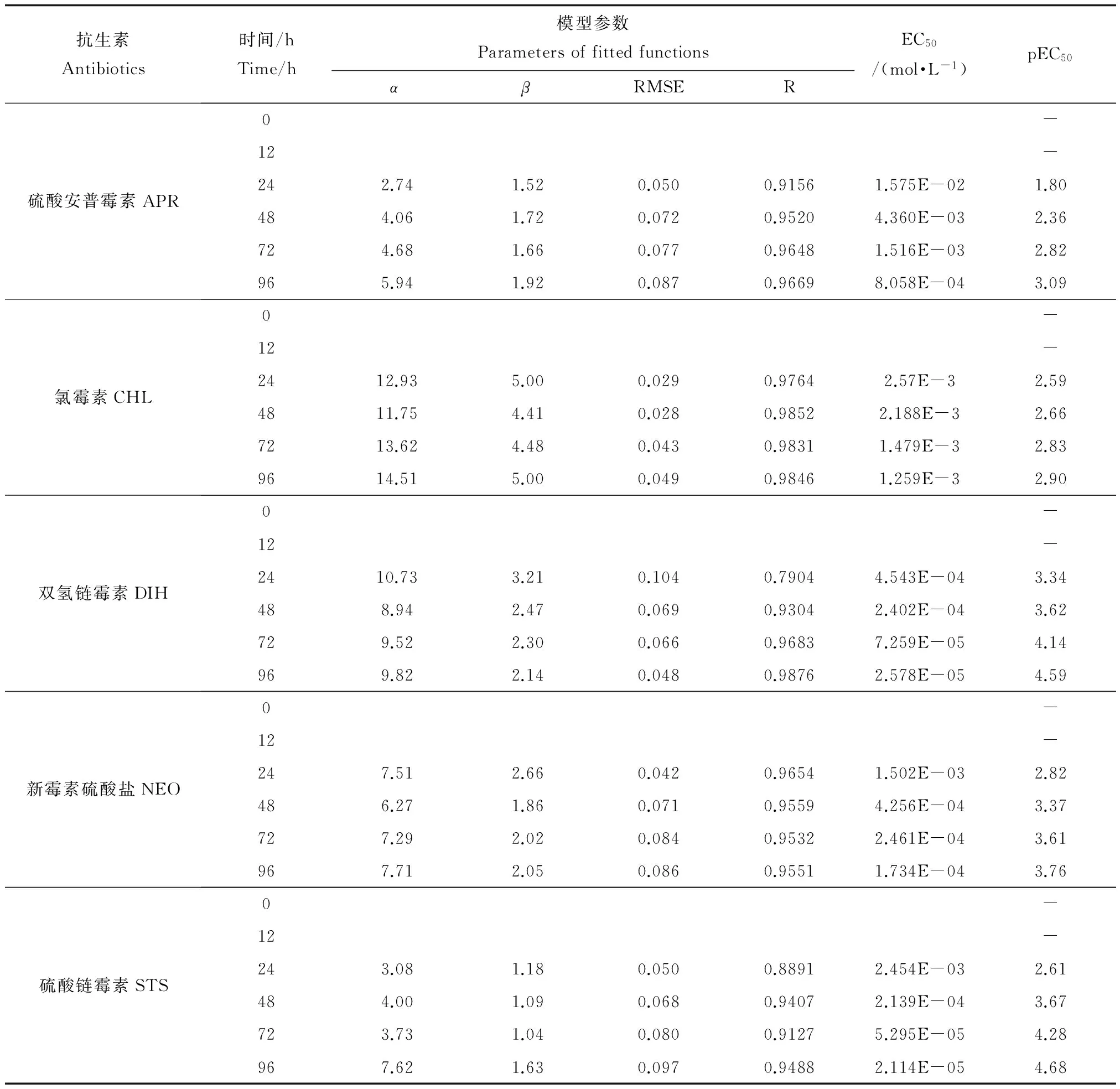

3 讨论(Discussion)
