抗生素对微生物的联合与低剂量毒性研究进展
2015-06-05方淑霞王大力朱丽华石恬恬秦孟楠林志芬
方淑霞,王大力,朱丽华,石恬恬,秦孟楠,林志芬,*
1. 同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室,上海200092 2. 华中科技大学化学与化工学院,武汉430074
抗生素对微生物的联合与低剂量毒性研究进展
方淑霞1,王大力1,朱丽华2,石恬恬1,秦孟楠1,林志芬1,*
1. 同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室,上海200092 2. 华中科技大学化学与化工学院,武汉430074
目前抗生素已成为一类不可忽视的环境污染物,它在环境中呈“混合-持久-低剂量”的暴露特征。因此,研究抗生素毒性效应,特别是它的联合毒性以及低剂量下毒性兴奋效应,对抗生素污染物生态风险的评价极其重要。以抗生素联合毒性的研究进展为主线,重点概述了抗生素二元混合物的急性和慢性联合毒性研究,指出了抗生素混合物间存在相互作用,它们的联合毒性并非表现为简单的加和或独立效应,且抗生素急性-慢性联合表现出的毒性效应也存在差异;发现了不仅单一抗生素具有Hormesis效应,低剂量抗生素二元混合物也具有Hormesis作用。但目前低剂量抗生素二元混合物对微生物的毒性兴奋效应研究较少,其毒性兴奋效应的预测和评价还有待进一步完善,以期为环境中抗生素的联合生态研究和风险评价提供理论依据。
抗生素;微生物;联合毒性;兴奋效应
抗生素自发现以来,被大量用于人类医疗保健、动物养殖和农业生产中,具有种类多、应用范围广的特点。目前,全世界每年抗生素的消费量达20多万t[1]。而我国是抗生素的最大生产国和消费国,抗生素年使用量已达世界抗生素年使用量的25%[2]。因此,抗生素在我国已成为一类不可忽视的环境污染物,研究抗生素毒性效应及其生态风险评价极为重要。
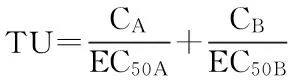
抗生素是一种拟持久性污染物[4,6-7]。虽然抗生素进入环境后会经过一系列转化过程,包括吸附-解吸[8]、迁移[3]、降解[7]等环境方式,但是由于抗生素随粪便和尿液的大量排入,抗生素及其代谢产物仍然大量残留[9]。若仅开展急性毒性试验会低估实际环境中抗生素长期作用所带来的生态毒性效应和环境风险[10]。Thomulka等[11]测定了4种抗生素对哈维氏弧菌(Vibrio harveyi)的发光抑制毒性,结果发现,抗生素作用30 min没有表现出发光抑制效应,但随着作用时间的延长,4种抗生素在低剂量下都表现出了毒性效应。磺胺噻唑对大型溞(Daphnia magna)的毒性结果也表明,其48 h所表现出的毒性是24 h的4倍[12]。显然,抗生素急性-慢性联合毒性存在差异。因此开展更接近环境实际体系的慢性毒性研究,可以更客观、全面地评价污染物对环境和生态的潜在威胁,更有效地保护人类健康和生态安全。
抗生素在环境中低剂量残留。Kolpin[13]监测了美国30个州内139条河流中农药、医药、兽药、激素等95种有机污染物,其中抗生素浓度大多在μg·L-1级,Zhang等[14]测定了多家医院废水中抗生素污染物,发现21种抗生素浓度均介于5.9~11.8 μg·L-1,Jiang等[15]测定了黄浦江沿岸抗生素暴露浓度均介于36.71~313.44 ng·L-1。可见,抗生素在环境中多呈低剂量暴露。美国毒理学家Calabrese认为很多化合物在低剂量下将呈现出刺激作用,又称之为兴奋效应(Hormesis)。这种作用与高剂量下的抑制作用不同。有研究发现,一些抗肿瘤药物(如苏拉明)在高剂量下抑制细胞增殖而具有临床疗效,但在低剂量条件下却可以促进细胞增殖而成为一种局部激动剂[16]。因此,与所有其他化合物一样,回答低剂量抗生素对环境微生物是否存在、为什么会存在Hormesis效应,也是目前环境科学领域关注问题之一[15]。
总之,抗生素在环境中往往呈现出混合、持久、低剂量的三大暴露特征,需要我们开展联合急性、联合慢性以及Hormesis效应等相关研究,但是之前的有关研究往往集中在抗生素对单一生物的急性(高剂量)毒性方面[16]。因此,为了促进抗生素生物的联合与低剂量毒性研究进展,以课题组的前期研究成果为基础,本文从抗生素的混合、持久、低剂量三大暴露特征出发,分别综述了近年来抗生素对微生物的急性联合毒性和慢性联合毒性,以及低剂量抗生素的联合Hormesis效应的研究,并展望了今后的研究思路,以期为环境中抗生素的联合生态风险评价和修复提供一些指导。
1 抗生素二元混合物对急性联合毒性研究(Acute toxicity of binary mixtures for antibioticsexposure on microorganisms)
现实环境中抗生素往往都以混合形式存在[6]。目前,研究人员已在大量地表水、污水处理厂、医院废水等地方同时检测到多类抗生素污染物。Zou等[17]在汇入渤海湾的6条主要河流中同时检测到磺胺类、四环素类、大环内酯类等抗生素。Xu等[18]在污水处理厂的进出水中发现氧氟沙星、罗红霉素、和磺胺甲恶唑等多种抗生素共存。另有研究发现,瑞典医院废水中也同时监测到氟喹诺酮、磺胺甲恶唑、甲氧苄啶等多种抗生素[19]。
现实环境中抗生素与混合物间也总表现出与单一化合物不同的毒性作用。Soto-Rodríguez等[20]研究了喹诺酮类抗生素对费氏弧菌(Vibrio fischeri)的单一毒性和联合毒性,结果显示将10种抗生素按各自的无效应浓度进行混合后会表现出99%发光抑制率的毒性效应。抗生素混合物间往往存在一定的联合作用[17]。Ren等[21]研究二元组合抗生素对发光细菌的急性联合毒性,发现吉他霉素与盐酸金霉素、吉他霉素与盐霉素、吉他霉素与黄霉素组合表现出较强的协同作用,其TU*值分别为0.56、0.46、0.47;而盐霉素与盐酸金霉素、盐霉素与黄霉素组合表现为轻微的拮抗作用,其TU值分别为1.25和1.23。另有研究发现,四环素类抗生素和氯霉素类抗生素对明亮发光杆菌(Photobacterium phosphoreum)的联合急性(15 min)毒性均表现出拮抗作用,其TU15m介于1.21~4.45之间[22]。此外,抗生素与其他类型化合物共存也有同样的特性。An等[23]研究了磺胺类抗生素分别与呋喃酮类、吡咯酮类、吡咯类等群体感应抑制剂对费氏弧菌(Vibrio fischeri)的急性(15 min)联合毒性,发现磺胺类抗生素(SAs)与呋喃酮类的联合效应为协同作用、与吡咯酮类为相加作用、与吡咯类为拮抗作用。
2 抗生素二元混合物对慢性联合毒性研究(Chronic toxicity of binary mixtures for antibioticsexposure on microorganisms)
随着混合污染物联合毒性研究的不断深入,加之环境现实体系中的抗生素污染物具有混合且持久性暴露特征,部分学者对抗生素混合污染物的毒性研究已从急性联合毒性逐步转向更为接近环境现实体系的慢性联合毒性[24]。研究表明,与急性联合毒性相似,当抗生素混合污染物持久作用于环境微生物时,它们的联合毒性并非仅仅表现为简单的加和或独立效应。Yang等[25]研究了12种抗生素对淡水绿藻(Pseudokirchneriella subcapitata)的慢性联合毒性,发现不同抗生素之间的联合作用是不同的。比如磺胺类抗生素之间表现出相加作用,而四环素类与四环素类、大环内酯类与大环内酯类、氟喹诺酮与氟喹诺酮的联合均呈协同作用。也有研究发现结构相似的四环素和金霉素对羊角月牙藻(Selenastrum capricornutum)的慢性联合毒性表现为相加作用,而四环素和7-氨基头孢霉烷酸结构差异较大且可能存在不同的毒性位点和作用方式,因而它们的慢性联合毒性表现为拮抗作用[26]。
抗生素和其他类型化合物长期混合暴露也会产生不同的联合作用。Sun等[27]把金霉素与重金属铜(Ⅱ)联合作用于产甲烷菌,发现15 d积累的甲烷产量明显低于各组分产量之和,即其联合毒性表现出拮抗作用。此外,Li等[28]把阿莫西林与纳米银混合作用于大肠杆菌(Escherichia coli),24 h后发现纳米银与阿莫西林的混合作用使大肠杆菌的抗菌作用大幅度提高,其联合毒性表现出明显的协同作用。另有研究认为,SAs与磺胺增效剂(TMP)联合使用会使羊角月牙藻(Selenastrum capricornutum)的叶酸代谢受到双重阻断,严重抑制细胞生长,所以SAs-TMP对羊角月牙藻慢性联合毒性表现出协同作用[29]。
虽然抗生素的慢性联合与急性联合毒性都存在着相互作用,但是它们表现出的联合毒性效应却往往不相同。Zou等[4]测定了SAs与TMP对明亮发光杆菌(Photobacterium phosphoreum)的联合毒性作用,发现急性联合毒性测试体系中SAs-TMP呈拮抗效应,而慢性联合毒性测试体系中SAs-TMP呈协同效应。同时,他们根据所测的不同急-慢性联合毒性效应,进一步构建磺胺类抗生素及其增效剂混合物体系对明亮发光杆菌的急性联合效应模型(方程1)和慢性联合效应模型(方程2):
(1)
n= 7, R2=0.954, SE=0.028, F=20.659, P=0.017
(2)
n= 7, R2=0.965, SE=0.107, F=27.552, P=0.011.
根据方程1和2的比较结果,他们发现:(1)在急性联合毒性中磺胺类化合物对于发光菌受体蛋白是荧光素酶(Luc),而在慢性联合毒性中其受体蛋白则是二氢叶酸合成酶(Dhps)。(2)由各受体结合能前的拟合系数并不一致,可知急性联合毒性中SA-Luc结合能力与慢性联合毒性中SA-Dhps的结合能力有所差异。可见,受体蛋白的差异和受体蛋白结合能力的差异是导致SAs-TMP急性-慢性联合差异的重要因素。
3 低剂量抗生素混合兴奋效应研究(Hormeisis oflow dose antibiotics to microorganisms)
由于抗生素及其混合污染物在水、土环境中暴露浓度较低[30-31],所以研究者对抗生素的研究也开始逐渐由传统的高剂量研究转向机制相关的低剂量研究[32]。研究表明,现阶段使用的大多抗生素及大量的其他药物都表现出Hormesis效应的双相剂量反应[33],如Migliore等[34]发现四环素对大肠杆菌(Escherichia coli)具有低浓度(0.015~0.03 μg·mL-1)促进和高浓度(4 μg·mL-1)抑制现象。Gao等[26]研究发现低浓度的7-氨基头孢霉烷酸促进羊角月牙藻(Selenastrum capricornutum)的生长,且在浓度为120 g·mL-1时促进率最高,达22.6%。Deng等[33]研究发现6种SAs对明亮发光杆菌(Photobacterium phosphoreum)的单一慢性毒性(24 h)均表现出明显的Hormesis现象,最大刺激在180%到210%之间。
近年来,低剂量混合污染物Hormesis已有报道,包括重金属、多氯联苯、持久性污染物等[35-37]。抗生素因其典型的易混合、剂量低特征,其低剂量下二元混合物毒性效应也已经引起了人们的关注。如Zou等[38]研究低剂量SAs及TMP对费氏弧菌(Vibrio fischeri)联合作用,发现5个二元混合体系均呈现出毒性兴奋效应,其最大刺激程度均大于40%。可见,不仅单一抗生素具有Hormesis效应,混合抗生素也具有Hormesis作用。但目前低剂量抗生素混合物对微生物的毒性兴奋效应研究较少,特别是联合Hormesis效应预测方法进展较为缓慢。虽然近年来浓度加和模型(concentration addition, CA)和独立作用(independent action, IA)模型已逐步应用到混合污染物联合毒性Hormesis的研究中,如Ge等[39]的研究表明离子液体混合物对发光菌的毒性兴奋效应可通过CA模型来预测;但是,我们前期研究发现[38],对于混合抗生素的联合Hormesis效应,尚无法通过CA或IA模型来预测,这是因为低剂量抗生素的联合毒性不仅存在着相加,还存在着协同和拮抗等作用。因此,近期我们提出了“六点法”这一新的混合Hormesis预测方法:1)选择了Hormesis曲线上具有代表性的六个点(如图1):A (EC50, 50),B (EC90, 90),C(M,Ymax),D(ZEP,0),E(NEC, 0)和F((1/2)×ZEP, Yh-ZEP))。

图1 典型剂量-毒性兴奋效应曲线及其“六点”注:NEC表示无效应浓度,ZEP表示零效应浓度,M表示最大促 进效应程度对应的污染物剂量,Ymax表示最大促进效应程度。Fig. 1 Six points in the hormetic dose response curveNote: NEC is no effect concentration, ZEP is the concentration of zero equivalence point, M is the concentration of maximal stimulatory effect, Ymax is the maximal stimulatory effect
根据曲线特征和定量结构-活性相关(QSAR)模型,我们提出了这6个点的预测方程并进一步通过预测出的6个点获取Hormesis曲线,结果发现,所获得的曲线与实际实验的Hormesis曲线有很好的一致性。
现阶段,虽然很多化合物的兴奋效应现象已被各种实验证实存在,但并没有一个单一的机制能解释普遍发生的Hormesis效应,较为人们所认同的理论主要有受体机制假说和过度补偿理论。受体机制假说[40]认为激动剂与不同亲和力和容力的2种受体亚型的结合差异导致了刺激和抑制2种相反的效应。过度补偿理论[41]认为生物体受到刺激,在最初的抑制反应之后会出现一个补偿过程,这个补偿行为会逐渐超过控制行为,从而导致一个净刺激效应。然而以上2种解释也并不是所有学者都接受,不少学者甚至是Hormesis的支持者亦对上述Hormesis机制表示怀疑[42]。目前,有关低剂量抗生素兴奋效应形成机制尚未开展系统研究。前期的初步研究发现[33],SAs对明亮发光菌(Photobacterium phosphoreum) Hormesis效应的机制可能与细菌的群体感应系统有关,其可能的具体机理是低浓度SAs会促进发光菌生成更多的自诱导物-受体复合物(LuxR~AI),而LuxR~AI复合体作为群体感应的信号分子,可以促进发光基因的表达从而引发Hormesis效应。另有报道认为[43],阿莫西林抗生素对铜绿微囊藻(Microcystis aeruginosa)的毒性兴奋效应机制与铜绿微囊藻内多种基因的表达和调控有关。总之,低剂量抗生素Hormesis机制解释尚无定论,还亟待更为深入且透彻的研究。
4 总结与展望
抗生素现已成为一类不可忽视的环境污染物,它在环境中多呈典型“混合-持久-低剂量”的暴露特征。有关抗生素的联合和低剂量的毒性研究表明,抗生素混合物间存在着相互作用,它们的联合毒性并非表现为简单的加和或独立效应;低剂量抗生素混合物对微生物的毒性效应也呈现Hormesis特征,并可以采用六点法加以预测。
但是,目前有关抗生素的毒性效应研究还有待进一步完善,主要体现在以下几个方面:
(1)需要多种模式生物来测定。环境风险评价中,合理的受体生物测试对象应包括不同能级的生物,很多生物面临着抗生素复合暴露时,其联合毒性效应及其作用机制是什么?
(2)环境中存在着许多可以影响抗生素生物有效性的物质,在这些共存物的作用下,抗生素间的联合毒性会发生怎样的变化?
(3)基于六点法的混合Hormesis的预测模型还比较繁琐,而且它仅仅基于磺胺类混合物的联合Hormesis的效应提出的,是否可用于其他抗生素,模型能否有效简化,其生物学意义能否更好得以体现?
(4)抗生素的种类繁多,目前测定的仅是前期用量较多或频率较高的种类,比如磺胺类,四环素类,大环内酯类等。那么其他类型的抗生素的联合毒性如何,它们在低剂量下是否呈现出Hormesis效应呢?
总之,加强抗生素毒性效应,特别是围绕上述这一系列问题,进一步开展联合毒性以及低剂量下毒性兴奋效应是未来相关研究的重要方向,这些问题的回答和相关研究将更具有理论意义和应用价值,可为环境中抗生素的联合生态研究和风险评价提供理论依据。
[1] Wise R. Antimicrobial resistance: Priorities for action [J]. Journal of Antimicrobial Chemotherapy, 2002, 49(4): 585-586
[2] Richardson B J, Lam P K, Martin M,et al. Emerging chemicals of concern: Pharmaceuticals and personal care products (PPCPs) in Asia, with particular reference to Southern China[J]. Marine Pollution Bulletin, 2005, 50(9): 913-920
[3] García-Galán M, Silvia D C. Combining chemical analysis and ecotoxicity to determine environmental exposure and to assess risk from sulfonamides[J]. TrAC Trends in Analytical Chemistry, 2009, 28(6): 804-819 [4] Zou X M, Lin Z F, Deng Z Q, et al. The joint effects of sulfonamides and their potentiator on Photobacterium phosphoreum: Differences between the acute and chronic mixture toxicity mechanisms[J]. Chemosphere, 2012, 86(1): 30- 35
[5] Broderius S J, Kahl M D, Hoglund M D, et al. Use of joint toxic response to define the primary mode of toxic action for diverse industrial organic chemicals [J]. Environmental Toxicology and Chemistry, 1995, 14(9): 1591-1605
[6] Kummerer K. Antibiotics in the aquatic environment-A review -Part I [J]. Chemosphere, 2009, 75(4): 417-434
[7] Kummerer K. Antibiotics in the aquatic environment-A review-PartII [J]. Chemosphere, 2009, 75(4): 435-441
[8] Radke M, Lauwigi C, Heinkele G, et al. Fate of the antibiotic sulfamethoxazole and its two major human metabolites in a water sediment test [J]. Environmental Science & Technology, 2009, 43(9): 3135-3141
[9] Hirsch R, Ternes T, Haberer K, et al. Occurrence of antibiotics in the aquatic environment[J]. The Science of the Total Environment, 1999, 225(1-2): 109-118
[10] Kummerer K. Standardized tests fail to assess the effects of antibiotics on environmental bacteria [J]. Water Research, 2004, 38(8): 2111-2116
[11] Thomulka K W, McGee D J, Lange J H, et al. Detection of biohazardous materials in water by measuring bioluminescence reduction with the marine organism Vibrio harveyi[J]. Journal of Environmental Science and Health, 1993, 28(9): 2153-2166
[12] Park S, Choi K. Hazard assessment of commonly used agricultural antibiotics on aquatic ecosystems[J]. Ecotoxicology, 2008, 17(6): 526-538
[13] Kolpin D W, Furlong E T, Meyer M T, et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: A national reconnaissance[J]. Environmental Science & Technology, 2002, 36(6): 1202-1211
[14] 张秀蓝, 张烃, 董亮, 等. 固相萃取/液相色谱-串联质谱法检测医院废水中21种抗生素药物残留[J]. 分析测试学报, 2012, 31(4): 453-458
Zhang X L, Zhang J, Dong L, et al. Determination of antibiotics in hospital wastewater using HPLC-MS/MS coupled with solid phase extraction [J]. Journal of Instrumental Analysis, 2012, 31(4): 453-458 (in Chinese)
[15] Jiang L, Hu X, Yin D, et al. Occurrence, distribution and seasonal variation of antibiotics in the Huangpu River, Shanghai, China [J]. Chemosphere, 2010, 82(6): 822-828
[16] Calabrese E J, Linda A B. Toxicology rethinks its central belief-Hormesis demands a reappraisal of the way risks are assessed [J]. Nature, 2003, 421(9): 691-692
[17] Zou S, Xu W, Zhang R, et al. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay, China: Impacts of river discharge and aquaculture activities [J]. Environmental Pollution, 2011, 159(10): 2913-2920
[18] 徐维海, 张干, 邹世春, 等. 典型抗生素类药物在城市污水处理厂中的含量水平及其行为特征[J]. 环境科学, 2007, 28(8): 1779-1783
Xu W H, Zhang G, Zou S C, et al. Occurrence, distribution and fate of antibiotics in sewage treatment plants [J]. Environmental Science, 2007, 28(8): 1779-1783(in Chinese)
[19] Lindberg R, Bjrklund K, Rendahl P, et al. Environmental risk assessment of antibiotics in the Swedish environment with emphasis on sewage treatment plants[J]. Water Research, 2007, 41(3): 613-619
[20] Soto-Rodríguez S, Mauricio A, Bruno G G, et al. Effects of enrofloxacin and florfenicol on survivaland bacterial population in an experimental infection with luminescent Vibrio campbellii in shrimplarvae of Litopenaeusvannamei [J]. Aquaculture, 2006, 255(1-4): 48-54
[21] 任皓, 王金荣, 陈行杰, 等. 应用发光细菌法检测饲用抗生素单一及联合毒性的研究[J]. 饲料加工与检测, 2011, 47(21): 49-52
Ren H, Wang J R, Chen X J, et al. Research on the application of luminescent bacteria to detect the single and joint toxicity of feed antibiotics[J]. Toxicity Study Feed Processing and Testing, 2011, 47(21): 49-52 (in Chinese)
[22] 丛永平, 姜蕾, 王婷, 等. 典型抗生素二元混合物对明亮发光杆菌的急性联合毒性[J]. 环境化学, 2013, 32(7): 1348-1351
Cong Y P, Jiang L, Wang T, et al. The acute mixture toxicity of the binary mixture of typical antibiotics on Photobacterium phosphoreum[J]. Environmental Chemistry, 2013, 32(7): 1348-1351 (in Chinese)
[23] 安情情, 姚志峰, 顾宇菲, 等. 磺胺类抗生素与群体感应抑制剂对发光菌的联合毒性及其机制初探[J]. 环境化学, 2014, 33(12): 1-8
An Q Q, Yao Z F, Gu Y F, et al. A novel probe of joint effects and mechanisms: Binary toxicity of sulfa antibiotics and quorum sensing inhibitors to Vibrio fischeri [J]. Environmental Chemistry, 2014, 33(12): 1-8 (in Chinese)
[24] Crane M, Watts C, Boucard T. Chronic aquatic environmental risks from exposure to human pharmaceuticals [J]. Science of the Total Environment, 2006, 367(1): 23-41
[25] Yang L H, Ying G G, Su H C, et al. Growth-inhibiting effects of 12 antibacterial agents and their mixtures on the freshwater microalga Pseudokirchneriella subcapitata [J]. Environmental Toxicology and Chemistry, 2008, 27(5): 1201-1208
[26] 高礼, 石丽娟, 袁涛, 等. 典型抗生素对羊角月牙藻的生长抑制及其联合毒性[J]. 环境与健康杂志, 2013, 30(6):475-478
Gao L, Shi L J, Yuan T, et al. Growth inhibitive effect of typical antibiotics and their mixtures on Selenastrum capricornutum [J]. Journal of Environment and Health, 2013, 30(6): 475-478 (in Chinese)
[27] 孙建平. 抗生素与重金属对猪场废水厌氧消化的抑制效应及其调控对策[D]. 杭州: 浙江大学, 2009
Sun J P. Inhibitory effect of antibiotics and heavy metals on anaerobic digestion of piggery wastewater and its control strategy [D]. Hang Zhou: Zhejiang University, 2009
[28] Li P, Li J, Wu C Z, et al. Synergistic antibacterial effects of β-lactam antibiotic combined with silver nanoparticles [J]. Nanotechnology, 2005, 16(9): 1912-1917
[29] Eguchi K, Nagase H, Ozawa M, et al. Evaluation of antimicrobial agents for veterinary use in the ecotoxicity test using microalgae[J]. Chemosphere, 2004, 57(11): 1733-1738
[30] Hernando M D, Mezcua M, Fernandez-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments[J]. Talanta, 2006, 69(2): 334-342
[31] Benotti M J, Trenholm R A, Vanderford B J, et al. Pharmaceuticals and endocrine disrupting compounds in US drinking water [J]. Environmental Science & Technology, 2008, 43(3): 597-603
[32] Calabrese E J, Linda A B. Hormesis: U-shaped dose responses and their centrality in toxicology[J]. Trends in Pharmacological Sciences, 2001, 22(6): 285-291
[33] Deng Z Q, Lin Z F, Zou X M, et al. Model of Hormesis and its toxicity mechanism based on quorum sensing: A case study on the toxicity of sulfonamides to Photobacterium phosphoreum [J]. Environmental Science & Technology, 2012, 46(14): 7746-7754
[34] Migliore L, Rotini A, Thaller M C, et al. Low doses of tetracycline trigger the E. coli growth: A case of hormetic response [J]. Dose-Response, 2013, 14(4): 550-557
[35] Bain P A, Kumar A. Cytotoxicity of binary mixtures of human pharmaceuticals in a fish cell line: Approaches for non-monotonic concentration-response relationships[J]. Chemosphere, 2014, 108(8): 334-342
[36] Nweke C O, Ahumibe N C, Orji J C, et al. Toxicity of binary mixtures of formulated glyphosate and phenols to rhizobium species dehydrogenase activity[J]. Journal of Microbiology Research, 2014, 4(4): 161-169
[37] Zhang J, Liu S S, Zhu X W, et al. Benefits from hazards: Mixture Hormesis induced by [emim]Cl despite its individual inhibitions[J]. Chemosphere, 2014, 112(10): 420-426
[38] Zou X M, Lin Z F, Deng Z Q, et al. Novel approach to predicting hormetic effects of antibiotic mixtures on Vibrio fischeri [J]. Chemosphere, 2013, 90(7): 2070-2076
[39] Ge H L, Liu S S, Zhu X W, et al. Predicting hormetic effects of ionic liquid mixtures on luciferase activity using the concentration addition model [J]. Environmental Science & Technology, 2011, 45(4): 1623-1629
[40] Szabadi E. A model of two functionally antagonistic receptor populations activated by the same agonist[J]. Journal of Theoretical Biology, 1977, 69(1): 101-112
[41] Calabrese E J. Overcompensation stimulation: A mechanism for hormetic effects [J]. Critical Reviews in Toxicology, 2001, 31(4-5): 425-470
[42] Calabrese E J. Hormesis: Why it is important to toxicology and toxicologists[J]. Environmental Toxicology and Chemistry, 2008, 27(7): 1451-1474
[43] Liu Y, Chen X, Zhang J, et al. Hormesis effects of amoxicillin on growth and cellular biosynthesis of Microcystis aeruginosa at different nitrogen levels [J]. Environmental Microbiology, 2014, 69(3): 608-617
◆
Progress in Researches on Toxicity of Antibiotics in Low Dose and Mixture Exposure to Microorganisms
Fang Shuxia1, Wang Dali1, Zhu Lihua2, Shi Tiantian1, Qin Mengnan1, Lin Zhifen1,*
1. State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China 2. College of Chemistry and Chemical Engineering, Huazhong University of Science and Technology, Wuhan 430074, China
2 November 2014 accepted 4 January 2015
Antibiotics have become serious environmental pollutants. Owing to their distinguishing feature of mixing, persistance and low-doses in the environment, a study on the toxicity of antibiotics, especially mixture toxicity and the hormetic effect in the low-dose, is significantly important to the ecological risk assessment. This review mainly focuses on the mixture toxicity of antibiotics and briefly summarizes the acute and chronic toxicity of binary chronic toxicity. Their joint effects are neither a simple addition of their individual effect nor independence of each other. The interactions in the binary mixture of antibiotics exist both in acute and chronic toxicity. Meanwhile, it is found that hormetic effect exists not only in the single toxicity but also in the binary toxicity when exposed to the low-dose. However, there are few studies on hormetic phenomenon in the binary mixtures of antibiotics. Therefore, a further study on the prediction and evaluation of the Hormesis in mixtures is needed, which can provide a theoretical basis for ecological risk assessment.
antibiotics; microorganisms; mixture toxicity; Hormesis
国家科技部“863”计划重大项目(No.2012AA06A304);同济大学污染控制与资源化研究国家重点实验室自主研究(重点)项目(PCRRY11003);国家自然科学面上基金(201177092,21377096),同济大学英才(攀登)计划(0400219287);中央高校基本科研业务费专项资金(0400219287)
方淑霞(1989-),女,硕士,研究方向为微生物毒理学,E-mail: fsxydx@126.com;
*通讯作者(Corresponding author), E-mail: lzhifen@tongji.edu.cn
10.7524/AJE.1673-5897.20141102001
2014-11-02 录用日期:2015-01-04
1673-5897(2015)2-69-07
X171.5
A
林志芬(1972-),女,教授,主要研究方向为混合污染物生物效应和人体健康评价。
方淑霞, 王大力, 朱丽华, 等. 抗生素对微生物的联合与低剂量毒性研究进展[J]. 生态毒理学报, 2015, 10(2): 69-75
Fang S X, Wang D L, Zhu L H, et al. Progress in researches on toxicity of antibiotics in low dose and mixture exposure to microorganisms [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 69-75 (in Chinese)
