被动加标在水生生态风险评价中的应用
——以多氯联苯分配系数的测定为例
2015-06-05祁红学李慧珍游静
祁红学,李慧珍,游静,*
1.中国科学院广州地球化学研究所有机地球化学国家重点实验室,广州510640 2.中国科学院大学,北京100049
被动加标在水生生态风险评价中的应用
——以多氯联苯分配系数的测定为例
祁红学1,2,李慧珍1,游静1,*
1.中国科学院广州地球化学研究所有机地球化学国家重点实验室,广州510640 2.中国科学院大学,北京100049
准确的水生生态风险评价需要可靠的毒性数据,而其获取要求在一定时间范围内,水体中污染物的浓度保持恒定。对疏水性有机污染物进行水体生物毒性测试时,通常采用有机溶剂加标,然而该方式可能因为污染物的挥发和降解、容器壁吸附、生物摄取等问题,水体中污染物浓度持续下降,导致污染物的浓度-效应关系难以明确。近期为了克服这些问题,被动加标用于替代溶剂加标,通过污染物在加标体系中平衡分配来维持精确和恒定的水体浓度,同时还可通过测定加标聚合物中污染物的浓度来监测水体浓度。首先介绍了被动加标方法及其材料选择,讨论了该方法在生态风险评价中的主要应用,包括分配系数的测定、体外细胞测试、体内生物积累及毒性测试,以及沉积物毒性评价等。然后,以测定代表污染物多氯联苯在聚二甲基硅氧烷与水间的分配系数为例,详细说明被动加标的操作流程。最后,讨论了被动加标方法的优缺点,并对其在水生生态风险中的应用前景进行了展望。
多氯联苯;被动加标;水体生物毒性测试;疏水性有机污染物
水体污染严重威胁水生生物的多样性和人类健康,因此迫切需要开展水生生态风险评价的研究,并制定相应基准[1]。准确可靠的毒性数据是建立水生生态基准方法的前提,而毒性数据主要通过加标受试污染物到水体,对模式生物进行毒性测试来获取。传统的溶剂加标法将待测化合物配制成目标浓度的有机溶液,然后加入水体。这种以溶剂为载体的加标方式对水溶性较大、水体中降解较慢的化合物适用性较好,水体浓度随时间变化不大。然而,对于疏水性有机污染物(hydrophobic organic contaminants, HOCs),则由于污染物的挥发降解、容器壁吸附、毒性测试中生物体的摄取等因素,测试过程中污染物水体浓度逐渐降低。这导致水体暴露浓度变化大,污染物的浓度-效应关系不明,直接影响毒性测试数据的准确性。例如,文献所报道的HOCs的毒性数据,即使是同一污染物对同一生物,也可能相差甚大[2],其中部分原因就是生物测试期间,无法保障水体中污染物的浓度稳定。
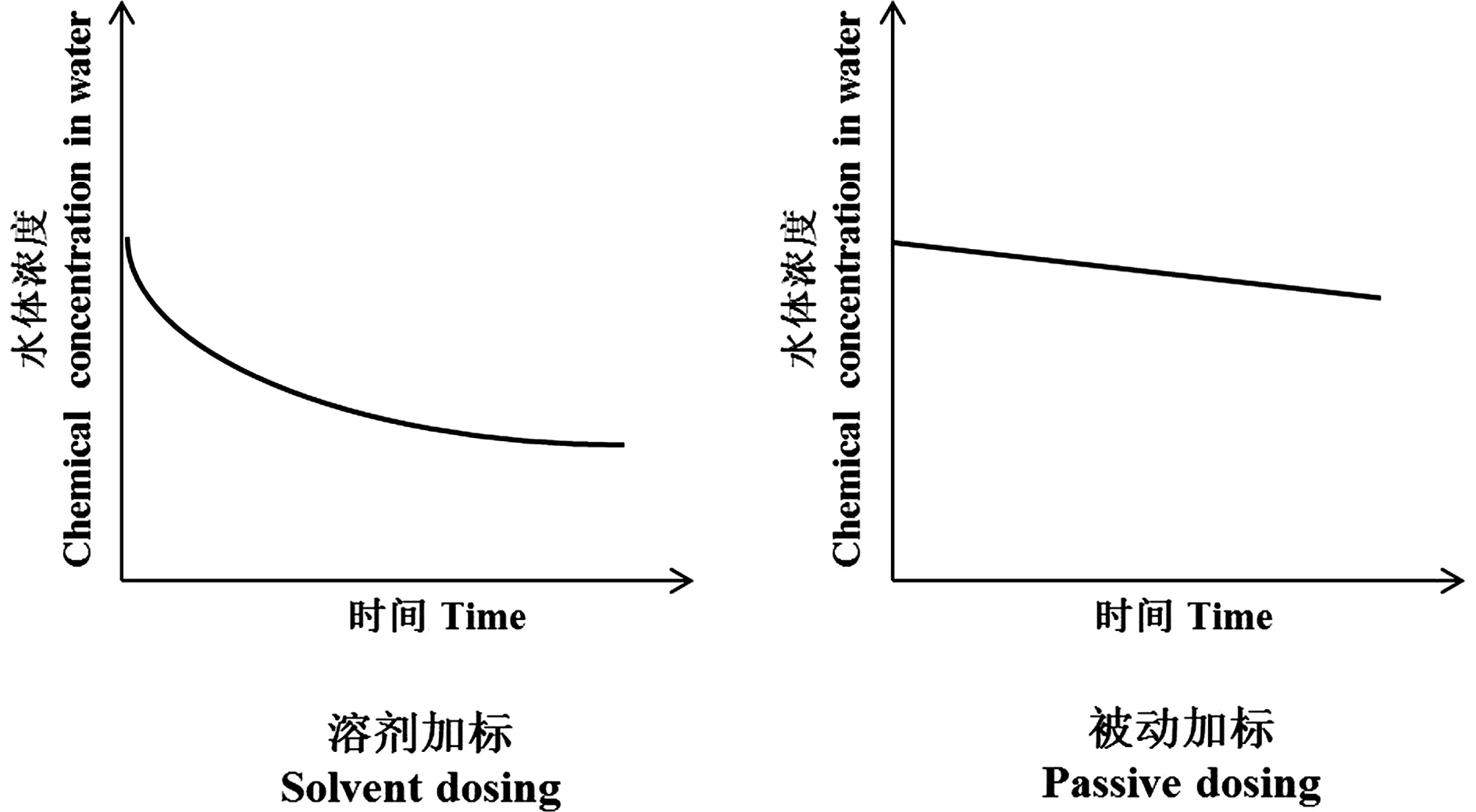
图1 溶剂加标与被动加标的对比[5]Fig. 1 A comparison between solvent dosing and passive dosing[5]
为了克服溶剂加标方式在水体中HOCs毒性测试的问题,Mayer等[3]在平衡分配理论[4]的基础上建立了被动加标法(passive dosing methodology)。该方法可有效地维持相对恒定的HOCs水体浓度,相比于传统溶剂加标法,优势明显。图1比较了2种加标方式,采用溶剂加标时,受试化合物的水浓度随时间大幅度下降,而在被动加标情况下,化合物的水浓度仅略微降低[5]。被动加标在生物暴露期间维持稳定的水体浓度,为毒性数据的准确性提供了有力的保障。
本文首先介绍被动加标方法及其常用材料的选择,接着重点综述被动加标法在水生生态风险评价中的应用。然后选择生物相容性好的聚二甲基硅氧烷(polydimethylsiloxane, PDMS)为吸附相聚合材料,多氯联苯(polychlorinated biphenyls, PCBs)为代表污染物,以被动加标法测定PCBs在PDMS-水间分配系数(kPw)为例,详细说明被动加标法的操作流程及可行性。最后,讨论被动加标法的优缺点,并对其在水生生态风险中的应用前景进行展望。
1 被动加标的定义及材料选择 (Definition andmaterial selection of passive dosing)
被动加标法在实际应用中还有多种名称。如1999年Mayer等[3]首次提出被动加标技术时,称之为分配机制的给药方式(partitioning driven administering),此后该技术也被称作分配控制的释放(partition controlled delivery)[6]、固相加标(solid phase dosing)[7]、动力渗透法(dynamic permeation method)[8]、基于分配的加标(partitioning-based dosing)[9],以及被动加标(passive dosing)[10]等。虽然名称不同,但其基本方法是一致的,即选择生物相容性较好的聚合物材料,如PDMS,将目标化合物加载到聚合物中作为“源”,然后将成功载样的聚合物放置在水体中。此时,聚合物中的化合物通过“平衡分配”释放进入水体,且在生物测试进行过程中弥补水体中化合物随时间的损耗,从而达到维持水体浓度恒定的目的。同时,被动加标方法还可通过测定聚合物中污染物的浓度来获得水体中污染物浓度,解决了污染物水浓度较低时难以测定的困难。
近年来,使用自动循环装置的被动加标也逐步发展起来,包括动态被动加标(dynamic passive dosing)[5]、被动加标流动系统(flow-through passive dosing system)[11]和再循环流动系统(recirculating flow-through system)[12]等。这些测试体系,可循环供给含有稳定浓度的目标水溶液,同时满足生物测试过程中的换水需求,保证生物体有充足的供氧量。
目前多种类型的聚合物被用作被动加标的材料,包括十八烷基键合硅胶(octadecyl silica, ODS)[3]、聚乙烯(polyethylene, PE)[13]、聚氧甲烯(polyoxymethylene, POM)[14],以及PDMS[6]等硅酮材料。反相色谱柱的常用填料ODS被用于被动加标,主要因为ODS有较大的比表面积,与化合物的作用方式主要为范德华力,而化合物在其中主要是分配吸附等特点[15]。广泛应用于被动采样技术中的一些聚合物材料[16],如PE[17]和PDMS等,也可用于被动加标。
因为其生物相容性好,平衡分配机制较为明确等优点,PDMS是应用最为广泛的被动采样及加标材料。为了适应不同容器的需要,其形状被制成膜状[13]、棒状[9]、O形环[18]等。通常认为,化合物在聚合物中的吸附分布主要有吸着(adsorption)和吸收(absorption)两种机理。吸着是指化合物附着在聚合物表面,可能存在吸附饱和、竞争吸附等现象。另一方面,吸收是指化合物分子分配进入聚合物内部,均匀分布,不出现吸附饱和及竞争吸附。根据相似相溶原理,吸收时目标化合物能以任意比溶入聚合物内,其载量与该物质的浓度呈线性相关,且不因其它化合物的种类增加而降低。Brown等[6]指出HOCs在PDMS膜上的吸附基于平衡分配理论,化合物通过分子扩散进入PDMS膜内部,为吸收机理。夏欢等[19]测定了多溴联苯在PDMS与水之间的分配系数,其结果也支持PDMS为吸收机理。此外,相对于PE膜,以PDMS为代表的硅酮类材料适用有机污染物的极性范围更大,包括有机磷阻燃剂和多溴联苯醚等,而PE膜的适用范围相对较窄,适用化合物的辛醇-水分配系数(log kow)介于4到7之间[20]。鉴于此,大多数目前被动加标法的应用选择了PDMS作为加标材料[6]。被动加标不仅用于单一化合物加标,而且可以实现多种化合物同时加标,目前还没有不同化合物在硅酮材料上相互干扰的报道[21]。
被动加标的载样和萃取过程中,会使用有机溶剂,但有机溶剂对材料会产生一定的溶胀作用。有机溶剂的溶胀作用从强到弱依次为正己烷、二氯甲烷、乙酸乙酯、丙酮、甲醇。甲醇对多数材料的溶胀体积小于5%,因此,通常选择甲醇为载样溶剂[16]。
2 被动加标的应用(Application of passive dosing)
相比于传统的溶剂加标,被动加标能够维持精确和恒定的HOCs水浓度。在HOCs的溶解度范围内,可以通过调节HOCs在甲醇溶液中的浓度,建立聚合物上的载样梯度,并依据聚合物与水之间的分配系数,获得所需浓度的水溶液系列。如表1所示,被动加标中水溶液浓度常以污染物自由溶解浓度(freely dissolved concentration, Cfree)和化学活度(a)的形式表达。Schmidt等[22]分析了39种非极性化合物对绿藻的毒性,发现对这些化合物当其非特异性毒性出现时,a值基本在0.01~0.1范围内,显示了a值在毒性预测中的作用。
在Cfree和a之外,表1还列出了通过被动加标法可获得的常用于表征污染物环境行为的参数及其计算公式。除了受HOCs疏水性的影响外,无机盐离子和溶解有机质(dissolved organic matters, DOM)也将影响被动加标体系[23]。离子强度增加时,盐析作用可导致HOCs的Cfree下降[24-25]。离子强度对Cfree的影响,可利用盐效应常数(Setschenow constant, ks)加以校正。另一方面,由于活度系数(γ)增加,HOCs的化学活度(a=γCfree)不受水体盐度影响[26]。水溶液中的HOCs趋向于与腐殖酸等DOM结合,引起Cfree降低,而DOM对Cfree的影响,可用分配比(k)、结合常数,以及增加容量(E)来表示(表1)。获得这些参数对研究HOCs的环境迁移和毒代动力学过程有重要的意义,例如,HOCs在土壤微孔中的胶体传输可能是地下水污染的主要途径[27]。Tejeda等[28]发现腐殖酸(humic acid, HA)的存在显著影响PAHs的生物降解。Zhao等[29]用被动采样方法研究了大分子物质对菲的结合能力,发现HA5>HA2>牛血清蛋白>胃蛋白酶>溶菌酶。此外,他们也进一步利用被动加标方法探讨了石墨烯对菲的吸附过程中表面活性剂胆酸钠的影响[30]。
除了研究水体中污染物环境行为之外,被动加标在水生生态风险评价中的应用主要涉及生物毒性测试[31]。目前已开展的应用包括污染物在聚合物与水相间分配系数的测定、体外细胞测试、体内生物积累与毒性测试,以及沉积物毒性评价等(表2)。
2.1 分配系数的测定
由于HOCs水溶性差、易产生容器壁吸附、平衡时间长等问题,随HOCs疏水性的加大,其分配系数的测定越来越难。在这种情况下,被动加标法被用于测量HOCs的分配系数。Ter Laak等[7]测定6种多环芳烃(polycyclic aromatic hydrocarbons, PAHs)的kPw,结果显示方法精密度好,标准误差小于0.05。此外,Kwon等[8]利用水边界层渗透的被动加标法测定了高疏水性HOCs的分配系数。该方法使用2张PDMS膜,1张预先载样,作为供体膜,而另1张未载样的为受体膜,将2张膜置于同一水体系统,依据平衡分配理论,供体膜、受体膜和水三相之间达到平衡时,通过受体膜-水之间的分配准确测定HOCs的分配系数。这一方法为测定高疏水性HOCs的分配系数提供了新的思路,但是研究方法所需的实验体系非常小,实验条件要求高。测定HOCs在聚合物-水相间分配系数,对于分析化合物与聚合物间的作用机理也至关重要。Smith等[21]测定了PAHs的kPw,发现当log kow在3.56~6.63范围内,log kPw与log kow呈线性相关(log kPw=0.799 log kow+0.234, r2=0.955),认为PAHs主要是以分配进入PDMS膜中,支持了PDMS对HOCs的吸收理论。
被动加标也可看作是被动采样的逆过程,故而相同的聚合物材料常在2种方法中共用[26],例如PDMS[32]。被动采样技术可在野外原位测定Cfree,该浓度是生物可利用浓度的表征[33-34],对生态风险评价有重要的意义[35]。相对于耗竭式提取所测定的沉积物总浓度,Cfree可更好地预测沉积物的毒性效应[36]。但是在野外环境中,被动采样方法的应用面临着诸多挑战,如是否达到平衡分配,是否会打破原有体系(微损耗条件是否满足)等[37]。用被动加标法准确测定污染物在聚合物和水之间的分配系数,以及通过被动加标与被动采样技术的相互校正,在一定程度上可促进被动采样技术的发展与与完善[38]。
2.2 体外细胞测试
被动加标技术已被用于体外与体内毒性测试,包括在细胞水平的暴露(表2)。细胞毒性测试,除了小体积的特点外,存在的主要问题是血清中蛋白质等物质对目标污染物的吸附。Smith等[18]将PDMS制成O形环,加载HOCs后置入细胞培养皿,成功地将被动加标法用于体外细胞毒性测试。进一步研究中,将载样的PDMS膜置于培养皿底部,另外插入一张膜,供细胞生长,从而避免细胞与PDMS膜的直接接触[39]。Kramer等[40]对比了溶剂加标与被动加标2种方法,结果显示在细胞培养时血清吸附对化合物浓度影响很大。当用二甲亚砜做溶剂加标时,二氯苯、三氯苯和苯并[a]芘的血清吸附量分别达到了61%、70%和99.8%,与被动加标法进行的细胞测试相比,溶剂加标的毒性数据低1.3到7倍。此外,研究结果也表明相比较于溶剂加标,被动加标法所得到的细胞毒性的剂量-效应曲线的重现性更好[39]。因此,体外细胞毒性测试中应用被动加标法,较好地解决了血清吸附污染物的问题。
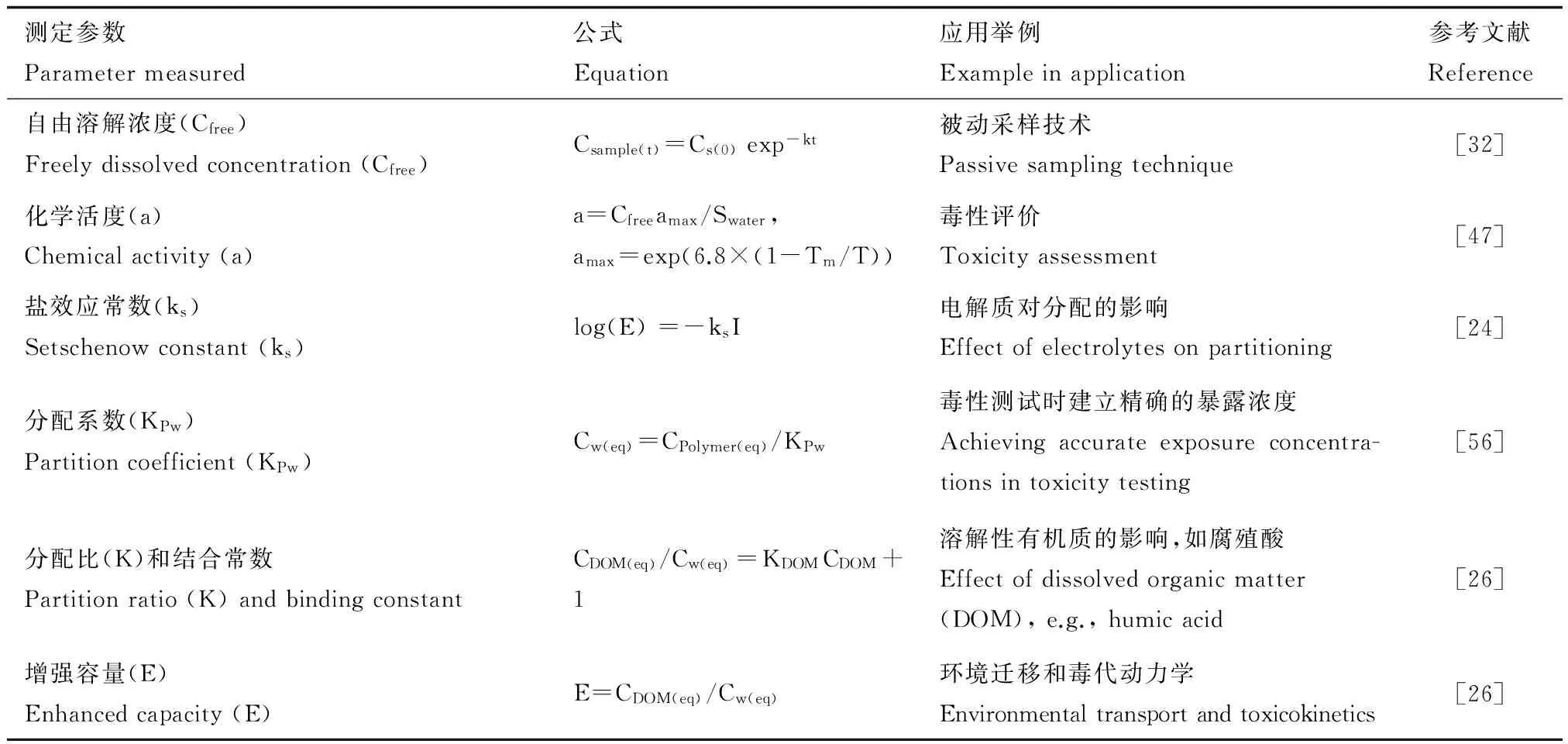
表1 被动加标的常用测定参数Table 1 Parameters measured in passive dosing
注:k是速率常数;t是时间;kPw是聚合物与水之间的分配系数;Swater是水中溶解度;tm是熔解温度;I是离子强度。
Note: k, rate constant; t, time; kPw, partition coefficient between polymer and water; Swater, water solubility; tm, melting temperature; I, ionic strength.
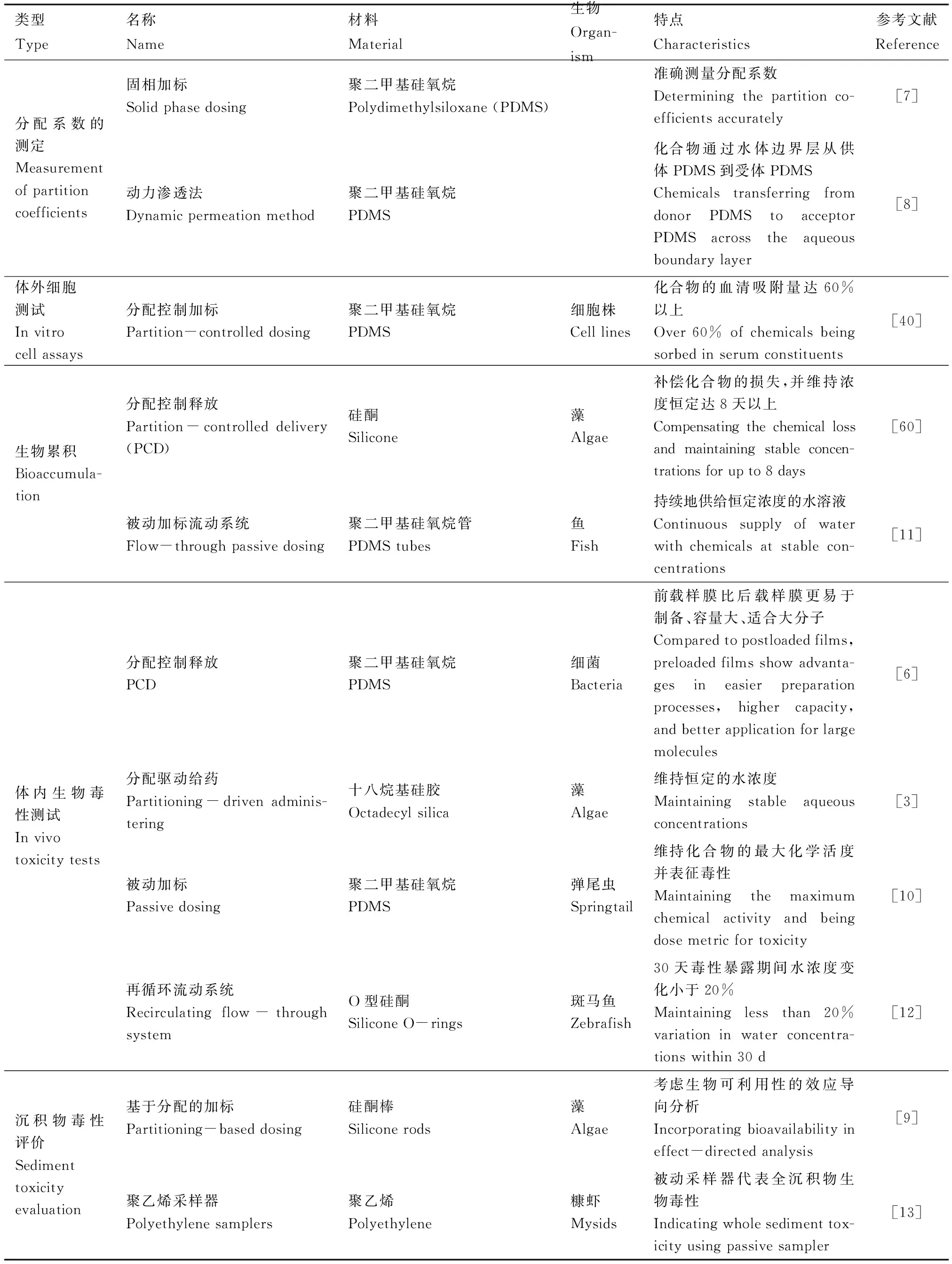
表2 被动加标的应用Table 2 Applications of passive dosing
2.3 分配系数的测定
除了体外测试之外,被动加标法还广泛用于HOCs的体内生物累积和毒性测试。例如,被动加标法成功测试了PAHs对水蚤[21]和斑马鱼[41]的毒性效应,以及用于测试基因突变的Ames试验中[42]。通过被动加标,HOCs在水体中的化学活度能较好地反映生物体的毒性效应(表1)。Mayer等[10]使用PDMS的被动加标测试10种PAHs对弹尾虫的毒性,建立了化学活度-毒性效应关系曲线,发现致死率与PAHs的化学活度的相关程度优于其与PAHs的log kow和分子大小的关系。Roh等[43]也成功运用被动加标方法,建立了暴露在毒死蜱中的线虫的生物标志物的剂量-效应曲线。Mayer等[44]进一步利用PDMS测定了PAHs在不同类蔬菜油、鱼脂和贻贝脂肪中的化学活度,认为PDMS可用于生物体内和富脂性样品中HOCs浓度的监测。Engraff等[45]和Schmidt等[46]报道多种PAHs的混合毒性与其总化学活度相关,而且不单是化学活度,PAHs的脂肪平衡浓度和毒性单位也都能很好地表征其毒性效应[47]。此外,研究显示通过被动加标开展的生物毒性实验,其重复性也要明显优于溶剂加标[48]。
最近,被动加标方法也被用于联合毒性效应的评价。Smith等[49]利用被动加标体系,确认了不同PAHs之间毒性表现为浓度加和效应。Holmstrup等[50]在弹尾虫的联合毒性研究中,发现菲在干燥环境条件下出现协同效应,进一步研究指出该协同效应与菲浓度相关,不可简单外推,而应该注意化合物浓度变化导致的协同效应差异[51]。
2.4 沉积物毒性评价
沉积物中多种污染物并存,其中主要致毒因子的鉴别往往借助于效应导向分析(effect-directed analysis, EDA)。在EDA过程中,考虑沉积物中污染物的生物可利用性(bioavailability)对评判结果的准确性极为重要。如PDMS等被动加标的材料相当于沉积物的有机碳,而污染物在PDMS-水相间的分配可用于模拟其在沉积物-水相中的分配[52],考虑到污染物的生物可利用性,更准确地评价沉积物毒性并鉴别致毒因素[9]。Bandow等[53]在EDA对有机物分离组分的毒性测试过程中,对比了溶剂加标与被动加标2种方式,发现主要致毒污染物鉴定结果大不相同。通过溶剂加标的方式获得的毒性组分主要是PAHs,而基于被动加标时,PAHs不再是主要致毒物,而极性较强的三氯生被检出。因此,Brack等[54]建议在进行致毒因素的鉴别时,结合基于生物可利用性的污染物提取方式(如Tenax萃取[55])与平衡分配的被动加标技术,可更好地评价沉积物毒性和推断主要致毒物质。
3 被动加标操作流程的应用实例(Example procedureof passive dosing)
被动加标的操作包括聚合物材料选择、载样、水体释放、测试4步。本文以7种PCBs为代表性HOCs,通过被动加标测定其在PDMS-水相间的分配系数,详细描述被动加标的操作流程。如图2所示,首先为材料的选择与制备,本研究自行制备生物相溶性好的PDMS膜为吸附相。其次为载样阶段,将PDMS浸入溶有所需浓度PCBs的甲醇中,通过不断向甲醇溶液中加水的方式实现载样,此方式称为后载样法(post-loading approach),另外也可采用前载样法(pre-loading approach),即在PDMS膜的制作过程中直接加入目标化合物[6]。再次,水体释放阶段,即将已载样的PDMS膜从载样的甲醇/水溶液中取出,放入适量测试水溶液中,PDMS膜中的化合物通过平衡分配释放进入水体,提供精确和恒定的水体浓度。最后,样品测试步骤,运用已获得稳定污染物浓度的水溶液开展分配系数测定或毒性测试等。在测试过程中,PDMS膜上的化合物可不断补充水中化合物的损失,维持恒定的水浓度。以下具体讨论实验流程及PCBs分配系数的测试结果,实验包括3个平行样。

图2 被动加标操作流程示意图(后载样法)Fig. 2 The diagram of procedures of passive dosing (post-loading approach)
3.1 膜的制备
本实验用的PDMS膜由美国道康宁公司生产MDX4-4210生物医用级硅酮制备,使用前将硅酮前聚物和催化剂充分混合(10:1),以0.25 mm左右的厚度均匀涂布在锡纸上,23 ℃硬化72 h后裁剪成所需大小。将膜从锡纸上取下,用甲醇浸泡至少4 h除去杂质,再用超纯水淋洗3次去除甲醇,自然风干待用。
3.2 载 样
取0.5 g的PDMS膜浸泡于含有PCBs的甲醇溶液,在23 ℃以220 r·min-1的速度摇动,每隔2 h加入1~2 mL高纯水,促使PCBs转移到PDMS膜中,至72 h完成载样。
3.3 水体释放
化合物从PDMS膜释放至水体时,需要确保污染物在两相间达到平衡,其释放过程可用公式(1)中一级一室动力学模型描述。污染物达到95%稳态时所需时间(t95)通过公式(1)模拟所得到释放速率k计算获得(公式2)。
Cw(t)= Cw(eq)(1-e-kt)
(1)
t95= 3/k
(2)
公式中:Cw(t)和Cw(eq)分别为PCBs在t时刻和达到平衡时的水浓度,k为释放速率常数,t95是达到95%稳态浓度所需时间。
在静止或动态条件下,达到平衡所需时间有较大差别,因此平衡时间的估算需要在特定实验条件下进行。Smith等[21]比较了荧蒽在不同条件下,在PDMS和水体中达到平衡的释放时间,发现采用颠倒混匀方法最快达到平衡,以250 r·min-1的振荡次之,而在静止状态下最慢。
本研究在烧杯中加入300 mL的纯净水和1片已载样的PDMS膜,并以660 r·min-1的速度搅拌至预订时间点,分别为0.5、1、2、8、24和48 h,分别采集样品,并通过数据模拟获得k值。如表3所示,7种PCBs达到稳态时所需时间最长为35.5 h(PCB-156)。因此,在测定分配系数时,平衡时间设定为48 h,确保所有PCBs均达到平衡。达到平衡后(48 h),通过溶剂萃取与气相-质谱仪测定PDMS膜和水体中PCBs浓度,结果表明PCBs在PDMS膜上的量占加标初始量的53%~73%(表3)。与文献中数据接近,如Mayer等[3]报道12种卤代烃的载样效率在63%~82%之间。整体而言,PDMS膜的载样效率较高,最低也能超过一半,在实际操作中还可逐步提高载样体系中的水含量,争取最大的载样量[56]。
3.4 测试(log kPw的测定)
当PCBs在PDMS和水相中达到平衡后测定其浓度,并根据公式(3)计算得到log kPw值(表3)。
kPw= CPDMS(eq)/Cw(eq)
(3)
公式中:kPw为平衡分配常数,CPDMS(eq)和Cw(eq)分别为达到平衡时PCBs在PDMS膜和水中浓度。
如图3所示,所测定PCBs的log kPw与其log kow[57]呈线性相关,即log kPw=0.77 log kow+0.83(r2=0.82, n=7, P< 0.01),与文献报道值相近:log kPw=0.82 log kow+0.24(r2=0.84, n=22)[16],说明本研究中PDMS材料的制备与实验体系的建立是可行的。同时该相关关系也表明PCBs的分配系数与其疏水程度密切相关,PCBs主要通过吸收进入PDMS中。

表3 多氯联苯(PCBs)的基本性质[57]及被动加标测定的分配系数Table 3 Chemical properties of polychlorinated biphenyl (PCBs)[57] and partition coefficients measured by passive dosing
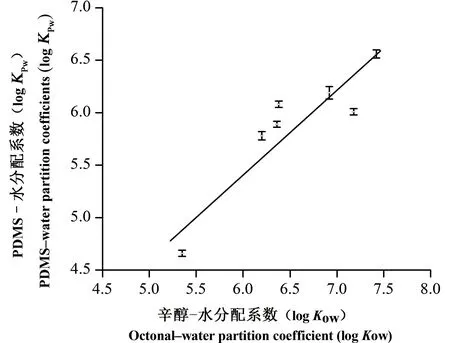
图3 被动加标测定的多氯联苯在聚二甲基硅氧烷 和水相的分配系数(log kPw)与其辛醇-水分配系数(log kow) 的关系。误差线代表标准偏差,实线代表线性回归模型 (log kPw=0.77 log kow+0.83, r2=0.82, n= 7, P<0.01)Fig. 3 Relationship between polydimethylsiloxane (PDMS)-water partition coefficients (log kPw) of polychlorinated biphenyls and their octano-water partition coefficients (log kow). Error bars denote the standard deviations and the real line indicates the best-fit using a linear regression (log kPw=0.77 log kow + 0.83, r2 = 0.82, n=7, P<0.01)
4 展望(Perspective)
被动加标法依据平衡分配理论,在水体中建立并维持目标化合物精确和恒定的浓度,为传统溶剂加标在毒性测试过程中水浓度不稳定的问题提供了有效的解决途径,提高风险评价准确性。此外,对污染物水体浓度的测定,可通过直接测定PDMS膜上的浓度来实现,解决了小体积、低浓度测定的困难。被动加标法的发展对水环境中HOCs的环境行为及毒性研究具有非常积极的意义。硅酮类加标材料具有对HOCs为分配吸收机制、生物相容性好、化合物适用范围广等优点。然而,当化合物的疏水性持续增大时,其分配系数与疏水程度可能出现非线性关系。Yang等[58]发现化合物的log kow> 7~7.5时,log kPw与log kow的关系出现拐点,不再呈正相关,而他们认为其原因可能是由于高交联网状结构的PDMS膜,对大分子的空间位阻效应所造成[59]。此外,除化合物的极性因素外,化合物的立体结构、分子量大小等也可能影响其分配行为,具体的机理尚需进一步地研究。
被动加标可用于水体暴露的生物测试,是提供准确毒性数据的有力保障。此外,在水体沉积物风险评价过程中,PDMS又可相当于沉积物中有机碳,通过污染物在PDMS-水间的分配模拟其在沉积物-水间的分配,这一过程巧妙地将生物可利用性结合到沉积物毒性评价中。最后,被动加标、被动采样技术,或其它基于分配理论的方法能够相互验证,通过建立被动采样浓度和被动加标所获毒性数据的联系,为水生生态风险评价提供新的思路。
[1] 金小伟, 雷炳莉, 许宜平, 等. 水生态基准方法学概述及建立我国水生态基准的探讨[J]. 生态毒理学报, 2009, 4(5): 609-616
Jin X W, Lei B L, Xu Y P, et al. Methodologies for deriving water quality criteria to protect aquatic life (ALC) and proposal for development of ALC in China: A review [J]. Asian Journal of Ecotoxicology, 2009, 4(5): 609-616 (in Chinese)
[2] Li H Z, You J. Application of species sensitivity distribution in aquatic probabilistic ecological risk assessment of cypermethrin: A case study in an urban stream in South China [J]. Environmental Toxicology and Chemistry, 2015, 34(3): 640-648
[3] Mayer P, Wernsing J, Tolls J, et al. Establishing and controlling dissolved concentrations of hydrophobic organics by partitioning from a solid phase [J]. Environmental Science & Technology, 1999, 33(13): 2284-2290
[4] Di Toro D M, Zarba C S, Hansen D J, et al. Technical basis for establishing sediment quality criteria for nonionic organic chemicals using equilibrium partitioning [J]. Environmental Toxicology and Chemistry, 1991, 10(12): 1541-1583
[5] Smith K E C, Rein A, Trapp S, et al. Dynamic passive dosing for studying the biotransformation of hydrophobic organic chemicals: Microbial degradation as an example [J]. Environmental Science & Technology, 2012, 46(9): 4852-4860
[6] Brown R S, Akhtar P, Akerman J, et al. Partition controlled delivery of hydrophobic substances in toxicity tests using poly(dimethylsiloxane) (PDMS) films [J]. Environmental Science & Technology, 2001, 35(20): 4097-4102
[7] Ter Laak T L, Durjava M, Struijs J, et al. Solid phase dosing and sampling technique to determine partition coefficients of hydrophobic chemicals in complex matrixes [J]. Environmental Science & Technology, 2005, 39(10): 3736-3742
[8] Kwon J H, Wuethrich T, Mayer P, et al. Dynamic permeation method to determine partition coefficients of highly hydrophobic chemicals between poly(dimethylsiloxane) and water [J]. Analytical Chemistry, 2007, 79(17): 6816-6822
[9] Bandow N, Altenburger R, Lubcke-von Varel U, et al. Partitioning-based dosing: An approach to include bioavailability in the effect-directed analysis of contaminated sediment samples [J]. Environmental Science & Technology, 2009, 43(10): 3891-3896
[10] Mayer P, Holmstrup M. Passive dosing of soil invertebrates with polycyclic aromatic hydrocarbons: Limited chemical activity explains toxicity cutoff [J]. Environmental Science & Technology, 2008, 42(19): 7516-7521
[11] Adolfsson-Erici M, Akerman G, Jahnke A, et al. A flow-through passive dosing system for continuously supplying aqueous solutions of hydrophobic chemicals to bioconcentration and aquatic toxicity tests [J]. Chemosphere, 2012, 86(6): 593-599
[12] Butler J D, Parkerton T F, Letinski D J, et al. A novel passive dosing system for determining the toxicity of phenanthrene to early life stages of zebrafish [J]. Science of the Total Environment, 2013, 463: 952-958
[13] Perron M M, Burgess R M, Ho K T, et al. Development and evaluation of reverse polyethylene samplers for marine phase II whole-sediment toxicity identification evaluations [J]. Environmental Toxicology and Chemistry, 2009, 28(4): 749-758
[14] Lombard N J, Ghosh U, Kjellerup B, et al. Kinetics and threshold level of 2,3,4,5-tetrachlorobiphenyl dechlorination by an organohalide respiring bacterium [J]. Environmental Science & Technology, 2014, 18(8): 4353-4360
[15] Moors M, Massart D, McDowall R. Analyte isolation by solid phase extraction (SPE) on silica-bonded phases: Classification and recommended practices (Technical Report) [J]. Pure and Applied Chemistry, 1994, 66(2): 277-304
[16] Rusina T P, Smedes F, Klanova J, et al. Polymer selection for passive sampling: A comparison of critical properties [J]. Chemosphere, 2007, 68(7): 1344-1351
[17] Booij K, Smedes F, van Weerlee E M. Spiking of performance reference compounds in low density polyethylene and silicone passive water samplers [J]. Chemosphere, 2002, 46(8): 1157-1161
[18] Smith K E C, Oostingh G J, Mayer P. Passive dosing for producing defined and constant exposure of hydrophobic organic compounds during in vitro toxicity tests [J]. Chemical Research in Toxicology, 2010, 23(1): 55-65
[19] 夏欢, 谢美, 杨泽玉, 等. 多溴联苯在聚二甲基硅氧烷与水相间分配系数的固相微萃取技术测定[J]. 分析测试学报, 2008, 27(2): 148-152
Xia H, Xie M, Yang Z Y, et al. Determination of poly(dimethyl)siloxane-water partition coefficients for polybrominated biphenyls by solid-phase microextraction [J]. Journal of Instrumental Analysis, 2008, 27(2): 148-152 (in Chinese)
[20] Allan I J, Harman C, Ranneklev S B, et al. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water [J]. Environmental Toxicology and Chemistry, 2013, 32(8): 1718-1726
[21] Smith K E, Dom N, Blust R, et al. Controlling and maintaining exposure of hydrophobic organic compounds in aquatic toxicity tests by passive dosing [J]. Aquatic Toxicology, 2010, 98(1): 15-24
[22] Schmidt S N, Mayer P. Linking algal growth inhibition to chemical activity: Baseline toxicity required 1% of saturation [J]. Chemosphere, 2015, 120: 305-308
[23] 郑伟, 杨曦, 张金凤. 水环境中有机污染物与溶解性有机质相互作用研究[J]. 环境保护科学, 2007(6): 17-20
Zhen W, Yang X, Zhang J F. Study on interaction of organic pollutants and dissolved organic matter in aquatic environment [J]. Environmental Protection Science , 2007(6): 17-20 (in Chinese)
[24] Endo S, Pfennigsdorff A, Goss K-U. Salting-out effect in aqueous NaCl solutions: Trends with size and polarity of solute molecules [J]. Environmental Science & Technology, 2012, 46(3): 1496-1503
[25] Wang C, Lei Y D, Endo S, et al. Measuring and modeling the salting-out effect in ammonium sulfate solutions [J]. Environmental Science & Technology, 2014, 48(22): 13238-13245
[26] Gouliarmou V, Smith K E C, de Jonge L W, et al. Measuring binding and speciation of hydrophobic organic chemicals at controlled freely dissolved concentrations and without phase separation [J]. Analytical Chemistry, 2012, 84(3): 1601-1608
[27] De Jonge L W, Kjaegaard C, Moldrup P. Colloids and colloid-facilitated transport of contaminants in soils [J]. Vadose Zone Journal, 2004, 3(2): 321-325
[28] Tejeda-Agredano M-C, Mayer P, Ortega-Calvo J-J. The effect of humic acids on biodegradation of polycyclic aromatic hydrocarbons depends on the exposure regime [J]. Environmental Pollution, 2014, 184: 435-442
[29] Zhao J, Wang Z, Ghosh S, et al. Phenanthrene binding by humic acid-protein complexes as studied by passive dosing technique [J]. Environmental Pollution, 2014, 184: 145-153
[30] Zhao J, Wang Z, Zhao Q, et al. Adsorption of phenanthrene on multilayer graphene as affected by surfactant and exfoliation [J]. Environmental Science & Technology, 2014, 48(1): 331-339
[31] Murphy M B, 林忠华, 林群声. 体内和体外生物测定在环境监测中的应用[J]. 化学进展, 2009, 21(2/3): 483-491
Murphy M B, Lam J C W, Lam P K S. Use ofinvivoandinvitrobioassays for environmental monitoring [J]. Progress in Chemistry, 2009, 21(2/3): 483-491 (in Chinese)
[32] Ter Laak T L, Busser F J, Hermens J L. Poly(dimethylsiloxane) as passive sampler material for hydrophobic chemicals: Effect of chemical properties and sampler characteristics on partitioning and equilibration times [J]. Analytical Chemistry, 2008, 80(10): 3859-3866
[33] Styrishave B, Mortensen M, Henning Krogh P, et al. Solid-phase microextraction (SPME) as a tool to predict the bioavailability and toxicity of pyrene to the springtail, Folsomia candida, under various soil conditions [J]. Environmental Science & Technology, 2008, 42(4): 1332-1336
[34] 胡霞林, 刘景富, 卢士燕, 等. 环境污染物的自由溶解态浓度与生物有效性[J]. 化学进展, 2009, 20(2/3): 514-523
Hu X L, Liu J F, Lu S Y, et al. Freely dissolved concentration and bioavailability of environmental pollutants [J]. Progress in Chemistry, 2009, 21(2/3): 514-526 (in Chinese)
[35] 陈珊, 许宜平, 王子健. 有机污染物生物有效性的评价方法[J]. 环境化学, 2011, 30(1): 158-164
Chen S, Xu Y P, Wang Z J. Methods for evaluating the bioavailability of organic contaminants in environments [J]. Environmental Chemistry, 2011, 30(1): 158-164 (in Chinese)
[36] 李慧珍, 游静. 被动采样技术在测定沉积物中有机污染物的生物可利用性和毒性中的研究进展[J]. 色谱, 2013, 31(7): 620-625
Li H Z, You J. Advances in using passive sampling techniques to measure bioavailability and toxicity of organic contaminants in sediment [J]. Chinese Journal of Chromatography, 2013, 31(7): 620-625 (in Chinese)
[37] Mayer P, Tolls J, Hermens L, et al. Equilibrium sampling devices [J]. Environmental Science & Technology, 2003, 37(9): 184A-191A
[38] DiFilippo E L, Eganhouse R P. Assessment of PDMS-water partition coefficients: Implications for passive environmental sampling of hydrophobic organic compounds [J]. Environmental Science & Technology, 2010, 44(18): 6917-6925
[39] Booij P, Lamoree M H, Leonards P E G, et al. Development of a polydimethylsiloxane film-based passive dosing method in the in vitro DR-CALUX(R)assay [J]. Environmental Toxicology and Chemistry, 2011, 30(4): 898-904
[40] Kramer N I, Busser F J, Oosterwijk M T, et al. Development of a partition-controlled dosing system for cell assays [J]. Chemical Research in Toxicology, 2010, 23(11): 1806-1814
[41] Seiler T B, Best N, Fernqvist M M, et al. PAH toxicity at aqueous solubility in the fish embryo test with Danio rerio using passive dosing [J]. Chemosphere, 2014, 112: 77-84
[42] Smith K E C, Heringa M B, Uytewaal M, et al. The dosing determines mutagenicity of hydrophobic compounds in the Ames II assay with metabolic transformation: Passive dosing versus solvent spiking [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2013, 750(1-2): 12-18
[43] Roh J Y, Lee H, Kwon J H. Changes in the expression of CYP35A family genes in the soil nematode Caenorhabditis elegans under controlled exposure to chlorpyrifos using passive dosing [J]. Environmental Science & Technology, 2014, 48(17): 10475-10481
[44] Mayer P, Toraeng L, Glaesner N, et al. Silicone membrane equilibrator: Measuring chemical activity of nonpolar chemicals with poly(dimethylsiloxane) microtubes immersed directly in tissue and lipids [J]. Analytical Chemistry, 2009, 81(4): 1536-1542
[45] Engraff M, Solere C, Smith K E C, et al. Aquatic toxicity of PAHs and PAH mixtures at saturation to benthic amphipods: Linking toxic effects to chemical activity [J]. Aquatic Toxicology, 2011, 102(3-4): 142-149
[46] Schmidt S N, Smith K E C, Holmstrup M, et al. Uptake and toxicity of polycyclic aromatic hydrocarbons in terrestrial springtails: Studying bioconcentration kinetics and linking toxicity to chemical activity [J]. Environmental Toxicology and Chemistry, 2013, 32(2): 361-369
[47] Schmidt S N, Holmstrup M, Smith K E C, et al. Passive dosing of polycyclic aromatic hydrocarbon (PAH) mixtures to terrestrial springtails: Linking mixture toxicity to chemical activities, equilibrium lipid concentrations, and toxic units [J]. Environmental Science & Technology, 2013, 47(13): 7020-7027
[48] Rojo-Nieto E, Smith K E C, Perales J A, et al. Recreating the seawater mixture composition of HOCs in toxicity tests with Artemia franciscana by passive dosing [J]. Aquatic Toxicology, 2012, 120-121: 27-34
[49] Smith K E C, Schmicdt S N, Dom N, et al. Baseline toxic mixtures of non-toxic chemicals: "Solubility addition" increases exposure for solid hydrophobic chemicals [J]. Environmental Science & Technology, 2013, 47(4): 2026-2033
[50] Holmstrup M, Slotsbo S, Schmidt S N, et al. Physiological and molecular responses of springtails exposed to phenanthrene and drought [J]. Environmental Pollution, 2014, 184: 370-376
[51] Schmidt S N, Holmstrup M, Damgaard C, et al. Simultaneous control of phenanthrene and drought by dual exposure system: The degree of synergistic interactions in springtails was exposure dependent [J]. Environmental Science & Technology, 2014, 48(16): 9737-9744
[52] Heinis L J, Highland T L, Mount D R. Method for testing the aquatic toxicity of sediment extracts for use in identifying organic toxicants in sediments [J]. Environmental Science & Technology, 2004, 38(23): 6256-6262
[53] Bandow N, Altenburger R, Streck G, et al. Effect-directed analysis of contaminated sediments with partition-based dosing using green algae cell multiplication inhibition [J]. Environmental Science & Technology, 2009, 43(19): 7343-7349
[54] Brack W, Bandow N, Schwab K, et al. Bioavailability in effect-directed analysis of organic toxicants in sediments [J]. Trac-Trends in Analytical Chemistry, 2009, 28(5): 543-549
[55] Schwab K, Altenburger R, Luebcke-von Varel U, et al. Effect-directed analysis of sediment-associated algal toxicants at selected hot spots in the River Elbe basin with a special focus on bioaccessibility [J]. Environmental Toxicology and Chemistry, 2009, 28(7): 1506-1517
[56] Birch H, Gouliarmou V, Lutzhoft H-C H, et al. Passive dosing to determine the speciation of hydrophobic organic chemicals in aqueous samples [J]. Analytical Chemistry, 2010, 82(3): 1142-1146
[57] Hawker D W, Connell D W. Octanol water partition-coefficients of polychlorinated biphenyl congeners [J]. Environmental Science & Technology, 1988, 22(4): 382-387
[58] Yang Z Y, Zeng E Y, Xia H, et al. Application of a static solid-phase microextraction procedure combined with liquid-liquid extraction to determine poly(dimethyl)siloxane-water partition coefficients for selected polychlorinated biphenyls [J]. Journal of Chromatography A, 2006, 1116(1-2): 240-247
[59] Yang Z Y, Zhao Y Y, Tao F M, et al. Physical origin for the nonlinear sorption of very hydrophobic organic chemicals in a membrane-like polymer film [J]. Chemosphere, 2007, 69(10): 1518-1524
[60] Gerofke A, Komp P, McLachlan M S. Stir bar contamination: A method to establish and maintain constant water concentrations of poorly water-soluble chemicals in bioconcentration experiments [J]. Water Research, 2004, 38: 3411-3419
◆
Application of Passive Dosing in Aquatic Ecological Risk Assessment: A Case Study of Measuring Partition Coefficients of Polychlorinated Biphenyls
Qi Hongxue1,2, Li Huizhen1, You Jing1,*
1. State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Science, Guangzhou 510640, China 2. University of Chinese Academy of Science, Beijing 100049, China
24 December 2014 accepted 23 January 2015
To conduct aquatic ecological risk assessment, credible toxicity data are required, and maintaining stable water concentrations of test contaminants for certain time are the premises of accurate data. Solvent dosing has been conventionally used in aquatic toxicity testing with hydrophobic organic contaminants (HOCs), however, continuous reduction in chemical concentrations in water was frequently observed due to volatilization and degradation of chemicals, glassware binding and uptake by organisms. As a consequence, it is hard to achieve accurate concentration-response relationships for test HOCs. To overcome these problems, passive dosing has been recently introduced as a replacement of solvent dosing. Through the equilibrium partitioning of chemicals within dosing systems, HOCs’ concentrations in water could be stabilized and monitored by quantifying chemical concentration in polymers. The definition and material selection of passive dosing are introduced and the recent applications of this method in ecological risk assessment are summarized, including the measurements of chemical partition coefficients, in vitro cell assays, in vivo bioassays, and sediment toxicity evaluation. Then, the procedures of passive dosing are detailed using a case study of measuring partition coefficients of polychlorinated biphenyls between polydimethylsiloxane and water. Lastly, the perspective of passive dosing in aquatic ecological risk assessment is discussed.
passive doing; polychlorinated biphenyls; aquatic toxicity testing; hydrophobic organic contaminants
国家自然科学基金(41473106; 41273120)
祁红学(1981-),男,博士研究生,研究方向为生态毒理学,E-mail: qihx@gig.ac.cn;
*通讯作者(Corresponding author), E-mail: youjing@gig.ac.cn
10.7524/AJE.1673-5897.20141224001
2014-12-24 录用日期:2015-01-23
1673-5897(2015)2-45-11
X171.5
A
游静(1974-),女,分析化学博士,研究员,主要研究方向为沉积物生态风险评价,发表学术论文80余篇。
祁红学, 李慧珍, 游静. 被动加标在水生生态风险评价中的应用——以多氯联苯分配系数的测定为例[J]. 生态毒理学报, 2015, 10(2): 45-55
Qi H X, Li H Z, You J. Application of passive dosing in aquatic ecological risk assessment: A case study of measuring partition coefficients of polychlorinated biphenyls [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 45-55 (in Chinese)
