水生生物急性毒性QSAR模型研究进展
2015-06-05刘羽晨乔显亮
刘羽晨,乔显亮
大连理工大学环境学院 工业生态与环境工程教育部重点实验室,大连 116024
水生生物急性毒性QSAR模型研究进展
刘羽晨,乔显亮*
大连理工大学环境学院 工业生态与环境工程教育部重点实验室,大连 116024
化学品污染对人类健康和生态环境造成潜在风险。但是,危害性信息缺失是进行化学品风险评价的主要挑战。经济合作与发展组织(OECD)和美国环保署都提倡用非动物实验替代方法来弥补数据缺失。定量结构-活性关系(QSAR)被认为是一种有应用前景的替代技术。水生生物急性毒性是化学品风险评估和优先污染物筛选中最常用的参数之一。但是,目前可获得的实验毒性数据非常有限。本文总结了近年来发展的急性毒性预测模型,包括:(1)基于同类化合物建模;(2)基于数理统计建模;(3)基于化合物毒性作用模式建模。从模型预测能力、应用域、机理解释等角度对这3类模型进行了比较。其中,基于作用模式构建的模型一般具有较好的预测性能,并有助于机理解释,将是今后水生生物急性毒性预测的发展方向。
定量结构-活性关系(QSAR);水生生物急性毒性;作用模式
目前,美国化学文摘社(Chemical Abstracts Service, CAS)数据库中的化学品约有9 108万种[1],其中绝大多数是人为合成的有机物,这些物质在人类生产、生活中产生了众多有益影响,同时也对人类健康和环境造成了巨大威胁。2006年12月18日,欧盟通过立法发布了REACH法规[2](Registration, Evaluation, Authorization and Restriction of Chemicals),该法规要求进入欧盟市场的所有化学品需要进行预防性管理,并计划对进入欧盟市场的每年超过1 t的化学品进行毒性评估。然而,这项任务面临着巨大的挑战,一方面目前的化学品信息非常缺失[3-4],例如根据欧盟商品化的化学品清单,既有化学品和新化学品总数已达132 119种,但仅有2 198种化学品具有实验测试的急性毒性数据[5]。另一方面,传统的测试方法耗费大量的人力物力[6-7],从2001年至2005年,欧盟依据REACH法规在化学品毒理学测试中约花费16亿欧元[8]。因此,欧盟和美国都提倡采用一些预测技术如定量结构-活性关系(QSAR)和交互比对(Read-Across)等方法来弥补化学品管理中的数据缺失[9]。
QSAR能够通过计算化学品的特征参数来预测化学品理化性质、毒理学效应。其理论依据是分子结构与有机物的理化性质、环境中的迁移转化行为和毒理学效应是有内在联系的,而这种联系是可以被认识、表征并应用的[10]。运用QSAR可以对现有和尚未投入使用的化学品的相关性质参数进行预测和评价,有助于化学品的管理以及对污染的预先防范[11]。经济合作与发展组织(OECD)于2007年提出了QSAR模型发展和使用准则[12]:(1)有明确定义的环境(活性)指标;(2)有明确的算法;(3)能够定义模型的应用域;(4)有适当的拟合度、稳定性和预测能力;(5)最好能够进行机理解释。符合该准则的QSAR模型可以应用于化学品风险评价、筛选和优先控制等管理。该准则的提出为QSAR模型的构建和使用指明了方向。
化学品对水生生物的毒性信息被作为化学品风险评估和优先污染物筛选的关键指标之一。鱼类(如黑头呆鱼(Pimephales promelas))、水蚤类(如大型蚤(Daphnia magana))、纤毛虫类(如梨形四膜虫(Tetrahymena pyriformis))、藻类(如斜生栅列藻(Scenedesmus obliquus))等作为不同营养级的代表性水生生物常被用于急性毒性研究,一般采用半数致死浓度(LC50)和半数效应浓度(EC50)作为毒性终点。基于目前数据库和文献中的急性毒性实验数据,前人运用不同类别的分子描述符和算法构建了一系列QSAR模型[13-16]。目前,水生生物急性毒性QSAR模型主要可以分为3类:(1)基于同类化合物构建的模型;(2)基于数理统计构建的模型;(3)基于化合物毒性作用模式分类构建的模型。下面将针对这3类模型进行分别介绍。
1 基于同类化合物构建模型
将结构相似的同类化合物作为训练集来建模在水生生物急性毒性QSAR模型中较为常见(见表1)。鱼类的模型如卤代苯类[17]、三唑类[18]、丙烯酸类[19]等。大型蚤的模型如多环芳烃类[20]、三唑类[21]、有机磷酸酯类[22]、苯甲酸类[23]等。纤毛虫类的模型如芳香醛类[24]、环氧化合物类[25]等。藻类的模型如卤代芳香族化合物[26]、腈类[27]、季胺类[28]等。这类模型主要包含一些毒性较大,受到广泛关注的化合物。模型中的实验数据通常实验条件相同或相近,受实验条件差异而导致的数据不确定性的影响较小。此外,同类化合物一般具有相同的毒性作用机制,化合物的结构特征明显,易于提取特征结构信息来建立模型。因此这类模型通常预测较准确,简单透明,描述符较少,有些只需疏水性描述符或电子描述符,如Wang等[29]运用疏水性描述符建立全氟羧酸对发光菌的毒性QSAR模型,模型回归系数较高。这类模型利于理解化合物结构和毒性作用的关系,提高模型使用的可信度,其不足是覆盖的化合物种类太少,应用域都比较窄,预测应用受到一定限制。另外,同类化合物也会包含不同的取代基团,往往会导致化合物的毒性产生差异。Song等[30]研究了6种萘醌类化合物对大型蚤的急性毒性,结果表明由于化合物的疏水性不同,使其毒性差异非常大,导致毒性类别也不尽相同。Zhang等[31]研究发现丙烯酸酯类化合物上的烷基取代基能使其毒性降低,使得丙烯酸酯类化合物并不都表现出过量毒性。因此,基于同类化合物建模不仅存在应用域小的限制,而且由于同类化合物的结构差异也给模型构建和预测带来一些挑战。

表1 基于同类化合物构建的QSAR模型Table 1 QSAR models for chemical classes
注:n,验证集化合物个数;N,描述符个数;R2,回归系数。
Note: n, number of chemicals; N, number of descriptors; R2, the squared correlation coefficient.
2 基于数理统计构建模型
基于数理统计构建的模型通常将多种类别化合物一起建模,通过不同的算法来得到拟合度较好的模型。这种建模方法一定程度上解决了基于同类化合物建模方法中应用域较窄的问题。表2列出了近几年发表的基于数理统计构建的水生生物急性毒性模型。从表中可以看出,这些模型的数据集较大,但有些模型参数并不是很理想,如Kar和Ray[35]选取了297个化合物的大型蚤急性毒性数据,使用了12个2D、3D描述符,回归系数R2仅为0.738。Tao等[36]采用碎片常数法对217个化合物建模,虽然回归系数高达0.97,但该方法选取了103个分子碎片和21个结构修正因子,模型较复杂,不便于预测应用。随着一些机器学习类算法的引入,人工智能类模型被应用于QSAR建模。Niculescu等[37]运用概率神经网络算法建立大型蚤急性毒性的QSAR模型,模型的预测能力较好,回归系数达0.85。基于机器学习的方法构建的模型虽然具有较好的拟合度,但模型算法和形式不够透明,机理解释性较差,会影响到结果的可信度和可接受程度,在一定程度上违背了OECD关于QSAR模型构建和使用准则的要求。
3 基于化合物毒性作用模式分类构建模型
McFarland[41]研究认为,化合物的毒性主要与其进入生物膜的穿透能力和与作用位点的相互作用有关。不同化合物对不同受试生物的毒性大小和毒性机制会存在差异。前文介绍的两类模型主要考虑到化合物本身的结构与毒性的关系,并没有考虑到有机物与生物受体之间作用关系对毒性的影响,显然是不够全面的。因此一些研究者尝试基于毒性作用模式(mode of action, MOA)来构建模型。应用这一方法建模不仅依据化合物结构,还要考虑到化合物与生物受体之间的作用,一般需要先根据化合物结构特征和毒性反应机理对化合物进行机制分类,再构建模型。这类建模方法,一定程度上体现了OECD对QSAR构建模型关于机理域的要求[12],即具有相同毒性机制的化合物可以组成训练集构建模型,预测集化合物的毒性作用机理应该与训练集化合物一致才能得到良好的预测结果。
3.1 毒性作用模式
认识毒性作用模式是建立毒理学效应QSAR模型的基础和前提。目前一些研究者对毒性作用模式进行了研究,提出了几种分类方法(见表3)。McKim等[42]选取彩虹鱼为受试生物,测试了多种污染物对其毒性影响。通过对鱼的毒性反应进行统计分析,基于毒性作用模式将化合物分为6种,即非极性麻醉剂、极性麻醉剂、氧化磷酸化解偶联剂、呼吸抑制剂、乙酰胆碱酶抑制剂和中枢神经系统控制剂。Verhaar等[3,43-45]根据毒性作用模式将化合物分为4类,分别为惰性化学物质、亚惰性化学物质、活性化学物质、特殊反应化学物质,认为4种作用模式与不同的结构类别有关,并提出了详细的分类规则。Russom等[46]以鱼类96 h- LC50值为毒性终点,通过剂量-反应关系、联合毒性反应研究、鱼类急性毒性综合症(FATS)等,提出了8种毒性作用模式,总结了相应的分类规则,并根据化合物所含的数据信息对各作用模式分类设置了置信度。Nendza和Wenzel[47]提出了9种机理,其中包括只与藻类有关的光合作用抑制和只与鱼类有关的雌激素活性。Nendza和Muller[48]运用体外成套测验(Battery test)方法将115种化合物按照这9种作用模式进行分类,并从化合物描述符的角度尝试对化合物分类,最终通过13个描述符用逐步判别分析的方法正确的将103个化合物分类,并认为基于描述符的判别标准能够用于作用模式下QSAR的预测和使用。
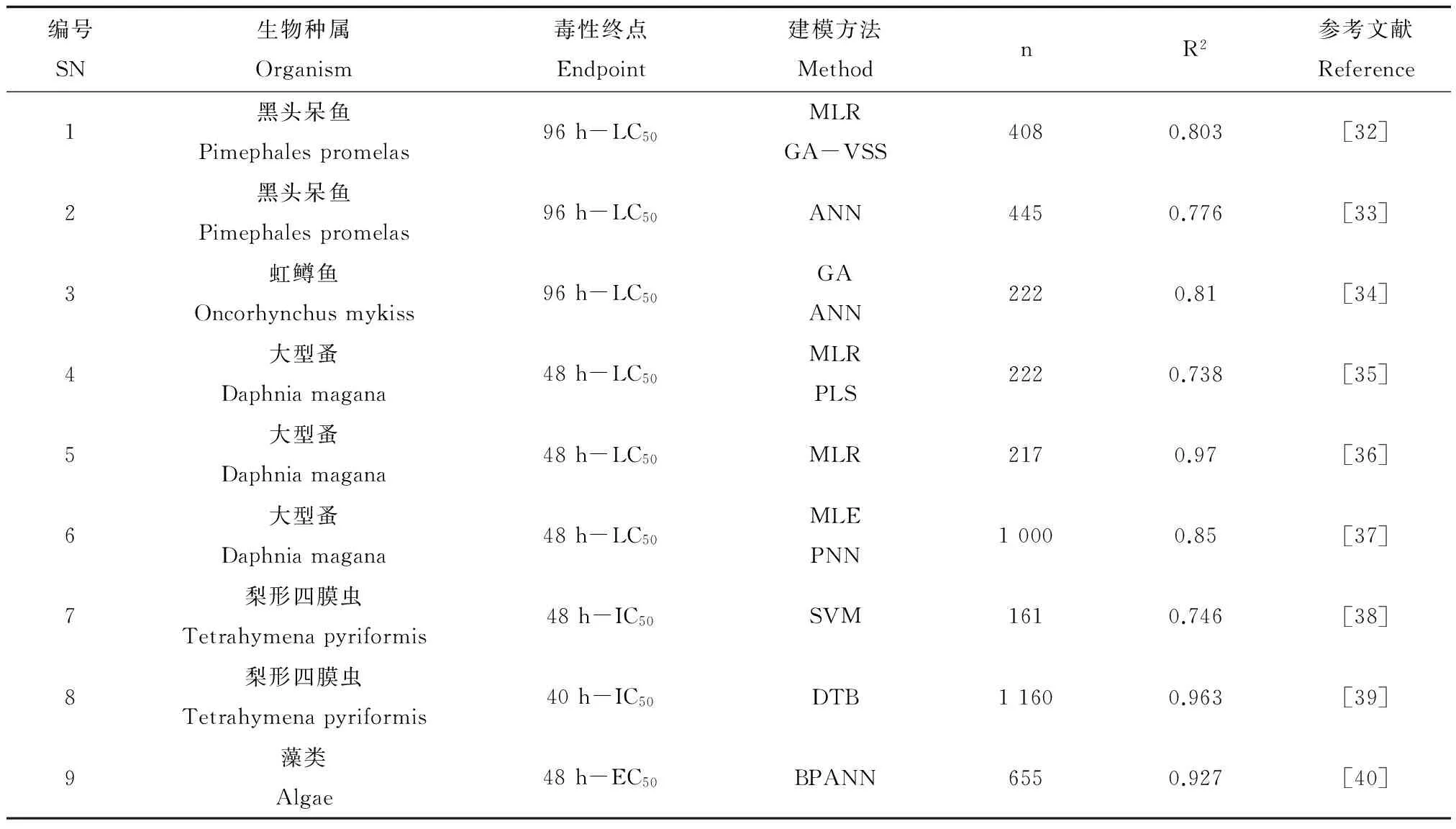
表2 基于数理统计构建的QSAR模型Table 2 Statistically derived QSAR models
注:LC50,半数致死浓度;EC50,半数效应浓度;IC50,半数抑制浓度;MLR,多元线性回归;GA,遗传算法;VSS,变量子集选择;ANN,人工神经网络;PLS,偏最小二乘;MLE,极大似然估计;PNN,概率神经网络;SVM,支持向量机;DTB,决策树;BPANN,反向传播人工神经网络。
Note: LC50, Median lethal concentration; EC50, Median effective concentration; IC50, Median inhibitory concentration; MLR, Multiple linear regression; GA, Genetic algorithm; VSS, Variable subset selection; ANN, Artificial neural network; PLS, Partial least squares; MLE, Maximum likelihood estimation; PNN, Probabilistic neural network; SVM, Support vector machine; DTB, Decision treeboost; BPANN, Back-propagation artificial neural network.
尽管不同研究者提出的毒性作用模式的类别有差异,但整体上可分为麻醉剂类和其他反应模式。麻醉剂作用模式被认为是基本的或是最弱的效应,又称基线毒性,其他反应模式毒性大于麻醉剂类毒性,称为过量毒性。可以采用Kow预测的有机物基线毒性值与毒性实验值的毒性比(toxic ratio)来区分基线毒性和过量毒性,一般认为毒性比>10可以作为过量毒性。von der Ohe等[49]以大型蚤急性毒性数据作为毒性终点,以化合物结构警示(structural alerts)作为判定规则提出了3种方法来区分过量毒性和麻醉剂。由于3种方法对麻醉剂化合物和过量毒性化合物的预测能力上各有优势,所以建议将3种方法联合使用来进行分类。Nendza等[50]综合了化合物结构和物理化学性质提出了一种区分基线毒性和过量毒性的判定规则,能够较准确的识别基线毒性化合物。
3.2 基于毒性作用模式的QSAR模型
目前,基于毒性作用模式分类构建了一些QSAR模型[44,51-54]。其中Verhaar[43]提出的分类方法使用较多[44,51-53]。这些模型中,非极性麻醉剂和极性麻醉剂类模型回归效果较好(见表4),原因在于这类化合物与机体中特殊的受体没有相互作用,毒性的大小主要取决于化合物的疏水性,在建模时仅用疏水性参数(如辛醇水分配系数,Kow)便可得到拟合度较好的模型[55-57]。极性麻醉剂能够提供氢键供体,产生的毒性比非极性麻醉剂毒性略大,因此,增加描述产生氢键能力的描述符(如最低空轨道能,ELUMO)后,模型的拟合度得到提升[58]。对于活性化合物和特殊反应类化合物2类模型拟合效果并不理想,原因在于毒性作用复杂,包括的反应机制很多,如活性化合物还包含迈克尔加成反应,亲核取代反应等反应类型。另外,还有一些化合物无法根据Verhaar方法进行分类,仍需进一步的研究来使得化合物的分类规则更准确和系统。Bearden和Schultz[54]将化合物分为非极性麻醉剂、极性麻醉剂、弱酸呼吸解偶联剂、软亲电试剂、亲电试剂,对黑头呆鱼和梨形四膜虫进行了模型构建(表4)。虽然分类方法不尽相同,但模型的整体体现与基于Verhaar分类所构建的模型很相似。对于非极性麻醉剂、极性麻醉剂采用log Kow就可以得到良好的模型,其他3类化合物需要引入其他描述符才能得到较优的模型。
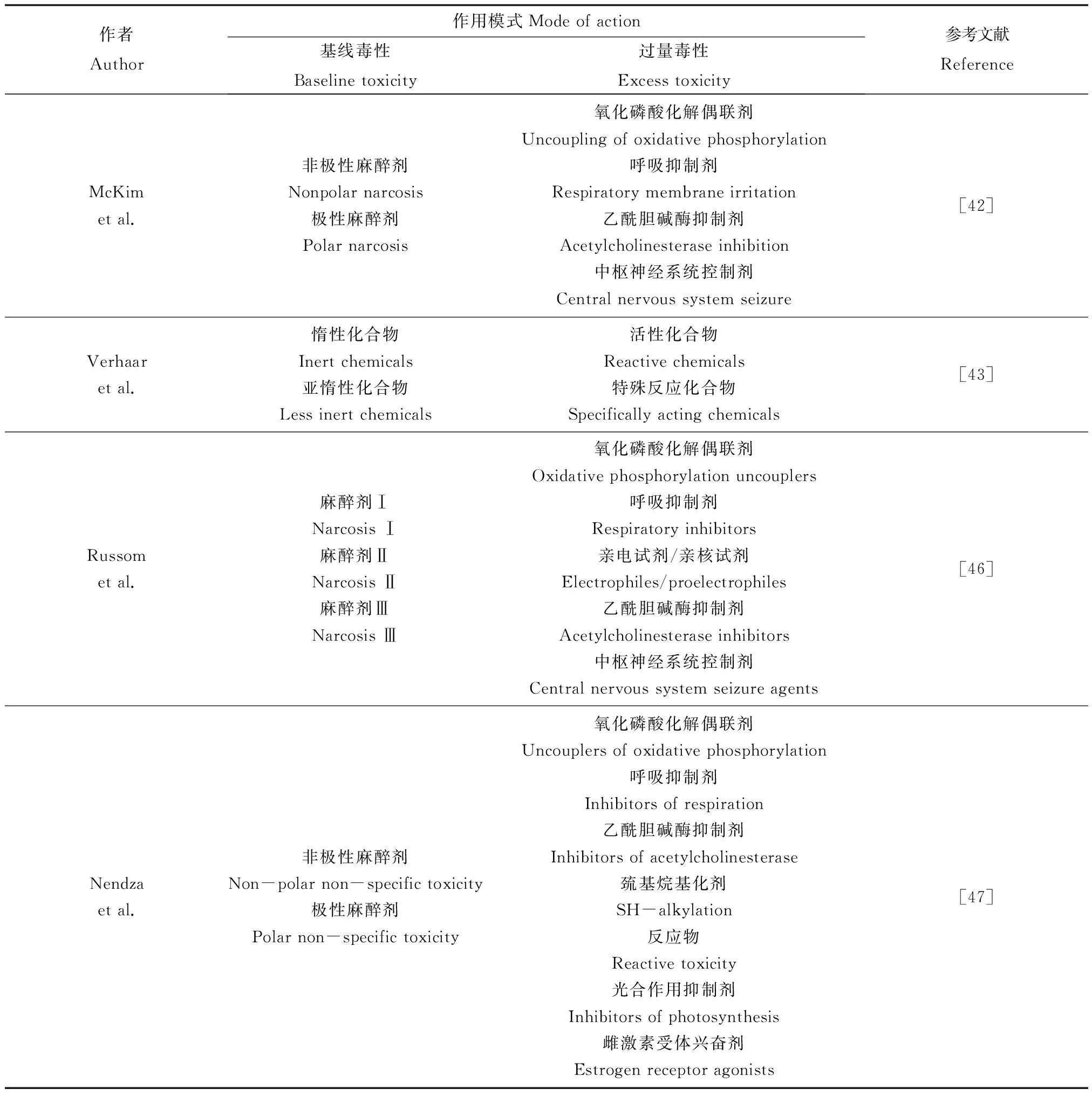
表3 毒性作用模式Table 3 Mode of action
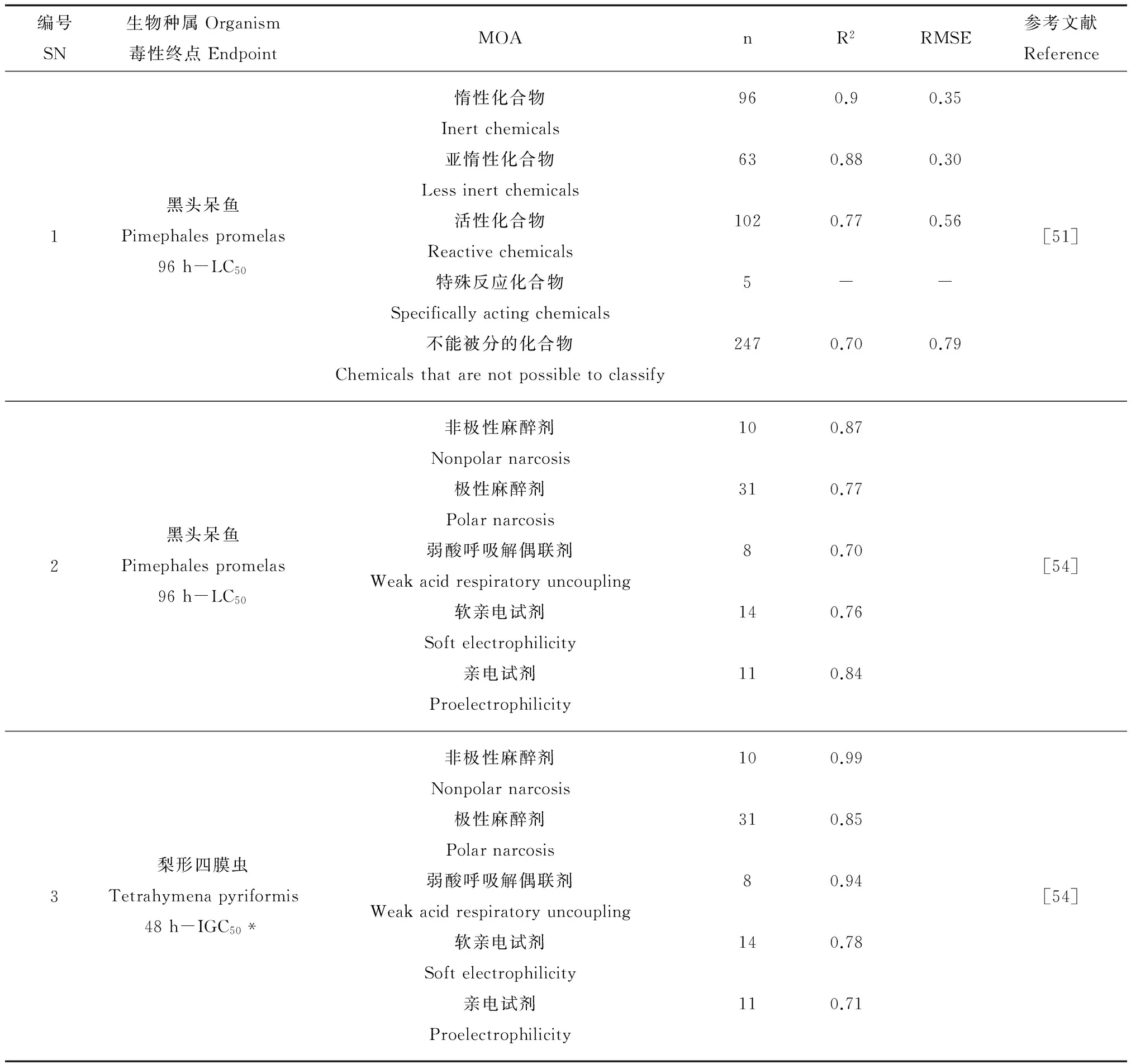
表4 基于毒性作用模式的QSAR模型Table 4 QSAR models for mode of action
注:IGC50为半数生长抑制浓度。
Note: IGC50represents median inhibitory growth concentration.
目前,有些毒性作用模式分类方法,因其分类规则较复杂,在QSAR建模中的应用还比较少。将毒性作用机制与其化合物结构建立联系会一定程度上提高其可操作性。但是,结构相似的化合物毒性作用模式也会存在差别,如拥有相同的子结构(substructure)的化合物仍会表现出不同的毒性机制。有研究者基于统计学方法从描述符角度对化合物毒性作用模式进行表征和分类[48,59-60]。如Aptula等[59]基于结构将221个酚类化合物分为四类,运用逐步线性判别分析方法来表征不同描述符对各类别化合物的影响,以实现基于描述符来划分具有不同毒性机制的化合物,划分的准确率可以达到86%~89%。尽管基于描述符进行化合物分类具有较好的操作性,但仍有一些化合物不能准确的区分。如Ren[60]运用判别分析方法对化合物进行分类,发现对极性麻醉剂和亲电试剂区分比较困难。
有研究者尝试运用定量活性-活性关系(QAAR)对不同物种进行分析建模。该方法需要根据两种生物之间的实验数据建立相关性模型,以实现种间毒性数据的预测。研究不同物种的种间毒性关系,可以用一种生物的毒性来估计其他物种的毒性,寻找替代的测试生物以减少动物实验,同时还有助于认识化合物的毒性作用机制。Zhang等[61]研究表明,海洋细菌和淡水细菌的种间关系较好,不同鱼类之间也表现出较好的种间关系。另外,结构相似的同类化合物对不同物种间也表现出较好的相关性,如有机磷酸酯类化合物对大型蚤和鲤鱼[22],苯三唑类化合物对大型蚤和虹鳟鱼[62],醛类对黑头呆鱼和梨形四膜虫[63]都表现出较好的相关性。但对于多种类化合物,不同化合物对不同物种的毒性大小和作用机制不尽相同。Tremolada等[64]较系统的研究了不同生物种间的毒性关系,研究表明不同种类鱼之间的毒性相关性较好;若将有特殊反应的化合物(有机磷农药和氨基甲酸酯)除去后,在大型蚤与鱼类之间也得到了较好的种间毒性关系;而绿藻与大型蚤和鱼类之间在毒性效应上表现出更多的差异。Lessigiarska等[65]对藻类、大型蚤和鱼类种间关系做了研究,发现在斑马鱼和羊角月牙藻、大型蚤和彩虹鱼之间模型的回归系数分别为0.674和0.665,其余6个种间关系模型并没有表现出较好的回归系数。Zhang等[31]研究表明,在大型蚤和梨形四膜虫之间,醇类、酮类、酯类等化合物的毒性机制种间较为一致,苯胺及其衍生物的种间毒性差异显著。这说明虽然不同生物之间存在一些相似的毒性机制,但是这种种间的一致性并不具有通用性,应用这种方法预测特别需要关注种间可能存在的差异性。
综上,前人基于毒性作用模式建模取得一些进展,其中水生生物急性毒性麻醉类化合物模型性能较好,而对具有反应活性化合物的QSAR建模仍存在一定的困难。原因在于这类化合物毒性作用机制相互交叉,作用模式分类复杂。为了降低毒性作用模式分类的复杂性,研究者们采取了一些方法来进行毒性作用模式分类和化合物毒性的预测,但都有各自的优势和局限。有关毒性分类方法有待进一步的研究。例如,可以将不同毒性分类方法整合,保留其共性和各自的优势,并将毒性机制通过相关的分子结构参数来进行表征,提高毒性分类方法的可操作性和统一性,以便于在模型构建中进行应用。
4 结 语
尽管目前已有较多水生生物急性毒性的QSAR模型,但很多模型存在自身的局限性,不太符合OECD提出的QSAR模型建立和使用准则。基于同类化合物构建的模型,一般拟合能力较好,但存在应用域较窄的限制。基于数理统计构建的涵盖多类化合物的模型,应用域有所拓展,但会存在模型性能较差或算法不透明等问题。基于作用模式对化合物进行分类建模,一方面具有较为明确的模型应用域和较好的预测能力,同时易于进行机理解释,将是今后构建水生生物急性毒性QSAR模型的主要方向。从目前所建的模型来看,麻醉毒性机制较为明确,模型拟合效果较好。过量毒性的毒性反应机制非常复杂,分类方法不太统一,给过量毒性化合物的模型构建带来一定的挑战。后续的研究需要在毒性作用机制研究的基础上,将多种毒性作用分类方法进行整合,以提高分类规则的可操作性和统一性,为过量毒性的化学物QSAR模型的构建奠定基础。
[1] 美国化学文摘社[OL]. [2014-10-30]. http://www.cas.org/
[2] European Parliament and Council Regulation (EC) No 1907/2006 Commission of the European Communities 2006. Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. Off. J. Eur. Union, L396/1 of 30.12.2006 [R/OL]. [2014-10-30]. http://publications.europa.eu
[3] Verhaar H J M, Solbe J, Speksnijder J, et al. Classifying environmental pollutants: Part 3. External validation of the classification system [J]. Chemosphere, 2000, 40(8): 875-883
[4] Allanou R, Hansen B G, Van der Bilt Y. PublicAvailability of Data on EU High Production Volume Chemicals[M]. European Commission, 1999
[5] Strempel S, Scheringer M, Ng C A, et al. Screening for PBT Chemicals among the "Existing" and "New" Chemicals of the EU [J]. Environmental Science & Technology, 2012, 46(11): 5680-5687
[6] Taylor K, Stengel W, Casalegno C, et al. Experiences of the REACH testing proposals system to reduce animal testing [J]. ALTEX, 2014, 31(2): 107-128
[7] Rovida C, Hartung T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-A report by the transatlantic think tank for toxicology (t(4)) [J]. ALTEX, 2009, 26(3): 187-208
[8] Hartung T, Rovida C. Chemical regulators have overreached [J]. Nature, 2009, 460(7259): 1080-1081
[9] Daginnus K. Characterisation of the REACH pre-registered substances list by chemical structure and physicochemical properties [M]. European Commission, Joint Research Centre, 2010
[10] 陈景文, 李雪花, 于海瀛, 等. 面向毒害有机物生态风险评价的(Q)SAR技术: 进展与展望[J]. 中国科学: B辑, 2008, 38(6): 461-474
Chen J W, Li X H, Yu H Y, et al. (Q)SAR technologies oriented to the ecological risk assessment of hazardous organic chemicals: Advances and perspective [J]. Science in China: B, 2008, 38(6): 461-474 (in Chinese)
[11] Tunkel J, Mayo K, Austin C, et al. Practical considerations on the use of predictive models for regulatory purposes [J]. Environmental Science & Technology, 2005, 39(7): 2188-2199
[12] OECD (Organisation for Economic Co-Operation and Development). Guideline document on the validation of (quantitative) structure-activity relationships [(Q)SAR] models. ENV/JM/MONO(2007)2. [R]. Paris: OECD, 2007
[13] Lyakurwa F S, Yang X H, Li X H, et al. Development of in silico models for predicting LSER molecular parameters and for acute toxicity prediction to fathead minnow (Pimephales promelas) [J]. Chemosphere, 2014, 108: 17-25
[14] Moosus M, Maran U. Quantitative structure-activity relationship analysis of acute toxicity of diverse chemicals to Daphnia magna with whole molecule descriptors [J]. SAR and QSAR in Environmental Research, 2011, 22(7-8): 757-774
[15] Roberts D W, Roberts J F, Hodges G, et al. Aquatic toxicity of cationic surfactants to Daphnia magna [J]. SAR and QSAR in Environmental Research, 2013, 24(5): 417-427
[16] Asadollahi-Baboli M. Aquatic toxicity assessment of esters towards the Daphnia magna through PCA-ANFIS [J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(4): 450-454
[17] 冯子雅, 冯长君. 卤代苯对呆头鱼, 发光菌急性毒性的构效关系研究[J]. 广州化工, 2013, 41(6): 16-18
Feng Z Y, Feng C J. QSAR study on the acute toxicity of halogeno-benzene compounds to photobacterium phosphoreum and black pimephales by molecular shape indices [J]. Guangzhou Chemical Industry, 2013, 41(6): 16-18 (in Chinese)
[18] Ding F, Guo J, Song W H, et al. Comparative quantitative structure-activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish [J]. Chemistry and Ecology, 2011, 27(4): 359-368
[19] Furuhama A, Aoki Y, Shiraishi H. Development of ecotoxicity QSAR models based on partial charge descriptors for acrylate and related compounds [J]. SAR and QSAR in Environmental Research, 2012, 23(7-8): 731-749
[20] Al-Fahemi J H. The use of quantum-chemical descriptors for predicting the photoinduced toxicity of PAHs [J]. Journal of Molecular Modeling, 2012, 18(9): 4121-4129
[21] Cassani S, Kovarich S, Papa E, et al. Evaluation of CADASTER QSAR models for the aquatic toxicity of (Benzo)triazoles and prioritisation by consensus prediction [J]. Alternatives to Laboratory Animals: ATLA, 2013, 41(1): 49-64
[22] Zvinavashe E, Du T, Griff T, et al.Quantitative structure-activity relationship modeling of the toxicity of organothiophosphate pesticides to Daphnia magna and Cyprinus carpio [J]. Chemosphere, 2009, 75(11): 1531-1538
[23] Kamaya Y, Fukaya Y, Suzuki K. Acute toxicity of benzoic acids to the crustacean Daphnia magna [J]. Chemosphere, 2005, 59(2): 255-261
[24] Roy K, Das R N. QSTR with extended topochemical atom (ETA) indices. 14. QSAR modeling of toxicity of aromatic aldehydes to Tetrahymena pyriformis [J]. Journal of Hazardous Materials, 2010, 183(1): 913-922
[25] Schramm F, Muller A, Hammer H, et al. Epoxide and thiirane toxicity in vitro with the ciliates Tetrahymena pyriformis: Structural alerts indicating excess toxicity [J]. Environmental Science & Technology, 2011, 45(13): 5812-5819
[26] Zeng M, Lin Z F, Yin D Q, et al. A Kow-based QSAR model for predicting toxicity of halogenated benzenes to all algae regardless of species [J]. Bulletin of Environmental Contamination and Toxicology, 2011, 86(6): 565-570
[27] Huang C P, Wang Y J, Chen C Y. Toxicity and quantitative structure-activity relationships of nitriles based on Pseudokirchneriella subcapitata [J]. Ecotoxicology and Environmental Safety, 2007, 67(3): 439-446
[28] Jing G H, Zhou Z M, Zhuo J. Quantitative structure-activity relationship (QSAR) study of toxicity of quaternary ammonium compounds on Chlorella pyrenoidosa and Scenedesmus quadricauda [J]. Chemosphere, 2012, 86(1): 76-82
[29] Wang T, Zhou X H, Wang D L, et al. Using molecular docking between organic chemicals and lipid membrane to revise the well known octanol-water partition coefficient of the mixture [J]. Environmental Toxicology and Pharmacology, 2012, 34(1): 59-66
[30] Song W H, Guo J, Ding F, et al. Study on acute toxicity and structure-activity relationship of Daphnia magna exposed to naphthoquinones [J]. Environmental Toxicology and Pharmacology, 2011, 32(1): 102-106
[31] Zhang X J, Qin W C, He J, et al. Discrimination of excess toxicity from narcotic effect: Comparison of toxicity of class-based organic chemicals to Daphnia magna and Tetrahymena pyriformis [J]. Chemosphere, 2013, 93(2): 397-407
[32] Pavan M, Netzeva T I, Worth A P. Validation of a QSAR model for acute toxicity [J]. SAR and QSAR in Environmental Research, 2006, 17(2): 147-171
[33] In Y, Lee S K, Kim P J, et al. Prediction of acute toxicity to fathead minnow by local model based QSAR and global QSAR approaches [J]. Bulletin of the Korean Chemical Society, 2012, 33(2): 613-619
[34] Mazzatorta P, Smiesko M, Lo Piparo E, et al.QSAR model for predicting pesticide aquatic toxicity [J]. Journal of Chemical Information and Modeling, 2005, 45(6): 1767-1774
[35] Kar S, Roy K. QSAR modeling of toxicity of diverse organic chemicals to Daphnia magna using 2D and 3D descriptors [J]. Journal of Hazardous Materials, 2010, 177(1-3): 344-351
[36] Tao S, Xi X H, Xu F L, et al. A fragment constant QSAR model for evaluating the EC50values of organic chemicals to Daphnia magna [J]. Environmental Pollution, 2002, 116(1): 57-64
[37] Niculescu S P, Lewis M A, Tigner J. Probabilistic neural networks modeling of the 48 h- LC50acute toxicity endpoint to Daphnia magna [J]. SAR and QSAR in Environmental Research, 2008, 19(7-8): 735-750
[38] Panaye A, Fan B T, Doucet J P, et al. Quantitative structure-toxicity relationships (QSTRs): A comparative study of various non linear methods. General regression neural network, radial basis function neural network and support vector machine in predicting toxicity of nitro- and cyano- aromatics to Tetrahymena pyriformis [J]. SAR and QSAR in Environmental Research, 2006, 17(1): 75-91
[39] Singh K P, Gupta S. In silico prediction of toxicity of non-congeneric industrial chemicals using ensemble learning based modeling approaches [J]. Toxicology and Applied Pharmacology, 2014, 275(3): 198-212
[40] Jin X Q, Jin M H, Sheng L X. Three dimensional quantitative structure-toxicity relationship modeling and prediction of acute toxicity for organic contaminants to algae [J]. Computers in Biology and Medicine, 2014, 51: 205-213
[41] McFarland J W. Parabolic relation between drug potency and hydrophobicity [J]. Journal of Medicinal Chemistry, 1970, 13(6): 1192-1196
[42] Mckim J M, Bradbury S P, Niemi G J. Fish acute toxicity syndromes and their use in the QSAR approach to hazard assessment [J]. Environmental Health Perspectives, 1987, 71: 171-186
[43] Verhaar H J M, Vanleeuwen C J, Hermens J L M. Classifying Environmental-Pollutants .1. Structure-Activity-Relationships for Prediction of Aquatic Toxicity [J]. Chemosphere, 1992, 25(4): 471-491
[44] Verhaar H J M, Ramos E U, Hermens J L M. Classifying environmental pollutants .2. Separation of class 1 (baseline toxicity) and class 2 ('polar narcosis') type compounds based on chemical descriptors [J]. Journal of Chemometrics, 1996, 10(2): 149-162
[45] Enoch S J, Hewitt M, Cronin M T D, et al. Classification of chemicals according to mechanism of aquatic toxicity: An evaluation of the implementation of the Verhaar scheme in Toxtree [J]. Chemosphere, 2008, 73(3): 243-248
[46] Russom C L, Bradbury S P, Broderius S J, et al. Predicting modes of toxic action from chemical structure: Acute toxicity in the fathead minnow (Pimephales promelas) [J]. Environmental Toxicology and Chemistry, 1997, 16(5): 948-967
[47] Nendza M, Wenzel A. Discriminating toxicant classes by mode of action-1. (Eco)toxicity profiles [J]. Environmental Science and Pollution Research, 2006, 13(3): 192-203
[48] Nendza M, Muller M. Discriminating toxicant classes by mode of action: 2. Physico-chemical descriptors [J]. QSAR-Quantitative Structure Activity Relationships, 2000, 19(6): 581-598
[49] von der Ohe P C, Kuhne R, Ebert R U, et al. Structural alerts-A new classification model to discriminate excess toxicity from narcotic effect levels of organic compounds in the acute daphnid assay [J]. Chemical Research in Toxicology, 2005, 18(3): 536-555
[50] Nendza M, Muller M, Wenzel A. Discriminating toxicant classes by mode of action: 4. Baseline and excess toxicity [J]. SAR and QSAR in Environmental Research, 2014, 25(5): 393-405
[51] Lyakurwa F S, Yang X H, Li X H, et al. Development and validation of theoretical linear solvation energy relationship models for toxicity prediction to fathead minnow (Pimephales promelas) [J]. Chemosphere, 2014, 96: 188-194
[52] Papa E, Villa F, Gramatica P. Statistically validated QSARs, based on theoretical descriptors, for modeling aquatic toxicity of organic chemicals in Pimephales promelas (fathead minnow) [J]. Journal of Chemical Information and Modeling, 2005, 45(5): 1256-1266
[53] Katritzky A R, Tatham D B, Maran U. Theoretical descriptors for the correlation of aquatic toxicity of environmental pollutants by quantitative structure-toxicity relationships [J]. Journal of Chemical Information and Computer Sciences, 2001, 41(5): 1162-1176
[54] Bearden A P, Schultz T W. Structure-activity relationships for Pimephales and Tetrahymena: A mechanism of action approach [J]. Environmental Toxicology and Chemistry, 1997, 16(6): 1311-1317
[55] Worgan A D, Dearden J C, Edwards R, et al. Evaluation of a novel short-term algal toxicity assay by the development of QSARs and inter-species relationships for narcotic chemicals [J]. QSAR & Combinatorial Science, 2003, 22(2): 204-209
[56] Roberts D W, Costello J F. Mechanisms of action for general and polar narcosis: A difference in dimension [J]. QSAR & Combinatorial Science, 2003, 22(2): 226-233
[57] Pavan M, Worth A, Netzeva T. Preliminary Analysis of an Aquatic Toxicity Dataset and Assessment of QSAR Models for Narcosis [R]. European Commission, 2005
[58] Lee Y G, Hwang S H, Kim S D. Predicting the toxicity of substituted phenols to aquatic species and its changes in the stream and effluent waters [J]. Archives of Environmental Contamination and Toxicology, 2006, 50(2): 213-219
[59] Aptula A O, Netzeva T I, Valkova I V, et al. Multivariate discrimination between modes of toxic action of phenols [J]. Quantitative Structure-Activity Relationships, 2002, 21(1): 12-22
[60] Ren S. Determining the mechanisms of toxic action of phenols to Tetrahymena pyriformis [J]. Environmental Toxicology, 2002, 17(2): 119-127
[61] Zhang X J, Qin H W, Su L M, et al. Interspecies correlations of toxicity to eight aquatic organisms: Theoretical considerations [J]. Science of the Total Environment, 2010, 408(20): 4549-4555
[62] Cassani S, Kovarich S, Papa E, et al. Daphnia and fish toxicity of (benzo) triazoles: Validated QSAR models, and interspecies quantitative activity-activity modelling [J]. Journal of Hazardous Materials, 2013, 258: 50-60
[63] Dimitrov S, Koleva Y, Schultz T W, et al. Interspecies quantitative structure-activity relationship model for aldehydes: Aquatic toxicity [J]. Environmental Toxicology and Chemistry, 2004, 23(2): 463-470
[64] Tremolada P, Finizio A, Villa S, et al. Quantitative inter-specific chemical activity relationships of pesticides in the aquatic environment [J]. Aquatic Toxicology, 2004, 67(1): 87-103
[65] Lessigiarska I, Worth A, Sokull-Klüttgen B, et al. QSAR investigation of a large data set for fish, algae and Daphnia toxicity [J]. SAR and QSAR in Environmental Research, 2004, 15(5-6): 413-431
◆
Progress in Quantitative Structure-Activity Relationship Models for Acute Aquatic Toxicity
Liu Yuchen, Qiao Xianliang*
Key Laboratory of Industrial Ecology and Environmental Engineering of Ministry of Education, Department of Environmental Science and Technology, Dalian University of Technology, Dalian 116024,China
22 November 2014 accepted 5 January 2015
Chemical contaminations lead potential risks to both human health and ecological environment. However, the lack of available data on the hazardous properties of chemicals is the major challenge for the risk assessment of chemicals. Non-animal alternative methods are encouraged to fill in data gaps by OECD and US EPA. Quantitative structure-activity relationship (QSAR) approach is regarded as one promising alternative technique. Information on acute toxicity to aquatic organisms are commonly used in the risk assessment and screening of priority substances. But, the available experimental toxicity data are very limited currently. In this paper, three types of prediction models of acute toxicity are summarized, including (1) models for particular chemical classes; (2) statistically derived models that are developed without an a priority mechanistic hypothesis; (3) models for a given mode or mechanism of action (MOA). The predictive ability, applicability domain and mechanism interpretation of the three type models are compared. QSAR models based on MOA, which generally demonstrate rather good predictive ability and facilitate the interpretation of mechanism meanwhile, will become the main trend for predicting acute toxicity to aquatic organisms.
QSAR; acute aquatic toxicity; mode of action
国家科技部863课题(2012AA06A301);国家自然科学基金面上项目(21277018);中央高校基本科研业务费专项(DUT14ZD213)
刘羽晨(1991-),女,硕士,研究方向为污染生态化学,E-mail: 286871921@qq.com;
*通讯作者(Corresponding author), E-mail: xlqiao@dlut.edu.cn
10.7524/AJE.1673-5897.20141122001
2014-11-22 录用日期:2015-01-05
1673-5897(2015)2-26-10
X171.5
A
乔显亮(1974-),男,博士,副教授,研究方向为污染生态化学。
刘羽晨, 乔显亮. 水生生物急性毒性QSAR模型研究进展[J]. 生态毒理学报, 2015, 10(2): 26-35
Liu Y C, Qiao X L. Progress in quantitative structure-activity relationship models for acute aquatic toxicity [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 26-35 (in Chinese)
