两种检测产ESBLs肺炎克雷伯菌方法的比较
2015-06-05吴佳学
张 健 吴佳学
(1.潍坊医学院,山东潍坊261053;2.临沂市人民医院,山东临沂276000)
两种检测产ESBLs肺炎克雷伯菌方法的比较
张 健1吴佳学2
(1.潍坊医学院,山东潍坊261053;2.临沂市人民医院,山东临沂276000)
目的比较产超广谱β-内酰胺酶(ESBL)肺炎克雷伯菌的表型鉴定方法,以及分析我院ESBLs肺炎克雷伯菌在各种临床标本的分布,初步筛选多重耐药菌,做出药物敏感性检测结果,为预防和控制多重耐药菌在医院内传播,提前给临床提供治疗依据。方法用双纸片协同试验和CLSI认证试验法检测产ESBLs肺炎克雷伯菌,比较两种方法的检出率。结果119株产ESBLs肺炎克雷伯菌在临床各种标本中被分离,其中痰标本最多,为76株,其他来源于分泌物标本16株和尿标本11株,脓标本为8株,血和胸腹水标本均为4株。这些病人在进行各种临床治疗措施中,静脉导管115例(96.6%)、留置导尿管的27例(22.7%)、气管插管10例(8.4%)、医疗器材穿刺9例(7.5%)等。用双纸片协同试验和CLSI认证试验确定的ESBLs的菌株分别为112株(94.1%)和118株(99.2%)。结论当没有分子生物学相关设备时,使用CLSI认证试验是非常有效的早期检测ESBLs肺炎克雷伯菌的方法。
肺炎克雷伯菌;ESBL;早期检测
多重耐药的革兰氏阴性杆菌引起的感染成为影响全球住院患者的重大威胁,而临床又缺乏有效的治疗依据供临床医生选择,使得治疗效果降低,临床治疗难度增加,相应地增加了患者死亡率,抗生素使用和住院的费用给患者带来经济负担[1]。病情危重的患者由于住院时间长,使用大量抗菌药物,导致感染病原体对抗菌药物产生耐药、多重耐药甚至泛耐药,成为医院感染暴发流行的潜在威胁,因此对患者进行多重耐药菌的早期筛查,快速、及时地筛选出多重耐药菌,做出药敏试验结果提供给临床医生,是降低医院感染率的重要举措,同时也对降低患者病死率起到非常重要的作用[2]。很多实验室推荐的体外检测ESBLs,最常用的方法包括双纸片协同试验、纸片扩散法和浓度梯度法,还有使用自动化仪器系统进行检测,还出现一些使用分子检测方法检测ESBLs的现象。本研究分析了产ESBLs肺炎克雷伯菌在临沂市人民医院各科室收集的各种临床标本的比率,以及比较双纸片协同试验和CLSI认证试验两种方法的筛选率,早期检测产ESBL肺炎克雷伯菌能有效的减少高发病率和死亡率。
1 材料与方法
1.1 菌株来源为2013年10月-2014年3月山东省临沂市人民医院各个科室住院患者送检标本中培养分离的119株产ESBLs肺炎克雷伯菌,剔除分离自同一患者的具有相同药敏结果的同一菌株。
1.2 质控菌株大肠埃希菌ATCC25922,肺炎克雷伯菌ATCC700603、ATCCBAA1705均购自于卫生部临床检验中心。
1.3 试剂与培养基头孢他啶(CAZ)、头孢曲松(CRO)、头孢噻肟(CTX)、氨曲南(ATM)、头孢他啶/克拉维酸(CAZ/CLA)、头孢噻肟/克拉维酸(CTX/CLA)、氨苄西林/克拉维酸(SAM)药敏纸片以及M-H琼脂培养基购自英国Oxoid公司。
1.4 方法
1.4.1 初筛试验纸片法:采用CLSI2014的M100-S20文件表2A的推荐方法,将浓度为107CFU/ml的受试菌液在M-H琼脂培养基上均匀涂布,贴头孢他啶(30 μg)、头孢噻肟(30 μg)、头孢曲松(30 μg)及氨曲南(30 μg)药敏片,37°C培养16~18 h,测量抑菌圈直径。若抑菌圈直径头孢他啶(30 μg)≤22 mm,头孢噻肟(30 μg)≤27 mm,头孢曲松(30 μg)≤25 mm,氨曲南(30 μg)≤27 mm,凡是能与以上四种抗生素任一种符合者作为筛选ESBLs肺炎克雷伯菌的依据。
1.4.2 确证实验使用双纸片协同试验和CLSI认证试验进一步筛选产ESBLs肺炎克雷伯菌。
1.4.2.1 双纸片协同试验将氨苄西林/克拉维酸(SAM)药敏纸片贴于M-H琼脂平板中间,头孢噻肟(30 μg)和头孢他啶(30 μg)贴于SAM的周围,与SAM纸片相距为20 mm,35°C孵育16~18 h。头孢他啶和头孢噻肟与氨苄西林/克拉维酸有协同作用的判断为ESBLs阳性株,否则为阴性,见图1。
1.4.2.2 CLSI认证试验采用CLSI2014的M100-S24中肺炎克雷伯菌ESBLs检测的筛选和确证试验推荐的方法,将头孢他啶(30 μg)、头孢噻肟(30 μg)、头孢他啶/克拉维酸(30 μg)、头孢噻肟/克拉维酸(30 μg)贴于M-H琼脂平板,35°C孵育16~18 h。测量抑菌圈直径,当头孢他啶/克拉维酸和头孢噻肟/克拉维酸抑菌圈直径大于头孢他啶和头孢噻肟5 mm以上,则确证为ESBLs阳性株[4],见图2。

图1 双纸片协同试验
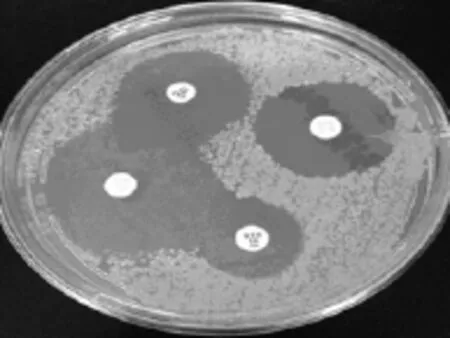
图2 CLSI认证试验
1.4.2.3 数据处理采用SPSS19.0软件对两种检测方法依照McNema检验进行比较。
2 结果
在收集的276例肺炎克雷伯菌中,ESBLs肺炎克雷伯菌为119例(43.1%)。
2.1 初筛试验结果119例ESBLs肺炎克雷伯菌用CAZ、CTX、CRO、ATM四种药敏片初筛结果均显示为阳性。
2.2 确证试验结果双纸片协同试验显示112株ESBLs肺炎克雷伯菌被检测到,而使用CLSI认证试验则显示检测到118株,证明CLSI认证试验有更高地敏感性。双纸片协同试验和CLSI认证试验比较,连续性校正卡方值=3.324,P=0.072>0.05,差异无统计学意义,结果显示两种检测ESBLs肺炎克雷伯菌的方法是可行的,见表1。

表1 两种检测ESBL方法的比较
2.3 分布特征ESBLs肺炎克雷伯菌在我院各种临床标本的分布:痰(63.9%)、分泌物(13.4%)、尿(9.2%)、脓(6.7%)、血(3.4%)、胸腹水(3.4%),其余样本较少发现ESBLs肺炎克雷伯菌。这119例ESBLs肺炎克雷伯菌阳性的标本分布显示大多数病人接受过静脉导管115(96.6%),其次是导尿管27 (22.7%),气管插管10(8.4%),医疗器材穿刺9 (7.5%)等。使用SPSS19.0对其进行卡方检验,χ2=0.033,P=1.00>0.05,无统计学意义,结果显示每种方法每种标本检出的数量,比较后无差别。
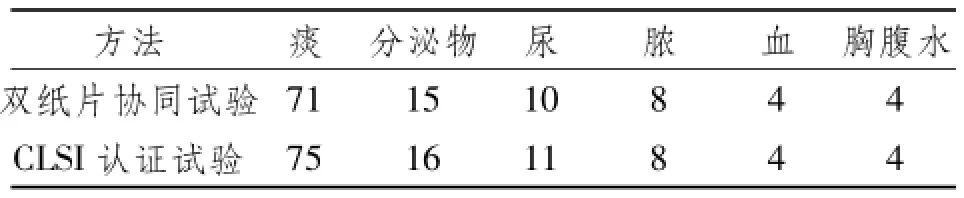
表2 ESBL肺炎克雷伯菌在我院各种临床标本的分布
3 讨论
超广谱β-内酰胺酶主要是由于细菌对各种各样的β-内酰胺类抗生素包括头孢菌素和单酰胺环类抗生素抗药产生质粒突变编码的结果[5]。超过150种各种各样的ESBLs已经被发现,并且大多数属于A类酶(SHV、TEM和CTX-M)。ESBLs在革兰氏阴性杆菌中最常见,尤其是肠杆菌,最近几年ESBLs的患病率不断增加,但是在全球不同的地理区域有不同的变化[7]。肺炎克雷伯菌在医院内是重要的也是最常见的传染性病原菌,会引起肺炎、尿路感染、新生儿败血症和儿童创伤感染。除了肠杆菌科,ESBLs在肺炎克雷伯菌也是非常普遍的,近年来,ESBLs肺炎克雷伯菌显著增加,有报道显示美国分布率为4.2%~44%[6],加拿大为4.9%,西班牙为20.8%,台湾为28.4%,土耳其为78.6%,阿尔及利亚为20%,中国为51%。逐渐增高的患病率需要一种准确率高的实验室检测方法来检测出β-内酰胺酶的存在,为临床治疗提供准确的用药指导,降低死亡率和病人额外的费用。
在本研究中,ESBLs肺炎克雷伯菌的分布率是43.1%。印度的一项研究中显示ESBLs肺炎克雷伯菌在印度的分布率为40%~83.3%[7]。巴基斯坦的一项研究中显示ESBLs肺炎克雷伯菌的分布率为70%。ESBLs肺炎克雷伯菌在医院的分布率取决于多种因素,比如抗生素的管理制度,医院的清洁水平以及感染控制措施有关。
比较双纸片协同试验和CLSI确证试验两种方法检测ESBLs肺炎克雷伯菌,CLSI确证试验比双纸片协同试验检测率更高。印度贾拉瓦尔医学院的Dalela使用双纸片协同试验方法和CLSI确证试验方法检测革兰氏阴性杆菌中的ESBLs,135例阳性ESBL菌株,双纸片协同试验检测到122例(90%),CLSI确证试验全部检测出,检测率为100%[8]。类似的一项研究也是比较双纸片协同试验和CLSI确证试验在ESBLs肺炎克雷伯菌中的检测率,92例筛选出的阳性菌株,用双纸片协同试验方法检测到32例(34.8%),CLSI确证试验检测到72例(78.3%)。Dhara等报道的一项研究用两种方法检测新生儿重症监护室患儿肺炎克雷伯菌的检测率,双纸片协同试验方法检测率只有75%,CLSI确证试验的检测率为85.4%[9]。本研究CLSI确证试验只漏检1例。一项研究报道15.2%假阳性ESBLs肺炎克雷伯菌用CLSI确证试验方法筛查为阳性菌株。本研究表明CLSI确证试验方法检测ESBLs肺炎克雷伯菌比其他表型检测方法更可靠,与以前的研究结果相符合。
我院分离的ESBLs肺炎克雷伯菌在不同的临床标本中的分布,分布率最高的是痰(63.9%),其次是分泌物(13.4%)、尿(9.2%)、脓(6.7%)、血(3.4%)、胸腹水(3.4%),表明呼吸道感染、损伤性操作和泌尿道感染是肺炎克雷伯菌产生的原因,这与大量使用抗生素、住院时间长、频繁性接受损伤性操作密切相关,大多数ESBLs肺炎克雷伯菌病人都进行过一些损伤性治疗操作,比如静脉导管(96.6%)、留置导尿管(22.7%)、气管插管(8.4%)、医疗器材穿刺(7.5%)。如果静脉注射和导管插管不能达到无菌操作的话,常常成为传播感染的源头。
产ESBLs肺炎克雷伯菌在医院内传播是一个严重的问题,它与高发病率密切相关,大大加重了患者的治疗难度及经济负担,抗生素的抗菌治疗只开始于早期发现ESBLs,当没有分子生物学相关设备时,使用CLSI确证试验是非常有效的早期检测ESBLs肺炎克雷伯菌的方法,检测ESBLs有助于建立和实施严格的感染控制措施来防止产ESBLs肺炎克雷伯菌的传播。
[1]I-Ling Chen,Chen-Hsiang Lee,Li-Hsiang Su,et al.Antibiotic Consumption and Healthcare-Associated Infections Caused by Multidrug-Resistant Gram-Negative Bacilli at a Large Medical Center in Taiwan from 2002 to 2009:Implicating the Importance of Antibiotic Stewardship[J].PLoS ONE,2013,5(8):1-6.
[2]隋文君,王海立,王玫,等.呼吸重症监护病房和外科重症监护病房目标病原菌主动筛查和环境监测研究[J].中华检验医学杂志,2013,12(36):1137-1139.
[3]Clinical and Laboratory Standards Institute(CLSI).Performance standards for antimicrobial susceptibility tests M100-S24[J].CLSI,2014.
[4]Ummadevi S,Joseph NM,Kumari K,et al.Detection of ESBLs,AmpC beta lactamase and metallo-beta-lactamases in clinical isolates of ceftazidime resistant P.aeruginosa[J].Braz J Microbiol,2011,42(4):1284-1288.
[5]Ahmad PM,Thokar MA,Fomda BA,Ahmed K.Extended-spectrum β-lactamase producing Klebsiella pneumoniae at a tertiary care setup in Kashmir,India:Comparative phenotypic detection and antimicrobial susceptibility pattern[J].RIF,2010;1(2):124 -133.
[6]Falagas ME,Karageorgopoulos DE.Extended spectrum β-lactamase-producing organisms[J].J Hospital Infect,2009,73(4): 345-354.
[7]Goyal A,Prasad KN,Prasad A,et al.Extended specturm β-lactamases in Escherichia coil and Klebsiella pneumoniae and associated risk factors[J].Indian J Med Res,2009;129(6):695-700.
[8]Dalela G.Prevalence of extended spectrum beta-lactamase(ESBL) producers among gram-negative bacilli from various clinical isolates in a tertiary care hospital at Jhalawar,Rajasthan,India[J].J Clin Diag Research,2012,6(2):182-187.
[9]Dhara M,Disha P,Sachin P,et al.Comparison of various methods for the detection of extended spectrum beta-lactamase in Klebsiella pneumoniae isolated from neonatal intensive care unit Ahmedabad[J].NJMR,2012,2(3):348-355.
Comparison of the two detections of ESBL-producing strains of Klebsiella pneumoniae methods
ZHANG Jian1WU Jia Xue2
(1.Weifang Medical University,Weifang 261053,China;2.Linyi People's Hospital,Linyi 276000,China)
Objective:To compare the phenotype identifying methods of extended-spectrum β-lactamase producing K.pneumoniae,observe the distribution of ESBLs K.pneumoniae from various clinical specimens,select the Multi-drug resistance(MDR),get the result of drug sensitive test,prevent and control the propagation of MDR in the hospital,and provide the basis for clinical treatment.Methods:The detection rates of Double-disc synergy test(DDST)and the CLSI confirmatory test were compared.Results:A total of 119 ESBLs-producing Klebsiella pneumoniae was isolated in a variety of clinical specimens,76 of which were collected from sputum,16 from secretions,11 from urine,8 from pus,4 from blood and 4 from pleural and peritoneal effusions.These patients underwent a variety of clinical treatments,the catheter in 115 cases(96.6%),indwelling catheter in 27 cases(22.7%),endotracheal intubation in 10 cases(8.4%),medical equipment and puncture in 9 cases(7.5%)and the like.The detection rate of DDST was 94.1%(112 samples),and the detection rate of CLSI confirmatory test was 99.2%(118samples).ConclusionThe results shows that using CLSI confirmatory test is a very effective method in the early stage without facilities for molecular characterization.
Klebsiella pneumoniae;ESBL;early detection
R446.5
A
1004-7115(2015)01-0030-03
10.3969/j.issn.1004-7115.2015.01.010
2014-11-25)
张健(1987-),女,山东泰安人,硕士研究生,研究方向:临床检验诊断学。
