Maillard反应对卵白蛋白稳定性的影响
2015-06-05毕海丹冯晓慧
金 婷,毕海丹,冯晓慧,于 滨
(枣庄学院生命科学学院,山东枣庄 277160)
Maillard反应对卵白蛋白稳定性的影响
金 婷,毕海丹,冯晓慧,于 滨*
(枣庄学院生命科学学院,山东枣庄 277160)
为了确定Maillard反应对卵白蛋白稳定性的影响,本文研究了Maillard反应卵白蛋白处于酶解、酸性环境、加热、变性剂、反复冻融等不利条件下的理化特点。结果表明Maillard反应抑制了蛋白酶对卵白蛋白的酶解效果。Maillard反应卵白蛋白在pH2~7的范围内,空间结构伸展程度较小。Maillard反应将卵白蛋白的变性温度从71.3℃提高到76.9℃,明显改善了卵白蛋白的热稳定性。6mol·L-1的尿素能够使热处理卵白蛋白和天然态卵白蛋白完全变性,而只能使Maillard反应卵白蛋白部分变性。Maillard反应能够提高卵白蛋白的溶解度,其溶解度经过反复冻融后仍处于较高水平。Maillard反应可以有效提高卵白蛋白稳定性,从而保证卵白蛋白功能性的发挥。
卵白蛋白,Maillard反应,稳定性,理化特点
蛋清蛋白作为一种食品加工原料具有广泛的应用范围[1],一方面是由于蛋清蛋白质的营养价值高、资源丰富、原料成本低,另一方面则是因为蛋清蛋白具有与食品的嗜好性、加工性等相关联的各种功能性质,如起泡性、吸油性、吸水性与持水性、凝胶性等,它们是蛋清蛋白质本身固有的物化性质[2]。卵白蛋白是蛋清中的主要蛋白质,其含量占蛋清蛋白质的54%,卵白蛋白的性质决定了蛋清蛋白的功能性质。蛋白质的功能性质除了受蛋白质本身影响外(成分、氨基酸序列、形态结构等),它们的发挥还受与其共存的某些食物组分(水、盐、蛋白质、糖、脂肪等)的影响,同时还受所接触环境(温度、pH、电离强度等)、加工条件(杀菌、均质、干燥)的影响,因此蛋白质功能性质的发挥是由多方面因素所决定的[3],而具有良好稳定性是保证蛋白质功能性质的关键。Maillard反应是将碳水化合物以共价键与蛋白质分子上氨基(主要为Lys的ε-氨基)或羧基相结合的化学反应,被广泛用于提高蛋白功能特性[4]。目前已有很多研究通过Maillard反应改善了大豆蛋白、乳清蛋白、蛋清蛋白等的功能性质[5-7],其研究重点主要集中于蛋白质的溶解度、凝胶性、乳化性等方面[8-9],而关于Maillard反应修饰后的蛋白质稳定性研究相对较少,因此本文以蛋清蛋白的主要蛋白——卵白蛋白为研究对象,分析Maillard反应对卵白蛋白稳定性的影响,为Maillard反应在蛋白质改性的进一步应用提供参考。
1 材料与方法
1.1 材料与仪器
鸡蛋 购自枣庄大润发超市;麦芽糊精(DE15) 山东润康生物工程有限公司;邻苯二甲醛(OPA)国药集团化学试剂有限公司;胃蛋白酶 郑州鸿祥化工有限公司;中性蛋白酶 南宁庞博生物工程有限公司;碱性蛋白酶 南宁庞博生物工程有限公司;8-苯氨基-萘酚-磺酸(ANS)Sigma试剂公司:尿素 天津市化学试剂三厂。其他化学试剂均为分析纯。
TU-1800紫外可见分光光度计 北京普析仪器公司;FDU-1100冷冻干燥机 日本EYELA公司;DHG-9240A型电热恒温鼓风干燥箱 上海一恒科技有限公司;pHS-3C精密pH计 上海精密科学仪器有限公司;Pyris6差示量热扫描仪 Perkin Elmer;F-4500荧光分光光度计 日本日立公司。
1.2 实验方法
1.2.1 卵白蛋白的制备 采用硫酸铵盐析加一次等电点沉降的工艺制备卵白蛋白[10](天然态卵白蛋白),经Sephadex G100葡聚糖凝胶柱层析,洗脱曲线呈单一峰型,表明卵白蛋白纯度较高,可以用于进一步实验。
1.2.2 样品的制备 根据参考文献[11],将麦芽糊精与卵白蛋白按照5%的比例混合、溶解,经冷冻干燥制得卵白蛋白-麦芽糊精混合粉,然后将混合粉置于含有饱和KI溶液(65%相对湿度)的封闭容器中,在60℃条件下保温3d,即得卵白蛋白-麦芽糊精共聚物(Maillard反应卵白蛋白)。以未加入麦芽糊精的卵白蛋白为对照样品(热处理卵白蛋白),进行相同处理,以分析卵白蛋白-麦芽糊精体系中未反应卵白蛋白对体系稳定性的影响。
1.2.3 游离氨基相对含量分析 采用OPA法对卵白蛋白中糖基化程度进行测定。取OPA试剂4mL,加入200μL蛋白溶液(10mg·mL-1),35℃反应2min,以OPA试剂中加入200μL水为空白,340nm下测定吸光值。游离氨基相对含量计算公式如下:游离氨基相对含量(%)=At/A0×100,其中At表示t时刻样品的吸光值,A0表示未反应样品的吸光值。
1.2.4 褐变程度分析 将蛋白配制成1%的溶液,4000r·min-1离心10min,420nm进行比色,以A420nm表征褐变程度。
1.2.5 卵白蛋白酶解性能分析 将样品配制成5%的蛋白溶液,在胃蛋白酶、中性蛋白酶、碱性蛋白酶的最适合条件下水解1h,沸水浴10min灭酶,4000r·min-1离心收集上清液,利用茚三酮法测定水解度[12]。
1.2.6 酸性环境对卵白蛋白荧光强度的影响 配制浓度为10mg·mL-1的样品溶液,用1mol·L-1的HCl调节pH为2~7,取样品溶液4mL,加入20μL的ANS溶液(采用0.02mol·L-1,pH7.4磷酸缓冲液)作为荧光探针,并于室温条件下保持30min,采用荧光分光光度计在390nm的激发波长和480nm的发射波长下测定样品的荧光强度。
1.2.7 卵白蛋白的热稳定性分析 本实验将蛋白粉1∶7(w/v)溶于0.02mol·L-1,pH7.0磷酸盐缓冲溶液中,采用差示扫描量热仪分析,扫描温度40~90℃,30℃保留1min,扫描速率2℃/min,90℃保留1min。利用仪器自带软件分析图谱,得到卵白蛋白的峰值温度。
1.2.8 变性剂处理对蛋白荧光强度的影响 将糖基化蛋白溶解于0~6mol·L-1的尿素溶液中,配制成蛋白浓度为1mg·mL-1的溶液,采用荧光分光光度计在370nm的激发波长和470nm的发射波长下测定样品的荧光强度。
1.2.9 冷冻-融化对蛋白溶解度的影响 配制10%的蛋白质溶液,置于-20℃的冰柜中冻结,24h后取出,在室温条件下解冻,即完成一次冷冻-融化过程,依次完成1、3、5次冷冻-融化循环,并对样品溶液进行溶解度分析,其测定方法参照文献的方法进行[13]。
1.3 数据处理
每次实验重复3次。单因素方差分析利用SPSS V17.0的One-way ANOVA程序进行分析。均数间比较利用Tukey检验分析(样本数n=3,p<0.05)。
2 结果与分析
2.1 Maillard反应程度分析
游离氨基与褐变程度是表征Maillard反应进行程度的主要指标,本文对反应过程中的相对游离氨基含量与褐变程度进行了分析,结果如图1所示。从图1可以看出,随着Maillard反应时间的延长,游离氨基相对含量不断下降,反应0.5d后,游离氨基相对含量减少11.9%,随后游离氨基含量降低趋于平缓,当反应时间为3d时,游离氨基含量减少了19.9%。随着Maillard反应时间的不断延长,褐变程度稍有增加,但其最大值不超过0.12。游离氨基相对含量与褐变程度的变化结果表明Maillard反应已基本完成,且反应进程基本处于Maillard反应的初期或中期阶段。
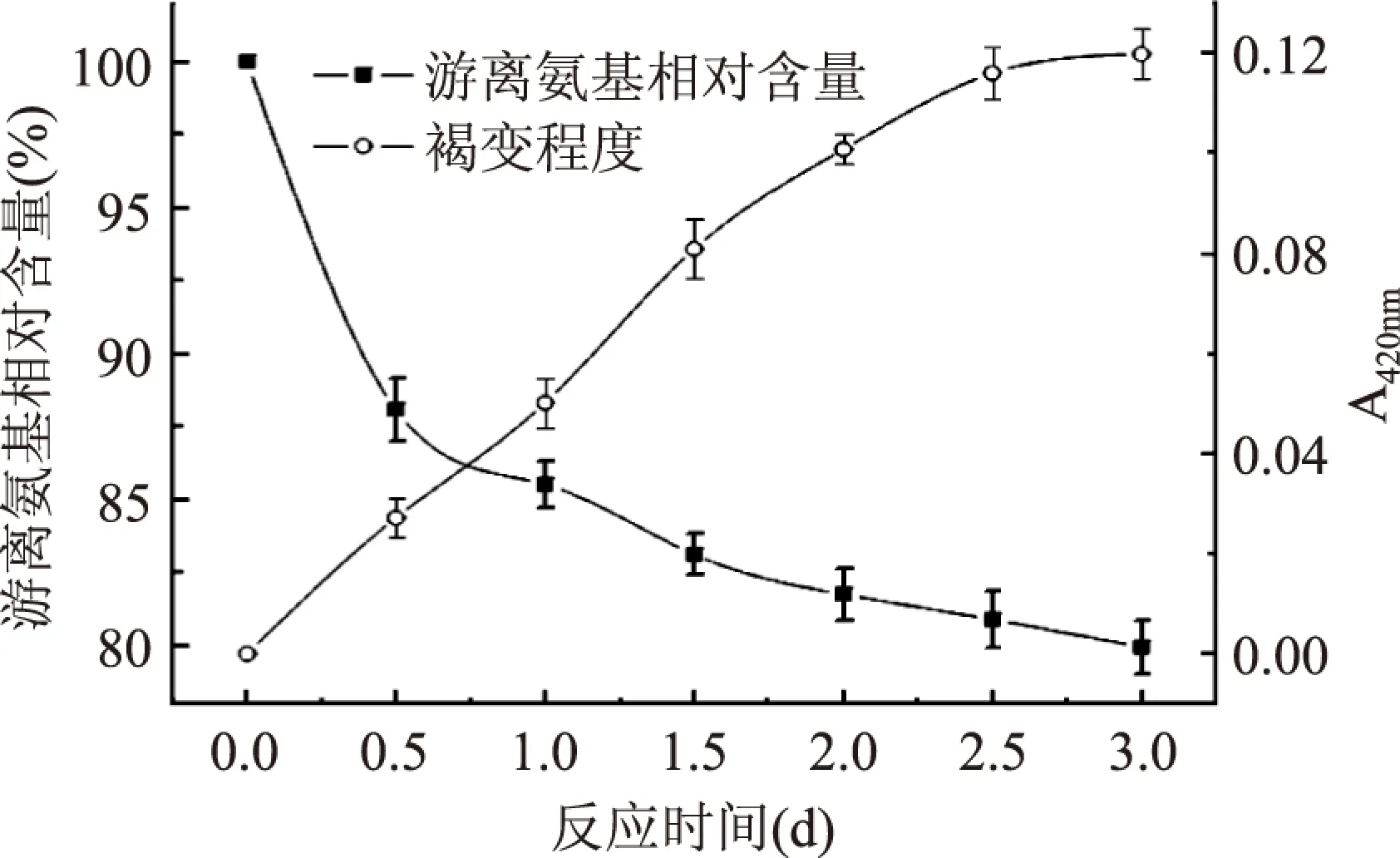
图1 卵白蛋白游离氨基和褐变程度的变化Fig.1 Changes in free amino groups content and browning of ovalbumin
2.2 卵白蛋白酶解性能分析
蛋白质在酶的作用下,结构打开的难易程度是描述其稳定性的重要指标,它和蛋白质结构、形状等都有密切关系[14]。为了研究Maillard反应卵白蛋白的稳定性,通过比较不同蛋白酶水解卵白蛋白的水解度,来反映蛋白质的稳定性,结果如图2所示。三种蛋白酶水解卵白蛋白的能力次序是碱性蛋白酶>胃蛋白酶>中性蛋白酶,三种卵白蛋白在不同蛋白酶的水解作用下,其水解度以热处理卵白蛋白为最大,卵白蛋白在热处理过程中,其分子空间结构不断伸展,使得蛋白酶的活性中心很容易与蛋白质的水解位点相互作用[15]。Maillard反应卵白蛋白在三种蛋白酶的作用下,其水解度低于热处理卵白蛋白,但高于天然态卵白蛋白的水解度。这可能是Maillard反应与热处理综合作用的结果。糖分子基团的出现使得反应位点周围的肽键具有立体位阻效应[16],这阻碍了Maillard反应蛋白与蛋白酶的活性中心不易接近。
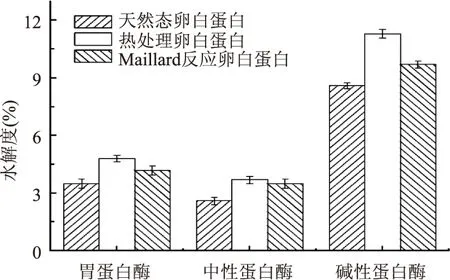
图2 卵白蛋白酶解性能分析Fig.2 Analysis in enzymolysis performance of ovalbumin
2.3 酸性环境对卵白蛋白荧光强度的影响
当蛋白质在极端的pH条件下,由于静电相互作用受到干扰,蛋白质结构被破坏[17]。不同电荷分子间形成盐桥的能力下降,从而降低蛋白质的静电自由能,从而导致全面的伸展[18]。通过分析卵白蛋白在酸性条件下的荧光强度的变化,表征其在酸性条件下的结构的伸展程度,结果如图3所示。从结果可以看出,三种卵白蛋白的荧光强度都随着pH的降低而不断增加,这说明蛋白质中的疏水性氨基酸不断暴露,分子结构不断伸展。但是在相同pH条件下,热处理卵白蛋白的荧光强度要高于天然态卵白蛋白和Maillard反应卵白蛋白,这与其处理过程中的受热有关。当pH高于天然态卵白蛋白等电点(4.5),三种蛋白荧光强度增加不明显,而当pH低于4.5时,天然态卵白蛋白与热处理卵白蛋白的荧光强度明显增加。Maillard反应卵白蛋白的荧光强度在pH为4.5~7.0之间是高于天然态卵白蛋白,这是由于pH对卵白蛋白的荧光强度影响较小,Maillard反应过程能够增加卵白蛋白的疏水性[19]。而pH在2.0~4.5之间,天然态卵白蛋白荧光强度高于Maillard反应卵白蛋白,这时强烈的静电斥力使得天然态卵白蛋白结构伸展,而Maillard反应卵白蛋白周围水分子的电荷屏蔽作用,降低了静电斥力对卵白蛋白结构的影响[20]。
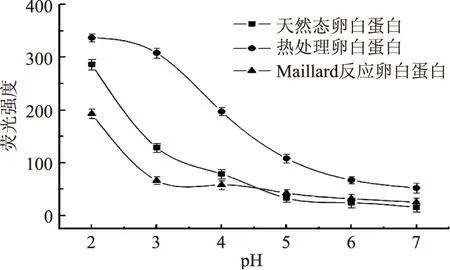
图3 pH对卵白蛋白荧光强度的影响Fig.3 Effect of pH on fluorescence intensity of ovalbumin
2.4 卵白蛋白的热稳定性分析
蛋白质在加热时,蛋白质分子展开过程中需要吸收能量即为变性热。蛋白质的热分析就是通过加热破坏蛋白质的二级,三级和四级结构并测得变性过程中的能量变化情况。本文利用差示扫描量热仪(DSC)分析卵白蛋白的热变性过程,结果如图4所示。从图中可以看出,在加热过程中三种卵白蛋白的DSC图有着很大的差别,各扫描曲线的出峰时间和形状差异明显不同。Maillard反应卵白蛋白的变性温度达到76.9℃,而天然态卵白蛋白与热处理卵白蛋白的变性温度较低,分别为71.3℃和65.2℃。这说明Maillard反应有效的提高卵白蛋白的热稳定性,很多学者已经证明Maillard反应可以提高乳球蛋白[21]、大豆蛋白[22]的热稳定性。Maillard反应可以显著提高蛋白质的变性温度,改善程度与糖分子含量有关[23]。
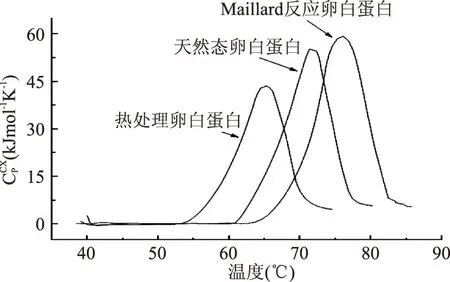
图4 卵白蛋白的热稳定性分析Fig.4 Thermal stability of ovalbumin
2.5 尿素对卵白蛋白荧光强度的影响
蛋白质变性的难易程度与蛋白质结构有关,结构越稳定越不易变性[24],本研究中为了分析卵白蛋白的稳定性,将卵白蛋白处于不同浓度尿素中进行变性,以破坏维持蛋白质稳定的氢键和疏水相互作用。从图5中可以看出,随着尿素浓度的不断增加,荧光强度也在不断的增加,这表明蛋白质结构在不断的伸展,内部疏水性基团不断暴露。当尿素浓度大于4mol·L-1时,热处理卵白蛋白的荧光强度趋于平缓,这说明蛋白质的结构已经充分展开,天然态卵白蛋白在尿素浓度大于5mol·L-1时才出现这种现象。而Maillard反应卵白蛋白荧光强度是随着尿素浓度线性增加,这说明Maillard反应卵白蛋白空间结构仍未被全部打开,其结构稳定性相对较好。这可能也与Maillard反应增加蛋白质的氢键有关[25]。
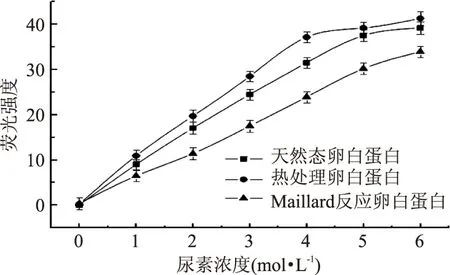
图5 尿素对卵白蛋白荧光强度的影响Fig.5 Effect of urea on fluorescence intensity of ovalbumin
2.6 反复冻融对卵白蛋白溶解度的影响
蛋白质在冻藏过程中,由于冰晶的形成,使得蛋白质变性,溶解度降低[26],本文研究了不同冻融循环次数对卵白蛋白溶解度的影响,结果如图6所示。从结果中可以看出,Maillard反应卵白蛋白的溶解度是最大,未经冻融处理时,其溶解度可以达到96.3%,这与许多报道Maillard反应可以显著的改善蛋白质的溶解度是一致[27]。而热处理卵白蛋白的溶解度相对于天然态卵白蛋白稍有下降。随着冻融循环次数的增加,三种卵白蛋白的溶解度均是不断下降的,其中天然态卵白蛋白和热处理态卵白蛋白溶解度经过5次冻融后,其溶解度分别下降了12.6%和11.7%,而Maillard反应卵白蛋白溶解度降低7.8%,由此可见Maillard反应卵白蛋白对于冻融处理具有较高的抵抗能力,这可能与卵白蛋白表面结合糖分子的羟基有关,羟基通过氢键吸附水分子,从而形成保护膜,减少冰晶对蛋白质结构的影响,从而稳定蛋白质的溶解度[28]。
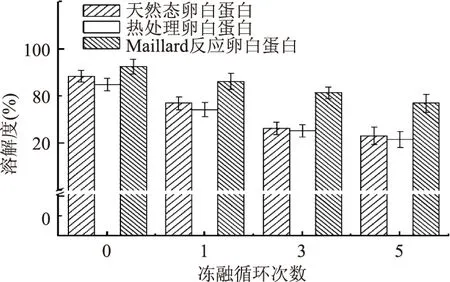
图6 反复冻融对卵白蛋白溶解度的影响Fig.6 Effect of freeze-thaw cycles on solubility of ovalbumin
3 结论
基于Maillard反应制备了卵白蛋白-麦芽糊精共聚物,并对其稳定性进行分析。当Maillard反应卵白蛋白在三种蛋白酶的作用下,均呈现出抵制酶水解的特点。而在酸性环境中(pH2~7),Maillard反应卵白蛋白荧光强度变化较小,这说明其空间结构变化较小,Maillard反应降低了静电斥力对卵白蛋白稳定性的影响。DCS扫描分析表明Maillard反应提高了卵白蛋白的变性温度,提高了卵白蛋白的热稳定性。在尿素浓度为1~6mol·L-1的条件下,Maillard反应卵白蛋白的荧光强度随着尿素浓度的增加而增加,Maillard反应卵白蛋白的空间结构仍未完全打开。Maillard反应卵白蛋白经过5次冻融后,其溶解度高于80%,说明Maillard反应卵白蛋白对于冻结的脱水作用及冰晶的物理挤压都具有较好的抵抗能力。Maillard反应提高了卵白蛋白在酶解、酸性环境、加热、变性剂、冻融等不利条件下的稳定性,有助于扩大卵白蛋白的应用范围。
[1]Mine Y. Recent advances in the understanding of egg white protein functionality[J]. Trends in Food Science & Technology,1995,6(7):225-232.
[2]Mine Y. Recent advances in egg protein functionality in the food system[J]. World’s Poultry Science Journal,2002,58(1):31-39.
[3]江志炜,沈蓓英,潘秋琴. 蛋白质加工技术[M]. 北京:化学工业出版社,2003.
[4]Oliver C M,Melton L D,Stanley R A. Creating proteins with novel functionality via the Maillard reaction:a review[J]. Critical Reviews in Food Science and Nutrition,2006,46(4):337-350.
[5]Wang Q,Ismail B. Effect of Maillard-induced glycosylation on the nutritional quality,solubility,thermal stability and molecular configuration of whey protein[J]. International Dairy Journal,2012,25(2):112-122.
[6]Gu X,Campbell L J,Euston S R. Influence of sugars on the characteristics of glucono--lactone-induced soy protein isolate gels[J]. Food Hydrocolloids,2009,23(2):314-326.
[7]Huang X,Tu Z,Xiao H,etal. Characteristics and antioxidant activities of ovalbumin glycated with different saccharides under heat moisture treatment[J]. Food Research International,2012,48(2):866-872.
[8]Corzo-Martínez M,Carrera Sánchez C,Moreno F J,etal. Interfacial and foaming properties of bovine β-lactoglobulin:Galactose Maillard conjugates[J]. Food Hydrocolloids,2012,27(2):438-447.
[9]Sun Y,Hayakawa S,Izumori K. Modification of ovalbumin with a rare ketohexose through the Maillard reaction:effect on protein structure and gel properties[J]. Journal of Agricultural and Food Chemistry,2004,52(5):1293-1299.
[10]聂珍媛,夏金兰,潘佳民. 卵白蛋白的分离及卵白蛋白铁的制备与表征[J]. 天然产物研究与开发,2008,20:870-875.
[11]Akhtar M,Dickinson E. Whey protein-maltodextrin conjugates as emulsifying agents:an alternative to gum arabic[J]. Food Hydrocolloids,2007,21(4):607-616.
[12]赵新淮,冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学,1994(11):65-67.
[13]Kato Y,Aoki T,Kato N,etal. Modification of ovalbumin with glucose 6-phosphate by amino-carbonyl reaction. Improvement of protein heat stability and emulsifying activity[J]. Journal of Agricultural and Food Chemistry,1995,43(2):301-305.
[14]Adler-Nissen J. Enzymic hydrolysis of food proteins[M]. Elsevier Applied Science Publishers,1986.
[15]Van der Plancken I,Van Remoortere M,Indrawati,etal. Heat-induced changes in the susceptibility of egg white proteins to enzymatic hydrolysis:a kinetic study[J]. Journal of Agricultural and Food Chemistry,2003,51(13):3819-3823.
[16]Clowers B H,Dodds E D,Seipert R R,etal. Site determination of protein glycosylation based on digestion with immobilized nonspecific proteases and Fourier transform ion cyclotron resonance mass spectrometry[J]. Journal of Proteome Research,2007,6(10):4032-4040.
[17]Wang W. Instability,stabilization,and formulation of liquid protein pharmaceuticals[J]. International Journal of Pharmaceutics,1999,185(2):129-188.
[18]Chan H S,Dill K A. Polymer principles in protein structure and stability[J]. Annual Review of Biophysics and Biophysical Chemistry,1991,20(1):447-490.
[19]Du Y,Shi S,Jiang Y,etal. Physicochemical properties and emulsion stabilization of rice dreg glutelin conjugated with κ-carrageenan through Maillard reaction[J]. Journal of the Science of Food and Agriculture,2013,93(1):125-133.
[20]Solá R J,Griebenow K. Influence of modulated structural dynamics on the kinetics of α-chymotrypsin catalysis[J]. Febs Journal,2006,273(23):5303-5319.
[21]Jiménez-Castao L,Lopez-Fandino R,Olano A,etal. Study on β-lactoglobulin glycosylation with dextran:effect on solubility and heat stability[J]. Food Chemistry,2005,93(4):689-695.
[22]Diftis N G,Biliaderis C G,Kiosseoglou V D. Rheological properties and stability of model salad dressing emulsions prepared with a dry-heated soybean protein isolate-dextran mixture[J]. Food Hydrocolloids,2005,19(6):1025-1031.
[23]Wang C,Eufemi M,Turano C,etal. Influence of the carbohydrate moiety on the stability of glycoproteins[J]. Biochemistry,1996,35(23):7299-7307.
[24]Shortle D. The denatured state(the other half of the folding equation)and its role in protein stability[J]. The FASEB Journal,1996,10(1):27-34.
[25]Jaenicke R. Stability and stabilization of globular proteins in solution[J]. Journal of Biotechnology,2000,79(3):193-203.
[26]Xiong Y L. Protein denaturation and functionality losses[M]//Quality in Frozen Food. Springer US,1997:111-140.
[27]Achouri A,Boye J I,Yaylayan V A,etal. Functional properties of glycated soy 11S glycinin[J]. Journal of Food Science,2005,70(4):C269-C274.
[28]Jiang S T,Chen G H,Tang S J,etal. Effect of glycosylation modification(NQ-108I→ NQ-108T)on the freezing stability of recombinant chicken cystatin overexpressed in Pichia pastoris X-33[J]. Journal of Agricultural and Food Chemistry,2002,50(19):5313-5317.
Effect of Maillard reaction on the stability of Ovalbumin
JIN Ting,BI Hai-dan,FENG Xiao-hui,YU Bin*
(College of Life Science,Zaozhuang University,Zaozhuang 277160,China)
In order to determine the effect of Maillard reaction(MR)on the stability of ovalbumin,physiochemical characteristic of ovalbumin modified by MR(OMR)subjected to enzymolysis,acidic conditions,heating,denaturant,freeze-thaw cycles were analyzed. The results showed that hydrolytic activities of proteases on ovalbumin were inhibited by MR. The three-dimensional structures of OMR showed a little change at pH range of 2~7. The denaturation temperature of ovalbumin was rise from 71.3℃ to 76.9℃ by MR,which improved the heat stability of ovalbumin. 6mol·L-1urea induced completely denaturation of native and heated ovalbumin,as well as partially denaturation of OMR. The solubility of ovalbumin was improved by MR. OMR displayed a better solubility after treatment of several freeze-thaw cycles. Improvement in stability of ovalbumin by MR was beneficial to functional properties of ovalbumin.
Ovalbumin;Maillard reaction;stability;physiochemical characteristic
2014-04-29
金婷(1980-),女,硕士,讲师,研究方向:食品化学。
*通讯作者:于滨(1980-),男,博士,副教授,研究方向:食品科学。
山东省高等学校科技发展计划(J12LD51)。
TS253.1
A
1002-0306(2015)03-0123-05
10.13386/j.issn1002-0306.2015.03.017
