江苏东部沿海四种低值贝类软体中牛磺酸动态积累规律与适宜采收期研究
2015-06-05王欣之易瑞灶王令充贺蓓蓓谢冬云
李 娜,王欣之,2,吴 皓,2,*,易瑞灶,刘 睿,2,王令充,2,贺蓓蓓,谢冬云,陈 涛
(1.南京中医药大学,江苏省海洋药用生物资源研究与开发重点实验室,江苏南京 210023;2.江苏省中药资源产业化过程协同创新中心,江苏南京 210023;3.国家海洋局第三海洋研究所,福建厦门 361005)
江苏东部沿海四种低值贝类软体中牛磺酸动态积累规律与适宜采收期研究
李 娜1,王欣之1,2,吴 皓1,2,*,易瑞灶3,刘 睿1,2,王令充1,2,贺蓓蓓1,谢冬云1,陈 涛1
(1.南京中医药大学,江苏省海洋药用生物资源研究与开发重点实验室,江苏南京 210023;2.江苏省中药资源产业化过程协同创新中心,江苏南京 210023;3.国家海洋局第三海洋研究所,福建厦门 361005)
以采自江苏东部沿海的文蛤、青蛤、四角蛤蜊及菲律宾蛤仔四种低值贝类为样本,研究其软体中牛磺酸的动态变化规律,探讨这四种贝类的最适采收期。建立以邻苯二甲醛(OPA)柱前衍生化结合HPLC-UV测定牛磺酸的方法,以Kromasil 50mm×2.1mm C18为分离柱,甲醇-0.05mol/L乙酸钠(pH6.0)23∶77为流动相,流速0.3mL/min洗脱,紫外检测波长为330nm。该方法可以准确测定四种贝类软体中牛磺酸的含量,且灵敏度高,重现性好。贝类的生长具有明显季节性,一般春夏季较秋冬季生长较快,尤其夏季水温为25~28℃时为快速生长期,此时,贝类软体中牛磺酸含量达到最高。菲律宾蛤仔牛磺酸含量最高在7月,约为42.79mg/g;而文蛤、青蛤、四角蛤蜊软体中牛磺酸含量最高在6月,分别约为27.48、16.59、15.00mg/g。若从产量和有效成分牛磺酸的含量变化上综合考虑,建议菲律宾蛤仔牛磺酸最佳采收期为7月,文蛤、青蛤、四角蛤蜊最佳采收期为6月。
牛磺酸,高效液相色谱法,采收期,贝类软体
牛磺酸(Taurine)又称为2-氨基乙磺酸,是一种含硫的β-氨基酸,具有广泛的生物学效应,主要体现在:促进大脑发育[2-3];增强细胞抗病毒侵害能力[4];增强心血管系统的功效[5-6];保护神经系统[7]、免疫系统及呼吸系统[8]的作用;抗衰老、抗高血压和高血脂[9];防治糖尿病[10];抗肿瘤活性[11]等几个方面。
国内外市场上使用的牛磺酸有化学合成牛磺酸和天然牛磺酸。其中广泛使用的为化学合成品,但化学合成的牛磺酸存在原料毒性大、工艺操作复杂、环境污染等严重问题[12],随着生活水平的提高和绿色化学的进展,人们越来越提倡使用天然提取的牛磺酸。天然牛磺酸主要存在于海产品及哺乳动物的几乎所有脏器中,尤其是在海洋贝类软体中,且以游离形式存在[13],故从海洋贝类中提取天然牛磺酸具有很大的应用前景。江苏省沿海滩涂面积广大,滩涂海洋生物资源丰富,其中四角蛤蜊、文蛤、青蛤、菲律宾蛤仔等贝类资源尤为丰富。因此,了解这些贝类软体中牛磺酸的蕴藏量,总结不同采收期贝类软体中牛磺酸的动态积累规律,对江苏沿海贝类的品质分析以及天然牛磺酸资源的开发具有重大的科学指导意义。
目前,鲜有海洋贝类软体中牛磺酸含量测定方法的研究,更缺乏贝类软体中牛磺酸的动态变化规律的报道。因此,本文通过邻苯二甲醛(OPA)柱前衍生化结合HPLC法[14],首次对江苏东部沿海所产的不同采收期的菲律宾蛤仔、文蛤、青蛤以及四角蛤蜊中牛磺酸的含量进行系统研究,探讨在一年之中四种贝类软体中牛磺酸的动态变化规律,以期了解江苏沿海贝类的品质,并确定其最佳的采收期。
1 材料与方法
1.1 材料与仪器
菲律宾蛤仔、文蛤、青蛤、四角蛤蜊软体(批号:201208-201307),由江苏省海洋水产研究所提供,经江苏省海洋水产研究所万夕和研究员鉴定来源分别为:帘蛤科动物菲律宾蛤仔、文蛤和青蛤,蛤蜊科动物四角蛤蜊。
牛磺酸标准品,纯度大于99% 上海国药集团化学试剂有限公司;甲醇 色谱纯,美国TEDIA 天地试剂有限公司;邻苯二甲醛 上海国药集团化学试剂有限公司;无水乙醇、氢氧化钠、硼酸、磷酸二氢钾、乙酸钠等分析纯试剂,均为南京化学试剂有限公司生产的产品。
衍生化试剂的制备:称取0.5g 邻苯二甲醛于100mL容量瓶中,加10mL甲醇溶解,再加入5mL 2-巯基乙醇,并用硼酸钠缓冲液(0.4mol/L,pH9.5,NaOH 调制)定容至100mL。密封后置于4℃冰箱中避光保存。在使用过程中,每隔两天加入1mL 的2-巯基乙醇,使用期限1周[15]。
Waters 2695高效液相色谱仪 Waters 2489 UV/Visible Detector检测器 美国Waters公司;TGL-16G型高速离心机 上海安亭科学仪器厂;KQ-500 DE型数控超声波清洗器 昆山市超声仪器有限公司;BT-125D型电子分析天平 赛多利斯科学仪器有限公司;UNIQUE-s15超纯水机 厦门锐思捷科学仪器有限公司;LABCONCO冻干机 美国。
1.2 实验方法
1.2.1 色谱条件 分离柱:Kromasil C18(2.5mm×50mm);流速0.3mL/min,进样体积2μL,流动相A为甲醇,流动相B为0.05mol/L乙酸钠溶液(pH6.0,冰醋酸调制),VA∶VB=23∶77,等度洗脱;紫外检测器,波长330nm;柱温40℃。牛磺酸对照品及四种贝类软体样品的色谱图见图1。
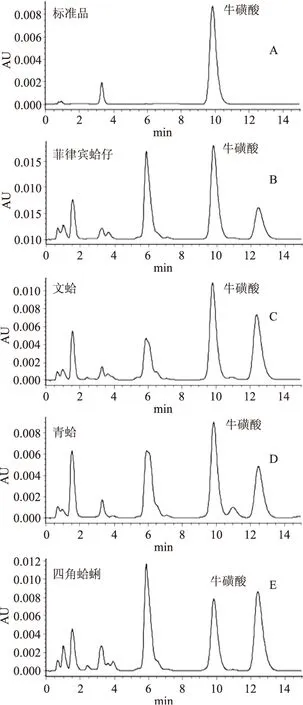
图1 牛磺酸标准(A)、样品(B菲律宾蛤仔、 C文蛤、D青蛤、E四角蛤蜊)色谱图Fig.1 HPLC chromatograms of Taurine solution of standards(A)and samples(B,C,D,E)
1.2.2 衍生剂浓度 称取OPA 500mg溶解于10mL甲醇中,加入1mL 2-巯基乙醇,并加入硼酸钠缓冲液定容于100mL 容量瓶中,摇匀,避光放置,使用前加硼酸钠缓冲液稀释为浓度分别为0.1、0.2、0.25、0.5、1.0、1.5、2.5、5mg/mL的系列浓度,依法衍生。
1.2.3 衍生反应时间 在其他条件不变的情况下,精密吸取1mL 0.20014mg/mL的牛磺酸对照品溶液与1mL 5mg/mL OPA反应液进行不同时间的反应,然后通过柱分离测定其峰面积。
1.2.4 流动相考察 分别选择不同配比的流动相甲醇-纯水(80∶20、70∶30、60∶40、55∶45、30∶70)、甲醇-酸水(70∶30、60∶40、45∶55、30∶70)、甲醇-乙酸钠水溶液(75∶25、40∶60、35∶65、23∶77),进行牛磺酸标准品和样品的色谱分离实验。
1.2.5 检测波长的选择 取牛磺酸对照品适量,用蒸馏水配成50mg/L浓度的对照品溶液。取该对照品溶液1mL于10mL容量瓶中,加入OPA衍生试剂1mL,摇匀,室温反应1.5min后,立即加入0.1mol/L磷酸二氢钾终止液1mL,摇匀,加甲醇定容至刻度。进行紫外全波扫描,确定最佳检测波长。
1.2.6 提取条件考察 分别考察提取方法、提取溶剂、提取溶剂比例、提取时间及提取次数对贝类软体中牛磺酸提取效果的影响。提取方法:提取溶剂纯水、提取溶剂比例1∶30、提取时间60min,比较超声提取与水煎煮加热回流提取两种提取方法的提取效率。提取溶剂:超声提取,溶剂比例1∶30、提取时间60min,分别考察比较不同提取溶剂(纯水、不同比例的甲醇溶液、不同比例的乙醇溶液)对牛磺酸的提取效率。提取溶剂比例:超声提取,70%乙醇,提取时间60min,不同溶剂提取比例1∶10、1∶15、1∶20、1∶30、1∶40、1∶50。提取时间:超声提取,70%乙醇,提取比例1∶30,提取时间分别为30、60、90、120min。
提取次数:超声提取,70%乙醇,溶剂比例1∶30,提取60min,提取次数分别为1、2、3次。
1.2.7 供试品溶液的制备 将购置的贝类软体置于篮中,化冻,洗净,静置过夜,匀浆,于冻干机上冻成干粉。即为实验中所用的贝类软体的冻干粉。
取贝类软体冻干粉约0.5g,精密称定,置于100mL具塞锥形瓶中,加70%乙醇溶液15mL,超声处理(功率300W,频率100kHz)60min 后,摇匀,滤过,取续滤液,再向残渣中加入15mL 70%乙醇溶液,超声处理60min,重复三次,合并续滤液,并定容至50mL 容量瓶中,保存备用[16]。
精密量取上述对照品溶液和供试品溶液各1mL,分别置10mL量瓶中,各加入邻苯二甲醛(OPA)衍生试剂1mL,摇匀,室温反应1.5min 后,立即加入0.1mol/L磷酸二氢钾终止液1mL,摇匀,加甲醇定容至刻度,即得。
1.2.8 对照品储备溶液的制备及标准曲线的绘制 取牛磺酸对照品适量,精密称定,加蒸馏水制成每1mL含1.0007mg的溶液。
分别移取1.0007mg/mL牛磺酸标准溶液0.1、0.5、1、2、5、8mL于10mL容量瓶中,加超纯水定容至刻度,摇匀,得到7个浓度系列的牛磺酸标准品溶液。分别精密吸取以上各浓度对照品溶液,依法进行衍生化反应,过0.45μm微孔滤膜,吸取2μL注入Waters 2695高效液相色谱仪中进行测定。
1.2.9 加样回收率实验 称取牛磺酸对照品0.06010g,精密称定,加蒸馏水定容至10mL。取文蛤(201208)冻干粉0.25g,精密称定,按80%、100%、120%的比例加入对照品,每个比例平行三份,再分别加入70%乙醇溶液补足到15mL,依照样品处理方法处理,保存备用。
2 结果与讨论
2.1 衍生反应条件的优化
2.1.1 衍生剂浓度 从图2可以看出,当衍生试剂浓度小于1mg/mL时峰面积随衍生试剂浓度的增大而增大,表明在此浓度范围内衍生反应不充分。浓度在1.0~5mg/mL时峰面积稳定。为保证衍生反应完全,确定衍生试剂的浓度为5mg/mL。

图2 衍生剂浓度对牛磺酸OPA衍生物色谱峰面积的影响Fig.2 Effect of OPA concentration on HPLC peak area of Taurine OPA derivation
2.1.2 衍生反应时间 衍生反应时间的长短对牛磺酸与OPA反应的程度有着直接的关系。时间过短,则反应不彻底;时间过长,则会使OPA衍生物迅速破坏。这都将影响检测结果的准确性或者重现性。因此,准确的控制衍生反应时间将是整个测定的关键。从图3可以看出,衍生时间不同,峰面积会有所变化,在衍生时间1.5min时峰面积达到最大,其检测灵敏度最高,随后开始下降,所以应将衍生时间准确控制在1.5min。

图3 衍生反应时间对牛磺酸OPA 衍生物色谱峰面积的影响Fig.3 Effect of reaction time on HPLC peak area of Taurine OPA derivation
2.2 色谱条件
实验研究表明,随着流动相中甲醇比例的减少,牛磺酸的出峰时间明显推迟,且牛磺酸的峰形变宽。当选用甲醇-纯水、甲醇-酸水时,牛磺酸的峰形很宽且拖尾很严重;当选用甲醇-0.05mol/L乙酸钠作为流动相,在流速为0.3mL/min,甲醇-0.05mol/L乙酸钠水溶液(pH6.0),23∶77,牛磺酸的出峰时间是9.805min,此时,样品中牛磺酸峰与其邻峰可以达到完全分离。
2.3 检测波长的选择
紫外全波扫描结果显示,牛磺酸在330nm处有一个很大的吸收峰,故选择330nm作为牛磺酸的检测波长。
2.4 提取条件的考察
2.4.1 提取方法 实验中分别考察了超声提取和水煎煮加热回流提取两种方法的提取效率,结果显示,超声三次和水煎煮加热回流三次提取出的牛磺酸含量相近,考虑操作的复杂程度,选择超声提取的方法提取牛磺酸。结果见图4a。
2.4.2 提取溶剂 提取溶剂分别为纯水、不同比例的甲醇溶液、不同比例的乙醇溶液对牛磺酸的提取效率见图4b。由图4b可知,甲醇作为溶剂对牛磺酸的提取效果明显低于乙醇,故选择乙醇作为提取溶剂。同时考察不同浓度的乙醇可知,随着乙醇的提高,牛磺酸的提取率呈先升高后下降的变化趋势,提取溶剂为70%乙醇牛磺酸的提取效果最好。乙醇浓度升高可以增大牛磺酸的溶解度,进而提高提取效果,但是当乙醇浓度为100%时会造成牛磺酸的含量下降。
2.4.3 提取溶剂比例 提取溶剂比例分别为1∶10、1∶15、1∶20、1∶30、1∶40、1∶50对牛磺酸的提取效率见图4c。由图4c可知,在溶剂比例为1∶10~1∶50范围内,牛磺酸的提取含量随着溶剂比例的升高而提高,当溶剂比例大于1∶30时,牛磺酸的提取含量不再增长,故提取溶剂的比例为1∶30。
2.4.4 提取时间 提取时间分别为30、60、90、120min时牛磺酸的提取效果见图4d。从图4d可以看出,在30~60min范围内,四种贝类软体中牛磺酸的提取含量随提取时间的延长而升高,之后若再延长时间,提取率不再增长。在一定范围内延长提取时间有利于牛磺酸的充分溶出,但提取时间过长,虽能增加牛磺酸的提取率,但需要耗费太多的时间、精力及功耗,考虑经济,最后提取时间定为60min。
2.4.5 提取次数 提取次数分别为1、2、3、4次的提取效果见图4e。由图4e可以看出,牛磺酸的提取含量会随着提取次数的增加而提高。在一定范围内增加提取次数,能够使牛磺酸的提取含量显著升高;但提取次数过多,虽能稍微提高牛磺酸提取效果,却需要耗费更多的时间、能耗。综合考虑,提取次数为3次。
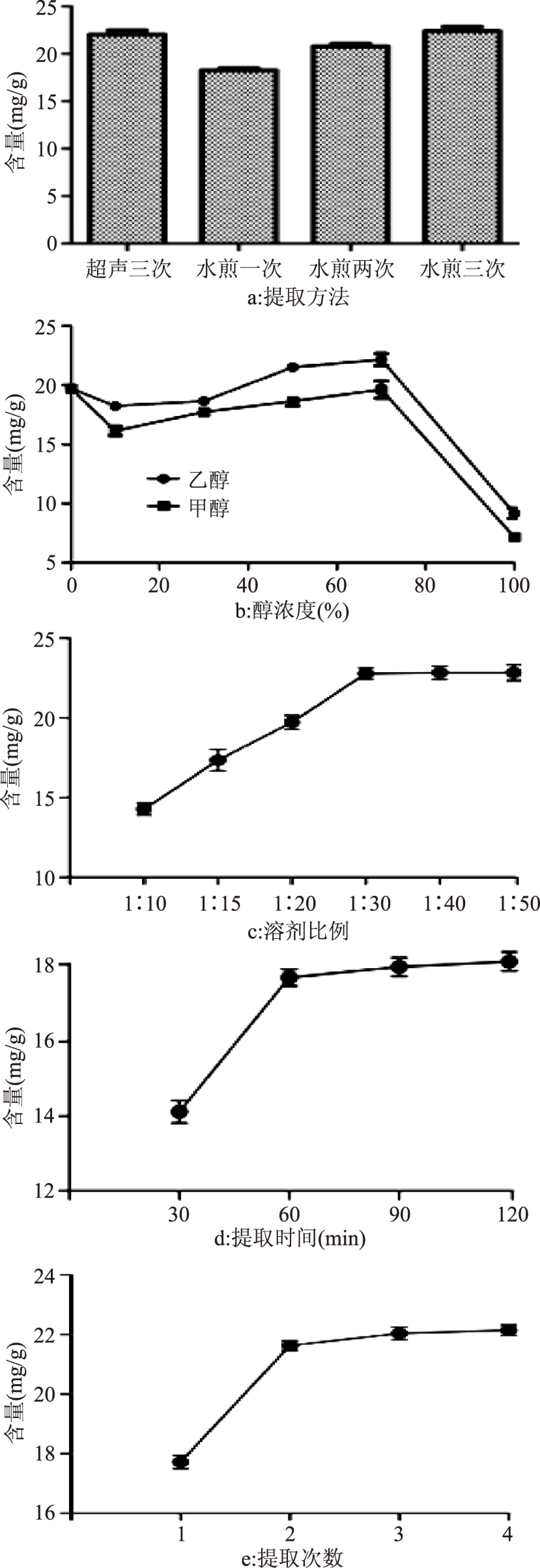
图4 不同提取方法对牛磺酸OPA衍生物含量的影响Fig.4 Effect of different extraction methods on the content of Taurine OPA derivation
2.5 线性关系考察
以各色谱峰的峰面积为纵坐标Y,浓度(μg/mL)为横坐标X,计算回归方程。进样浓度与峰面积呈良好的线性正相关,相关系数R2=0.9995,回归方程y=13098x-1696.3。取对照品溶液,用蒸馏水依次稀释制成一系列由高到低的梯度浓度溶液,然后进行衍生化反应,测定峰面积为噪音3倍(S/N=3)时进样浓度的检出限(LOD)为0.5003μg/mL:测定峰面积为噪音10倍(S/N=10)时进样浓度的定量限(LOQ)为1.5011μg/mL。
2.6 精密度实验
分别精密移取“2.5”项下0.20014、0.010007mg/mL和0.80056mg/mL牛磺酸对照品溶液,依法衍生,每种浓度平行处理3份,当日连续进样6次,则日内精密度RSD分别为2.82%、2.35%、1.70%。此外,连续三天分别进样3次,记录峰面积,并计算三种浓度点日间精密度RSD值分别为1.89%、2.69%、2.33%。
2.7 重现性实验
取文蛤软体冻干粉(2012.8)0.5g,精密称定,按供试品溶液制备方法平行制备6份,依法衍生,经0.45μm微孔滤膜,吸取2μL进样,每个样品平行测定3次,记录峰面积,计算其中牛磺酸的平均值为23.60g/kg,RSD值为1.88%。
2.8 稳定性实验
移取“2.7”项下样品1溶液,依法衍生,经0.45μm微孔滤膜,每隔半个小时进样一次(2μL),观察测定时间对待测物稳定性的影响。在衍生反应后的4h之内,测得的牛磺酸含量的RSD值小于5%;而4h后,测得的牛磺酸含量的RSD值大于5%。结果如图5。所以,在4h之内,衍生物是稳定的。

图5 衍生物稳定性实验结果Fig.5 Stability experiment results of Taurine OPA derivation

表2 菲律宾蛤仔、文蛤、青蛤和四角蛤蜊不同采收时间软体原料中牛磺酸含量测定结果Table 2 Contents of Taurine in different harvest time of Ruditapes philippinarum, Meretrix meretrix Linnaeus,Cyclina sinensis,and Mactra veneriformis Reeve
2.9 加样回收率实验
分别移取上述溶液1mL,依法衍生,进样分析,记录峰面积,采用外标法计算其中牛磺酸的浓度。结果见表1。

表1 回收率实验结果Table 1 Recovery experiment results
2.10 样品含量测定
分别取菲律宾蛤仔、青蛤、文蛤、四角蛤蜊蛤的软体2012年8月~2013年7月共12个月的冻干粉0.5g,精密称定,每份样品平行处理三份,按“1.2.7”项下方法制备样品溶液及衍生化反应,按“1.2.1”项下色谱条件进行测定,进样量2μL,测得峰面积,由峰面积外标法定量,结果见表2。
从表2可以看出,四种贝类软体中都含有较为丰富的牛磺酸,其中,菲律宾蛤仔软体中牛黄酸的含量是相对较高的,其含量在13.50~42.79mg/g范围之内,且最高是在七月份,约为42.79mg/g。其次是文蛤软体,含量为14.61~27.48mg/g,其中含量最高是在六月份,约为27.48mg/g。而青蛤和四角蛤蜊软体中牛磺酸的含量是很接近的,分别为7.62~16.59、9.09~15.00mg/g,且二者的最高含量的月份是在六月份,分别约为16.59、15.00mg/g。
3 结论
邻苯二甲醛(OPA)柱前衍生化结合HPLC-UV测定牛磺酸是国家食品标准中所采用的分析方法,OPA与巯基试剂在碱性条件下与牛磺酸迅速发生衍生反应,生成唯一的衍生产物,该产物具有紫外和荧光吸收。已有研究报道,高加龙等人[16]采用邻苯二甲醛(OPA)柱前衍生化结合HPLC-UV测定马氏珍珠贝中牛磺酸含量。故本课题组也尝试首次采用邻苯二甲醛(OPA)柱前衍生化结合HPLC-UV测定四角蛤蜊、文蛤、青蛤、菲律宾蛤仔软体中牛磺酸含量,结果表明衍生产物稳定,准确性高,精密度好,在330nm处有良好吸收。
四种贝类软体最佳采收期的确定(以牛磺酸为指标成分):从表2可以看出,四角蛤蜊、文蛤、青蛤、菲律宾蛤仔四种贝类软体均含有丰富的牛磺酸,其中以6、7月份中牛磺酸的含量相对较高。四种贝类中牛磺酸的含量相比较而言,菲律宾蛤仔软体中含有牛磺酸的含量是最高的,尤其是7月份,最高可达约42.79g/kg,其次是文蛤,其软体中牛磺酸含量最高是在6月份,约为27.48g/kg。而青蛤和四角蛤蜊软体中牛磺酸的含量相对较低且含量也较接近,含量最高都是在6月份,分别为16.59、15.00g/kg。
贝类的生长具有较为明显的季节性,一般春夏季生长较快,其中夏季水温25~28℃时是它的快速生长期,秋冬季生长缓慢。通常在5月至7月期间是贝类生长繁殖最为旺盛,各种营养成分也较为丰富,肥满度也是最高的,由此我们推测,若从产量和有效成分牛磺酸的含量变化上综合考虑,菲律宾蛤仔最佳采收期在7月,而文蛤、青蛤、四角蛤蜊最佳采收期在6月。本实验通过探讨并总结一年之中四种贝类软体中牛磺酸的动态变化规律,证实海洋贝类软体含有丰富的牛磺酸,其对沿海贝类的品质分析具有重大的科学指导意义,且能够为天然牛磺酸资源的利用提供理论依据。
[1]陈申如,胡阳,倪辉,等. 高效液相色谱法测定牡蛎中牛磺酸含量[J]. 中国食品学报,2013,13(2):193-198.
[2]Liu J,Liu L,Chen H. Antenatal taurine supplementation for improvine brain ultrastructure in fetal rats with intrauterine growth restriction[J]. Neuroscience,2011,181(5):265-270.
[3]Ricci L,Valoti M,Sgaragli G,etal. Protection by taurine of rat brain cortical slices against oxygen glucose deprivation and reoxygenation-induced damage[J]. European Journal of Pharmacology,2009,621(1):26-32.
[4]Zhang M,Bi LF,Fang J H,etal. Beneficial effects of taurine on serum lipids in over-weight or obese non-diabetic subjects[J]. Amino Acids,2004,26(3):267-271.
[5]Bhavsar TM,Cantor JQ,Patel SN,etal. Atternuating effect of taurine on lipopolyysaccharide-induced acute lung injury in hamsters[J]. Pharmacological Research,2009,60(5):418-428.
[6]华浩明,伊藤崇志,邱志刚,等. 牛磺酸对心血管系统作用及机理的研究进展[J]. 中国中药杂志,2005,30(9):653-658.
[7]王国明,陈俊荣,李积胜. 牛磺酸和锌对氟致神经系统损伤的拮抗作用[J]. 中国工业医学杂志,2007,20(6):399-401.
[8]李大庆,吴明均,胡晓华,等.牛磺酸研究进展[J]. 现代生物医学进展,2011,2(11):390-392.
[9]郑敏,吴基良,李立中. 牛磺酸对肾性高血压大鼠左室肥厚的保护作用[J]. 中国药理学通报,2003,19(5):536-539.
[10]曾凯宏,许红霞,张亚洁,等. 牛磺酸对糖尿病大鼠视网膜谷氨酰胺合成酶表达的影响[J]. 中国糖尿病杂志,2009,17(4):302-304.
[11]薛美兰,张华荣,姜长青,等. 牛磺酸抑制二甲基苯蒽诱发大鼠乳腺癌及其机制研究[J]. 营养学报,2008,30(1):57-60.
[12]汪学军,张慧,腾大为. 牛磺酸制备工艺的研究[J]. 化学工程师,1999,2(6):12-13.
[13]张晾,耿越,张静静,等. 高效液相色谱法快速测定海产品中牛磺酸[J]. 食品与药品,2006,8(4):56-58.
[14]Gillian P. McMahon,Richard,etal. High-performance liquid chromatographic determination of taurine in human plasma using pre-column extraction and derivatization[J]. Journal of Pharmaceutical and Biomedical Analysis,1996,14:1287-1294.
[15]任一平. 黄百芬. 胡红伟. 应用OPA柱前衍生法测定食品中的牛磺酸[J]. 食品与发酵工业,1995(1):43-48.
[16]钱爱萍,颜孙安,余亚白,等. 海产品中牛磺酸测定前处理方法探讨[J]. 中国农学通报,2006,22(5):94-97.
[17]高加龙,章超桦,刘书成,等. 邻苯二甲醛柱前衍生高效液相色谱法测定马氏珍珠母贝中牛磺酸含量[J]. 广东海洋大学学报,2007,2(27):55-58.
Study on the dynamic accumulation of taurine in four shellfish fleshof Jiangsu east costal and the appropriate harvest times
LI Na1,WANG Xin-zhi1,2,WU Hao1,2,*,YI Rui-zao3,LIU Rui1,2,WANG Ling-chong1,2,HE Bei-bei1,XIE Dong-yun1,CHEN Tao1
(1.Jiangsu Key Laboratory of Research and Development in Marine Bio-resource Pharmaceutics,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Jiangsu collaborative Innovation Center of Chinese Medicinal Resources Industrialization,Nanjing 210023,China;3.The 3rd Institute of Oceanography State Oceanic Administration,Xiamen 361005,China)
Four kinds of shellfish from the east coast of Jiangsu province were collected to research the dynamic changes of taurine in the shellfish flesh,in order to investigate the appropriate harvest times. To determine the content of taurine,a method of HPLC-UV combined with opthaldialdehyde was established,and the samples extracted by 70% alcohol were separated by a Kromasil 50mm×2.1mm C18column with the column temperature of 40℃. The mobile phase was composed of 23% methanol and 77% 0.05mol/L sodium acetate(pH6.0)at the flow rate of 0.3mL/min with gradient elution. The UV detection wavelength was 330nm. This method,with high sensitivity,good reproducibility,could accurately determine the content of taurine in four shellfish. Generally,the growth of shellfish had an obvious seasonal characteristic and its growth faster in spring and summer than autumn and winter,especially when water temperature was 25 to 28℃ in summer-the rapid growth period. During the period,the content of taurine reached its peak. Moreover,the content of taurine ofRuditapesphilippinarumreached highest was July,with 42.79mg/g.MeretrixmeretrixLinnaeus,Cyclinasinensis,MactraveneriformisReeve was in June,when the content of taurine was up to 27.48,16.59,15.00mg/g,respectively. In combination production with content changes of effective constituent-taurine,the best harvest time ofRuditapesphilippinarumwas recommended in July,withMeretrixmeretrixLinnaeus,Cyclinasinensis,MactraveneriformisReevewas in June.
Taurine;HPLC;harvest time;shellfish flesh
2014-05-04
李娜(1989-),女,硕士研究生,研究方向:海洋药物。
*通讯作者:吴皓(1957-),女,博士,教授,从事海洋药物研究开发以及中药质量标准研究。
国家公益性行业专项基金(201305007)。
TS254.1
A
1002-0306(2015)03-0054-06
10.13386/j.issn1002-0306.2015.03.002
