PRP联合盐酸川芎嗪对BMSCs体外增殖及向成骨细胞分化的影响
2015-06-01李树臣尚绪山李东陈民龙荫生
李树臣尚绪山李东陈民龙荫生
PRP联合盐酸川芎嗪对BMSCs体外增殖及向成骨细胞分化的影响
李树臣1尚绪山1李东1陈民1龙荫生2
目的通过将不同比例的富血小板血浆(Platelet-richplasma,PRP)与盐酸川芎嗪联合用于人骨髓间充质干细胞(Bone marrowmesenchymal stemcells,BMSCs),观察不同比例对其体外增殖及其向成骨细胞分化的影响。方法选取我院住院并签订知情同意书的患者为研究对象,抽取已签订知情同意书的患者静脉血50mL,分别二次离心法制备PRP,进行血小板计数分析。根据骨髓间充质干细胞培养是否加入药物为分组依据,分成A、B、C、D四组,A组为对照组,培养液中不加入药物,其余三组分别将体积分数为15%、30%、50%的PRP与80%盐酸川芎嗪按照1∶1.5混合加入骨髓间充质干细胞的培养液中,检测细胞的增殖状况,细胞达到80%融合,消化收集细胞;计数确定各组细胞培养情况,确定加入PRP和盐酸川芎嗪组对细胞培养的影响。对加入PRP和盐酸川芎嗪组培养的细胞进行成骨诱导,确定其成骨分化特性。结果各组PRP+盐酸川芎嗪促进MSCs增殖优于对照组。达到80%融合时间更短。随着PRP浓度增加细胞增殖效率显著增加。结论 PRP与盐酸川芎嗪对BMSCs的体外增殖有促进作用,与PRP体积分数和作用时间呈正相关关系。
骨髓间充质干细胞;富血小板血浆;盐酸川芎嗪;体外增殖;实验研究
PRP是通过离心全血后得到的血小板的浓缩物,含有大量生长因子,如血小板源性生长因子、转化生长因子、胰岛素样生长因子、血管内皮生长因子等,其中以血小板源性生长因子和转化生长因子对促进骨生长和骨修复最为重要[1]。研究发现PRP加速组织修复的能力取决于其高浓度的生长因子[2],而 PRP中生长因子的浓度则与其中的血小板计数呈正相关关系。近年来有临床研究表明PRP有助于骨组织的愈合和再生[3]。据报道,川芎嗪可以诱导小鼠骨髓间充质细胞分化为神经元样细胞,最佳诱导剂量为1.25g/L[4]。据此提出一个假设PRP是否可以与川芎嗪联合用于诱导成骨细胞的分化,所以实施本实验。
体外实验需时短、实验条件和因素易于控制,便于进行复杂的实验设计,具有避免体内实验伦理学问题优点,在现代医学的发展中发挥着极为重要的作用[5]。研究证明BMSCs经过长期体外培养,细胞增殖能力降低,但不会引起恶性变[6]。本研究作为课题的前期工作,通过制备PRP,以不同浓度联合中药川芎嗪对人BMSCs进行培养,观察不同浓度对体外增殖及其向成骨细胞分化的影响。
1 材料和方法
1.1 实验对象
在我院住院患者,经知情同意者。
1.2 药物及试剂
L-DMEM[低糖细胞培养基(批号16000044,美国)],优等胎牛血清(批号 SV30087.02 Hyclone,南美),Percoll[硅胶颗粒混悬分层液(1.073×10-3g·L-1,Sigma,美国)],PBS(无菌磷酸盐缓冲液)(批号:20012-027,Gibco,美国),CD(单克隆抗体)13-PE(藻红蛋白)、CD29-FITC(异硫氰酸)、CD34-FITC及 CD45-PE(BD医疗器械有限公司,美国),川芎嗪粉针剂(每支5mg,上海现代哈森(商丘)药业有限公司,批号11032912;日期2011年3月29日~2013年)。
1.3 实验方法
1.3.1 PRP制备方法[7]
抽取已签订知情同意书的患者静脉血50mL,使用二次离心法制备PRP,然后进行血小板计数分析。
1.3.2 分组及给药
该实验共分四组(由于实验对象数量有限,没有设立PRP组和单用盐酸川芎嗪组)。A:对照组,培养液内不加入药物进行骨髓间充质干细胞培养;实验组分为B、C、D三组,分别将体积分数为15%、30%、50%的PRP与1.25g/L盐酸川芎嗪(盐酸川芎嗪的浓度按照所查文献确定)按照1∶1.5混合加入骨髓间充质干细胞的培养液中,(B:15% PRP+1.25g/L盐酸川芎嗪;C:30%PRP+1.25g/L盐酸川芎嗪;D:50%PRP+1.25g/L盐酸川芎嗪)。
1.3.3 BMSCs培养
取4份3mL骨髓加入等量L-DMEM稀释混匀后,1000r/ min,弃上清液,加入等量 L-DMEM稀释混匀后1000r· min-1×15min,弃上清液,沉淀加入含10%胎牛血清的L-DMEM混匀,接种至1个25cm2培养瓶放入37℃、5%CO2,95%湿度的 CO2孵箱培养;72小时后更换培养基,弃掉未贴壁细胞,以后每2~3天换一次;待细胞达80%融合时,用0.125%胰蛋白酶+0.02%EDTA(依地酸钠钙)消化,弃去胰酶,加入适当培养液重悬,轻轻吹打,用吸管吸取细胞悬液至离心管,1000r·min-1×5min,弃上清液;加入2mLL-DMEM重悬细胞沉淀并吹打成单细胞悬液,用计数板显微镜下计数,按6000~8000·cm-2进行传代接种培养,标记为P1代,培养过程中每2~3天换液一次,直至贴壁细胞约80%融合,再次传代为P2代。
取P2代制成的单细胞悬液,按1.5×10000·cm-2接种至六孔板;待细胞长至完全融合时,实验组每孔加2.5mL诱导液。(本课题提供PRP+1.25g/L盐酸川芎嗪),对照组仍用含10%胎牛血清的L-DMEM培养;每隔3天换一次,第21天终止诱导;吸去培养液,PBS冲洗2次;95%乙醇固定30min。蒸馏水冲洗3次;茜素红染液37℃染色30min;蒸馏水冲洗3次,显微镜下摄像。
1.3.4 成骨诱导分化鉴定[8]
以成骨诱导培养基(100nmol·L-1地塞米松、50 mol· L-1左旋VitC、10nmol·L-1-磷酸甘油、50nmol·L-1FK506(他克莫斯))对P2代细胞培养。第7、14天时行碱性磷酸酶钙钴法染色、钙茜素红染色和Ⅰ、II型胶原免疫组化。
一是社会突发事件。社会突发事件往往最容易形成网络舆情,在信息化时代,任何社会突发事件有可能引起网友激烈的讨论。由于网络社群的观点不一,极易发生言论冲突,如果不及时处理,会引发群众过激反应,给社会稳定带来威胁。
2 结果
2.1 碱性磷酸酶钙钴法(14天结果)
诱导组细胞于第7天左右可见细胞表面,培养液内有较多棕褐色细小颗粒出现。随着诱导时间延长棕褐色颗粒明显增加,第14天时阳性反应更明显(图1A),对照组两个时间段阳性程度明显较弱(图1B)(图1彩图见插页)。

图1 倒置相差显微镜(×10)
2.2 钙茜素红染色(14天结果)
诱导组细胞于第7天即可见阳性反应,细胞表面出现较多红色着色。第14天时阳性反应更明显(图2A),对照组两个时间段阳性程度明显较弱(图2B)(图2彩图见插页)。
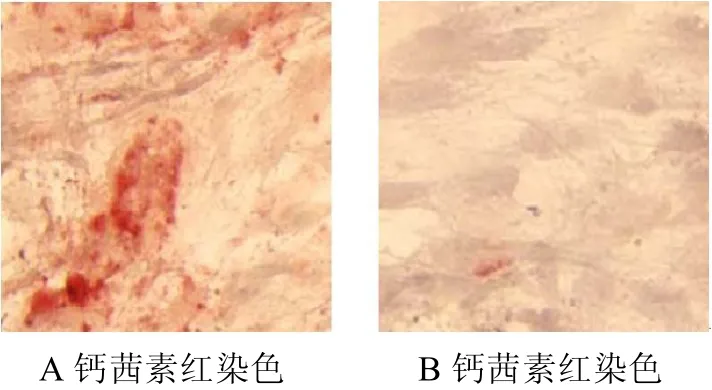
图2 倒置相差显微镜(×10)
2.3 Ⅰ型胶原免疫组化
诱导组细胞培养至第14天,细胞外基质可见大量条带状棕褐色着色。第14天时阳性反应更明显(图3A),对照组基本无阳性反应(图3B)(图3彩图见插页)。
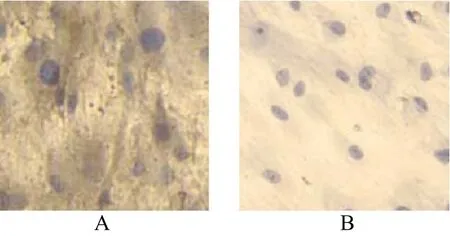
图3 Alcian Blue染色倒置相差显微镜(×10)
2.4 II型免疫组化反应(14天结果)
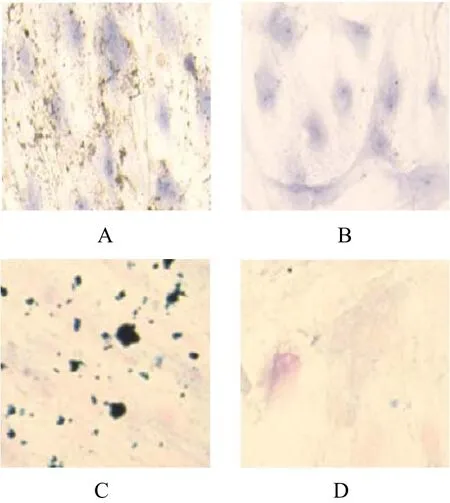
图4 Alcian Blue染色倒置相差显微镜(×10)
2.5 细胞形态学观察(照片)
接种后第一天贴壁形态,图5。经三个不同比例 PRP+ 1.25g/L盐酸川芎嗪培养10天,A只达到70%融合。B、C、D组已达到90%融合(图6)(图5、图6彩图见插页)。
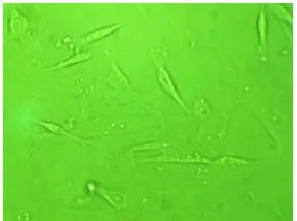
图5 荧光素照片倒置相差显微镜(×10)

图6 荧光素照片倒置相差显微镜(×10)
B,C组无明显诱导培养后细胞数量差异免疫组化阳性反应较对照组稍强,D组可见细胞融合好,数目相对较多,免疫组化显示阳性反应较对照组更明显。说明 50%PRP+ 1.25g/L盐酸川芎嗪组配比较佳。
2.6 细胞表面标记鉴定
经流式细胞仪检测,BMSCs均一地表达CD13、CD29,HLA-DR(人类白细胞抗原),阳性率分别为99.97%、98.46%和94.27%;而CD34、CD45和HLA-DR阴性,阳性率分别为5.16%、1.34%和3.13%。
3 讨论
BMSCs具有成骨分化能力,能够促进骨组织修复[9]。但是由于数量有限且较少,修复大的骨缺损需要较长时间。然而缓慢的修复过程可能会导致修复的失败和加重人体的不可逆性损害。加快修复的首要条件是要有足够的BMSCs。因此BMSCs的体外培养增殖是不可或缺的。为了短时间内在体外培养出足够的BMSCs,研究者一直在不断地寻找快速、高质量的BMSCs培养基。
由于体内实验诱导分化率远较体外实验低,不同浓度的细胞因子有不同的诱导分化率[10],中药及其提纯物为诱导分化提供了新思路。1999年研究者报道[11],血浆富含生长因子,利用其培养BMSCs,可以加强和加速骨再生,更迅速的软骨组织愈合。而PRP中生长因子的浓度则与其中的血小板计数呈正相关关系[12]。
Ferreira等[13]在研究富血小板血浆对人成骨细胞生长的影响时发现,当使用50%PRP来培养时结果成骨细胞生长较快,但是在更深入的研究中发现12.5%和6.125%PRP成骨细胞生长无统计学差异。该实验研究发现,随着PRP体积分数和作用时间的增加,骨髓间充质干细胞体外增殖越快。本研究与前者区别就是加入了中药川芎嗪。
川芎嗪是从中药川芎中提取的一种生物碱单体,是一种新型的钙离子拮抗剂,对中枢神经系统有镇静作用,具有促进骨髓移植后造血重建等作用[14]。川芎嗪可体外诱导大鼠BMSCs分化为神经元样细胞,诱导后神经元样细胞初步观察可活5天。研究表明川芎嗪能使BMSCs定向分化为神经元样细胞,细胞内、外Ca2+的减少可促进川芎嗪诱导BMSCs向神经细胞的分化[15,16]。
本研究表明PRP联合盐酸川芎嗪对BMSCs的体外增殖有促进作用,与PRP体积分数和作用时间呈正相关关系。但本研究有不足之处:由于川芎嗪为中药,药物辅料的存在可能会对结果产生一定影响;实验分组是未设立PRP组和单用盐酸川芎嗪组,可能会忽略其中一种药物的某种作用。对于二者共同应用BMSCs基中时二者之间是否发生反应,对于中药联合应用的机制尚不明确,尚需进一步深入研究。中药诱导BMSCs定向分化是近年来一个新兴的研究领域,中药有着源广、价廉、副作用小等优点,对干细胞长期生长分化无毒且有利于分化后细胞活体移植。所以,采用联合中药培养BMSCs具有美好的前景。
[1] Zhang Li,Peng Li-pan,Wu Nan,et al.Development of bone marrow mesenchymal stem cell culture in vitro[J].中华医学杂志(英文版),2012,125(9):1650-1655.
[2]苏晓慧,孔祥英,吴文彬,等.风湿清对RANKL诱导的RAW264.7细胞向破骨细胞分化的影响[J].中国实验方剂学杂志,2013,19(4):173-176.
[3]杨丽,赵新兰,雷丹丹,等.miR-125a/TRAF6调控通路在破骨细胞分化中的作用研究[J].疑难病杂志,2014(11):1160-1164.
[4] 陈兵,尹延庆,柯俊龙,等.川芎嗪诱导大鼠骨髓间充质干细胞分化为神经元样细胞:最佳诱导剂量筛选[J].中国组织工程研究与临床康复,2010.
[5] 张元豫,郭永荣,刘霞等.人破骨细胞分化中重组结核杆菌热休克蛋白10的影响[J].中国组织工程研究,2014(38):6116-6122.
[6] 何飞,吴勇,周艳,等.Notch信号促进核因子 B受体活化因子配体诱导的破骨细胞分化的体外研究[J].华西口腔医学杂志,2015(1):25-28.
[7] 董伟,冯晓洁,梁永强,等.双膦酸盐对破骨细胞分化及抗酒石酸酸性磷酸酶的影响[J].中国组织工程研究,2014(38):6069-6073.
[8] 王汝杰,邓小军,刘复州,等.Jagged1活化Notch通路促进破骨细胞分化并抑制其增殖[J].中华实验外科杂志,2014,31(10): 2262-2264.
[8] 甄茹,俸婷婷,赵致,等.黑骨藤抑制破骨细胞分化及骨吸收能力的活性部位研究[J].中国实验方剂学杂志,2015,21(1):112-116.
[9] 张杭,孙天威.骨髓间充质干细胞分化为神经细胞研究进展[J].国际骨科学杂志,2011,32(2):104-106.
[11]Li Jinghui,Liu Dayong,Zhang Fangming,et al.Human dental pulp stem cell is a promising autologous seed cell for bone tissue engineering[J].中华医学杂志(英文版),2011,124(23):4022-4028.
[12]Du William,Fang Ling,Yang Weining,et al.The role of versican G3 domain in regulating breast cancer cell motility including effects on osteoblast cell growth and differentiation in vitro-evaluation towards understanding breast cancer cell bone metastasis[J]. BMC Cancer,2013,12(1).
[13]Zhang Xiao,Lin Liang-bo,Xu Dao-jing,et al.Wntaenhances bone morphogenetic protein 9-induced osteogenic differentiation of C3H10T1/2 cells[J].中华医学杂志(英文版),2013,126(24): 4758-4763.
[14]Liu Bowu,Lv Anlin,Hou Jing,et al.Cardiac differentiation and electrophysiology characteristics of bone marrow mesenchymal stem cells[J].中华医学杂志(英文版),2012,125(18):3318-3324.
[15]刘云云,赵兴绪,赵红斌,等.Ca2+信号介导川芎嗪诱导小鼠骨髓间充质干细胞向神经细胞的定向分化[J].甘肃农业大学学报,2010,45(2):1-5.
[16]康健,侯洋,周许辉,等.全骨髓贴壁法获取组织工程髓核种子细胞的相关研究[J].生物骨科材料与临床研究,2014,11(1): 10-15.
Impacts of PRPand ligustrazine hydrochloride on BMSCs in vitro prolif-eration and definitive differentiation to osteoblast
Objective To applythe combinedadministrationof platelet-richplasma(PRP)and 1i-gustrazinehydrochloride on human bone marrow mesenchymal stem cell(BMSCs)at different ratios and observe the impacts on the in vitro proliferation and definitive differentiation to osteoblast.Methods Select hospital and signed informed consent in our hospital patients as the research object,the extraction have been signed informed consent of vein blood of patients with 50mL, two PRP were prepared by centrifugal casting,the platelet count analysis.According to the bone marrow mesenchymal stem cells cultured on whether or not to join the drug is the grouping basis,divided into A,B,C,D four groups,group A was the control group,the drug does not join in culture liquid,the other three groups respectively,the volume fraction of15%,30%,50%PRP and 80%of ligustrazine hydrochloride inaccordancewith 1:1.5mix bonemarrowmesenchymal stem cells were cultured in the media,the detection of cell proliferation,cell reached 80%confluence,digestive cells were collected;count was determined incell culture conditions,todetermine the influenceofjoiningPRP and ligustrazine hydrochloride group on cell culture.To join the PRP and ligustrazine hydrochloride group cultured cells of osteogenic induction,determinetheosteogenicdifferentiation.Results PRP+ligustrazinehydrochloride promotedBMSCs proliferation in each group,which was superior to the control group and 80%of infusion was obtained in very short time.With the increase of PRP concentration,the efficiency of cell proliferation was enhanced significantly.Conclusion PRP and ligustrazine hydrochloride promote the in vitro proliferation of human BMSCs,which presents the positive correlation with PRP volume fraction and effect time.
Bonemarrowmesenchymalstemcells(BMSCs);Platelet-richplasma(PRP);Ligustrazine Hydrochloride; In Vitro Proliferation
R318.5
A
10.3969/j.issn.1672-5972.2015.05.001
swgk2015-01-00014
李树臣(1967-)男,本科,副主任医师。研究方向:神经内科、血液。
2015-01-26)
1山东省新泰市第二人民医院,山东新泰271219;2河南省洛阳正骨医院,河南洛阳471013
