海洋微生物在船舶用结构钢表面附着成膜过程及其腐蚀研究
2015-06-01董耀华贺中意董丽华
董耀华,贺中意,郭 娜,刘 涛,董丽华
(上海海事大学 海洋科学与工程学院,上海 201306)
海洋微生物在船舶用结构钢表面附着成膜过程及其腐蚀研究
董耀华,贺中意,郭 娜,刘 涛,董丽华*
(上海海事大学 海洋科学与工程学院,上海 201306)
通过紫外分光光度计测定了海洋微生物需钠弧菌Vibrionatriegens的生长曲线,通过扫描电镜和原子力显微镜观测了该细菌在船舶用结构钢(DH32)钢样表面成膜过程及试样腐蚀形貌,探讨了生物膜的形成过程及其对材料表面腐蚀的影响。结果表明,生物膜的形成过程与微生物生命活动关系密切。根据对比暴露在菌液和无菌培养基中的试样表面形貌,发现细菌的附着及成膜过程的不均匀性,改变了DH32钢样表面的物理和化学状态。细菌附着区与周围形成的氧浓差电池,以及细菌新陈代谢主要产物对金属离子的络合,共同促进了试样局部腐蚀加速。
海洋微生物;生物膜;腐蚀
0 引言
海洋船舶用结构钢作为最常见的涉海材料之一,主要包括高强钢AH32、DH32、AH36和DH36等,厚度在12~30 mm之间,这类船舶用钢强度高,但耐海洋环境生物腐蚀的性能却比较差。海洋微生物活性所引起的微生物腐蚀(microbially-influenced corrosion, MIC)已经被公认为是船舶及海洋工程用结构钢腐蚀破坏的重要形式[1-3]。在海洋环境中服役的船舶,由海洋污损导致的燃油消耗增加可达40%,航次总成本增加可达77%,而且每年仅用于全球船只防污剂美观工艺的花费约有7亿美元,此外更为严重的是,船舶海水冷却管道和诸如船舶压载舱等各种液体舱的微生物腐蚀破坏也极大地影响船舶寿命及安全性[4-5]。
大量的实验表明,在海洋环境中,与金属直接接触的腐蚀介质并非海水而是微生物,所以可以肯定船舶用钢腐蚀破坏的重要发生因素是微生物通过在材料表面附着及形成的生物膜与其发生相互作用,使得材料表面始终处于非稳定状态,直接或间接参与和影响了金属的腐蚀过程[6],从而导致金属性能的劣化和破坏。MIC是一个相当复杂的生物和化学过程,目前有关MIC的研究层出不穷,例如REMAZEILLES et al[7]认为,微生物膜对阴极反应动力学的影响可能导致腐蚀电位的正移,同时微生物膜内形成的氧浓差电池和阴极反应速度的增加使得天然海水比无菌海水更具腐蚀性。JAVAHERDASHTI et al[8]认为,金属表面的酸化和微生物膜内的过氧化氢的产生是导致材料腐蚀电位正移的原因。BEECH[9]研究了腐化海水环境中碳钢的腐蚀行为,提出微生物膜内硫酸盐还原菌(SRB)的存在是加速材料腐蚀的主要原因,他认为SRB释放的硫化氢导致膜内pH值下降,加速了阳极溶解。OSIRO et al[10]也证实了相关的结论,同时提出微生物膜内特殊酶的作用也是影响材料腐蚀行为的主要因素之一。赵军 等[11]却认为微生物胞外分泌物(EPS)是影响材料腐蚀行为的主要原因。此外,也有大量学者认为微生物膜的形成可以阻碍溶解氧的扩散或分泌某种具有缓蚀作用的物质,从而抑制材料腐蚀,起到保护材料的作用[12-15]。由此可见,目前大部分研究主要着眼于生物膜对金属腐蚀的影响及机制,很少去分析生物膜形成的过程,而事实上,微生物的附着过程对船舶用钢的耐海洋微生物腐蚀研究却至关重要[7]。本文以DH32钢为研究对象,以海洋环境中普遍存在的需钠弧菌Vibrionatriegens为实验菌种,使用紫外分光光度计(UV-Vis,PerkinElmer,Lambda35)、电子扫面显微镜(SEM,JEOL,JSM7500F)和原子力显微镜(AFM,Bruke,Dimension ICON)等测定了V.natriegens的生长曲线,探讨了其在DH32钢样表面的附着过程以及对试样腐蚀行为的影响。
1 实验方法
1.1 材料和试样
实验材料为碳钢DH32,其主要合金成分为:Fe 96.79%,C 0.056%,Mn 1.496%,Cu 0.198%, Al 0.037 5%,Ni 0.662%,Cr 0.183%,Si 0.191%和P 0.008 5%。实验前,将DH32钢板用线切割机切成一批尺寸为10 mm×10 mm×3 mm的钢样,将其任意10 mm×10 mm的一面选择为工作面,非工作面用焊接导线,并用环氧树脂封装,工作面并经300#、600#、800#和1 200# 耐水SiC砂纸依此打磨,然后用0.3 μm氧化铝粉末进行抛光处理,丙酮超声除油,最后用乙醇冲洗、自然干燥待用。
1.2 细菌培养及生长曲线测定
需钠弧菌采用淀粉牛肉膏蛋白胨培养基培养。淀粉牛肉膏蛋白胨培养基是一种应用最广泛和最普通的细菌基础培养基,其成分为:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L和可溶性淀粉2 g/L。
生长曲线通过比浊法测定。具体步骤如下:用移液枪吸取0.01 mL过夜V.natriegens菌液,加入到100 mL无菌培养基中(培养基成分为:1 L 过滤后的无菌海水、10 mg/L FePO4、5 g/L蛋白胨和1 g/L 酵母汁),然后放置于生化培养箱中培养,按照实验预设时间,每次取出0.5 mL与4.5 mL无菌培养基混合均匀后用紫外-可见分光光度计(UV-Vis,Lambda 35)测定在600 nm下的O.D600 nm值。实验做3个平行样,结果取3次测量的平均值。
1.3 微生物在金属表面附着成膜过程观测
将准备好的DH32试样依此用尼龙绳悬挂放入新培养的需钠弧菌培养液中,每7 d更换一半的培养基。按照实验预设时间间隔依此将试样取出,并用PBS缓冲液缓慢冲洗工作表面,然后将试样置于100 mL含2%戊二醛的PBS溶液中固化5~8 h,取出后,依此用体积分数分别为25%,50%,75%和100%的乙醇逐级脱水,然后低温干燥[8]。利用SEM(Japan, JEOL , JSM7500)在5.0 kV工作电压下对其表面进行扫描电镜观察,同时采用能谱仪(EDS)进行材料表面元素种类分析及含量测定。
1.4 材料表面腐蚀微观形貌
刮取试样表面的生物膜和腐蚀产物,乙醇逐级脱水,低温干燥后,再次使用原子力显微镜(AFM,Dimension ICON)在轻敲模式下作表面观察。实验以无菌培养基作对照,试样处理方法与有菌培养基处理方法相同。
2 实验结果与讨论
2.1 细菌生长曲线
根据比浊法,使用紫外-可见分光光度计测定菌液透光度,再据其与菌液中细菌数量之间的线性关系,得到细菌的生长曲线,如图1所示。
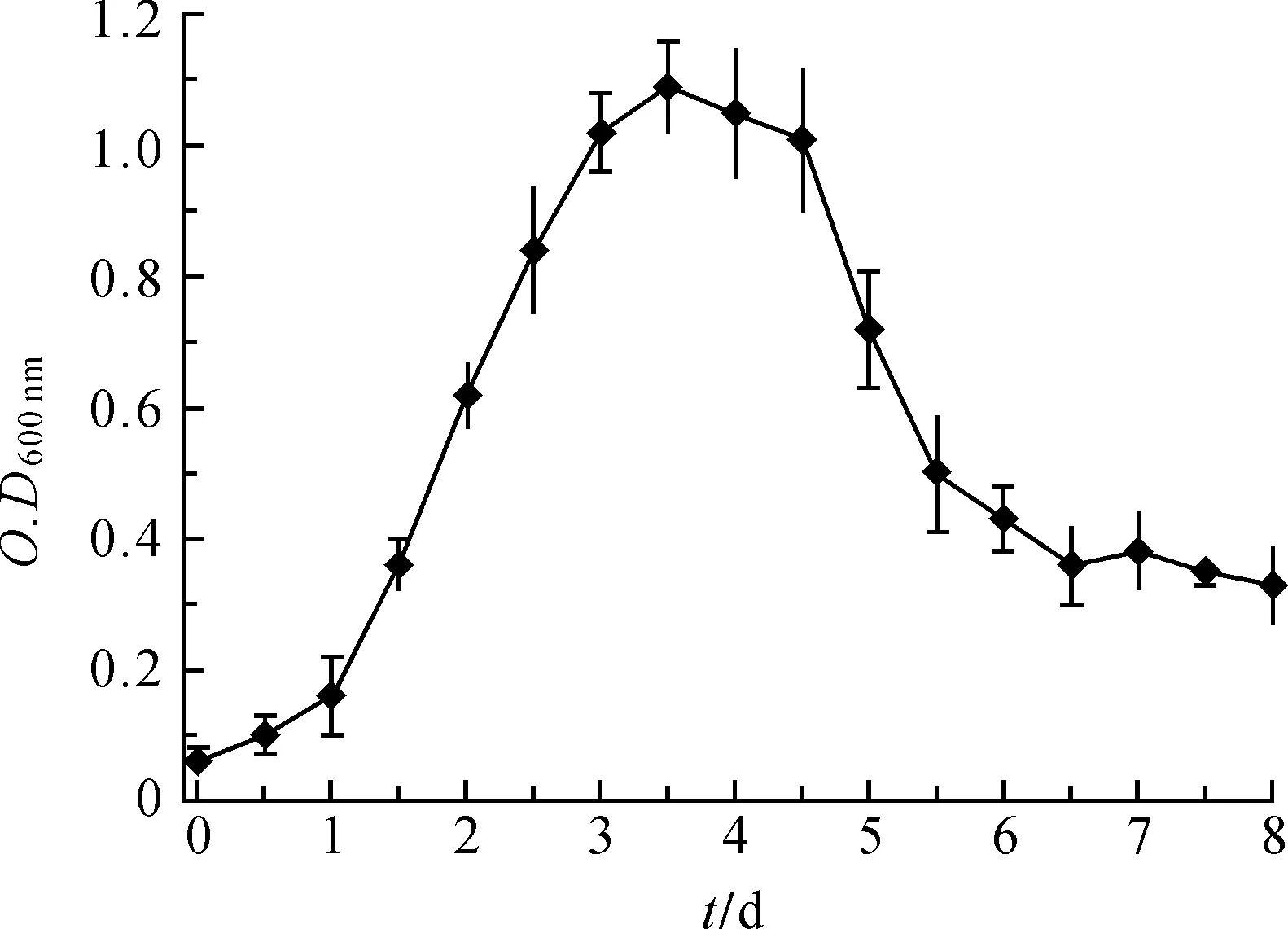
图1 需钠弧菌的生长曲线
从实验结果来看,V.natriegens的生长过程大致可以分为4个阶段:最初的1个阶段为生长延滞期,出现在需钠弧菌扩培的第1天,这段时间由于培养基成分和生长环境的变化等因素,影响了需钠弧菌生长,具体表现为尽管需钠弧菌形态开始变大或增长,细胞合成代谢十分活跃,核糖体和酶类等合成加速,胞内RNA尤其是rRNA含量也在增高,原生质呈嗜碱性,变得均匀,但需钠弧菌暂时停滞生长,数量增长速率常数为零。第2个阶段为生长指数期,或者称生长对数期,出现在扩陪的第2天至第3天,这段时间里,需钠弧菌代谢旺盛,酶系活跃,细菌数量以几何级数快速增长,并在3 d后达到最大值。第3个阶段为稳定期,出现在生长指数期的随后1 d左右时间内,特点是需钠弧菌数量大致恒定,即处于新繁殖的细胞数量与衰亡的细胞数量相等的动态平衡中,这时的需钠弧菌产量达到了制高点,菌体的产量与培养基中营养物质的消耗呈现规律比例关系。从第5天开始,需钠弧菌进入第4个阶段,即衰亡期,此时,外界环境对需钠弧菌生长越来越不利,细胞形态相继发生变化,甚至因蛋白水解酶活力的增加而发生自溶现象,细菌大量死亡,个体死亡速率超过新生速度,培养基中呈现细菌负生长状态。
2.2 微生物在金属表面附着成膜过程分析
需钠弧菌是一种在海洋环境普遍存在的固氮类细菌,并且是世界上繁殖速度最快的细菌之一,极易在材料表面形成生物膜[3]。图2是DH32试样悬挂于需钠弧菌的培养基中不同时期的表面细菌附着形貌SEM照片。从图中可以看出,试样浸泡1 d后,原本光滑的表面上附着了一些零星的细菌个体和少量的腐蚀产物;浸泡3 d后,试样表面开始形成分布不均的菌落,细菌显著变多,并呈链状排列;浸泡5 d后,可以观察到明显的细菌新陈代谢产物,即EPS。之后,随着时间的推移,试样表面附着的细菌越来越多,菌落也逐渐变大,试样可见面积越来越小,42 d后,试样表面被一层致密的微生物膜完全覆盖。
结合需钠弧菌生长曲线的测定结果可知,在试样浸泡初期,细菌处于生长延滞期,培养基中细菌数量不多,所以只有零星的细菌以个体形式附着在试样表面,而这种附着过程,可能是因为试样放入培养基后,表面会吸附一些溶解态的有机物或无机物,改变了材料表面的电荷电性或憎水性等特征,使得具有类似胶体表面的细菌被吸附到了材料表面。之后随着对环境的适应,细菌进入生长指数期,开始大量繁殖,吸附在试样表面的细菌也开始形成菌落,胞外分泌物开始变多。这种分泌物可以部分解释细菌黏附到材料表面的原因,因为它可以帮助微生物紧紧地吸附在材料的表面。在接下来的时间里,材料表面的菌落越来越多,这一方面是由于细菌的附着使得材料表面状态发生了改变,细菌的附着变得越来越容易,另一方面是已经附着的细菌也在材料表面继续繁殖,这个过程中,生物膜逐渐形成,而且越来越厚,里面不仅仅是活的细菌,还包括它们新陈代谢的产物和衰亡的细菌,这种复杂的结构使得材料与微生物之间形成了一种半生命、半活性的特殊复合界面结构。
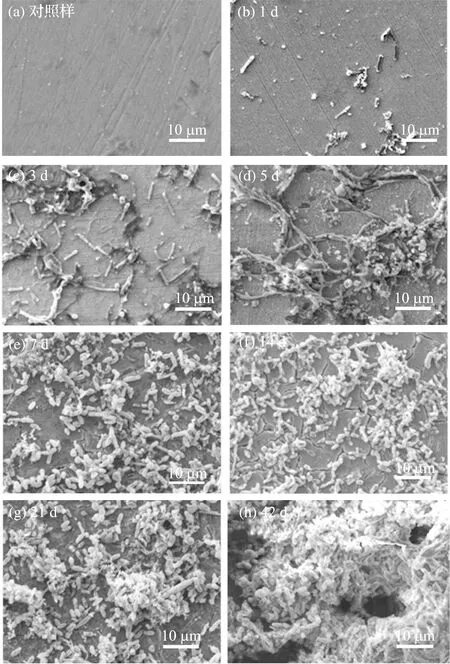
图2 DH32试样在菌液中浸泡不同时间后表面细菌 附着的SEM形貌
图3是DH32试样在菌液中浸泡不同时间后,表面的EDS谱图。由图可见,浸泡1 d后,试样表面的主要化学元素为Fe、C、Mn和少量的P(图3a)。浸泡7 d后(图3b),试样表面检测出O、N和Na等元素,而且P和C元素含量成倍增长。21 d后(图3c),P和O元素含量持续增长,而且检测出S元素的存在。此外,从检测结果看来,Fe元素含量随时间推移持续减少。
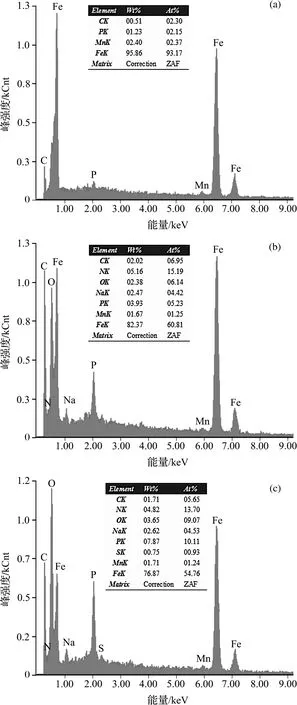
图3 试样在菌液中浸泡1 d(a)、7 d(b)和 21 d(c)后表面EDS能谱图
元素Fe、C和Mn是DH32冶炼中的主要成分,元素P、O、N和S是微生物生命活动必不可少的生命元素。第1天少量P元素的出现,说明试样表面有少量细菌附着,但因没有检测出O元素,所以可以判断,此时试样几乎没有受到培养基和细菌的影响,这与SEM观察到的结果基本一致。随后的20 d内,N和S元素依次出现,P和O元素持续增多,这些生命元素的变化,说明材料表面的生物膜逐渐形成,同时从Fe元素含量逐渐降低的趋势来看,微生物膜随时间推移越来越致密,使得试样表面的Fe元素越来越难被检测到。
2.3 表面腐蚀微观形貌
为了直观地了解微生物附着过程对材料腐蚀的影响,使用无菌培养基浸泡试样作为对照,比较两种情况下,试样的腐蚀程度。图4a和图4c分别为试样暴露在菌液中3 d和42 d后的表面AFM腐蚀形貌图,图4b和图4d为试样暴露在无菌海水中3 d和42 d后的表面AFM腐蚀形貌图。从图中可以看出,前3 d内,浸泡在两种腐蚀介质中的试样表面粗糙度较小,且没有显著区别,这说明浸泡初期,细菌生长延滞,新陈代谢活性不高,试样表面附着的细菌也不多,试样的腐蚀以海水腐蚀为主,细菌对试样腐蚀行为的影响不大。但在随后的观察中可以发现,浸泡在菌液中42 d后的试样,其表面粗糙不堪,其局部腐蚀程度明显大于对照样。这说明,微生物的附着和繁殖过程,改变了试样表面的物理和化学状态,影响了材料腐蚀行为,并在局部起到剧烈加速材料腐蚀的作用。
由于需钠弧菌是一种需氧细菌,其新陈代谢活动需要消耗氧气[3]。在需钠弧菌附着的过程中,菌落的形成和分布并不均匀,所以其局部的耗氧活动无疑会导致试样表面细菌附着区局部溶解氧的降低,而周围区域氧含量较高,进而造成试样表面富氧区和贫氧区的分化,使局部形成氧浓差电池,贫氧区形成阳极,周围成为阴极,从而加速材料局部腐蚀。尽管部分研究者认为微生物的生命活动可以改变环境pH值,进而影响材料腐蚀行为[16],但从图4c中明显的不均匀腐蚀形貌来看,氧气浓度的变化对金属腐蚀的影响要大于pH值变化的影响,氧气对阴极的去极化作用可以使材料加速腐蚀。造成试样在微生物附着成膜过程中加速腐蚀的另外一个原因可能也和细菌新陈代谢产物EPS有关。EPS主要由蛋白质、多糖、核酸和脂类等高分子物质组成,其中含有大量的诸如羟基、羧基、磷酸根、硫酸根、甘油酸根、丙酮酸根和琥珀酸根等带负电的官能团[17-18]。这些官能团有一个重要的特点,即能与带正电荷的金属离子,如Fe3+、Mn2+和Cu2+等结合发生络合反应,从而作为电子运输器,在微生物膜和金属基体之间开启新的氧化还原反应途径,导致电子从基体向受体的转移,促进试样阳极溶解,加速材料腐蚀。
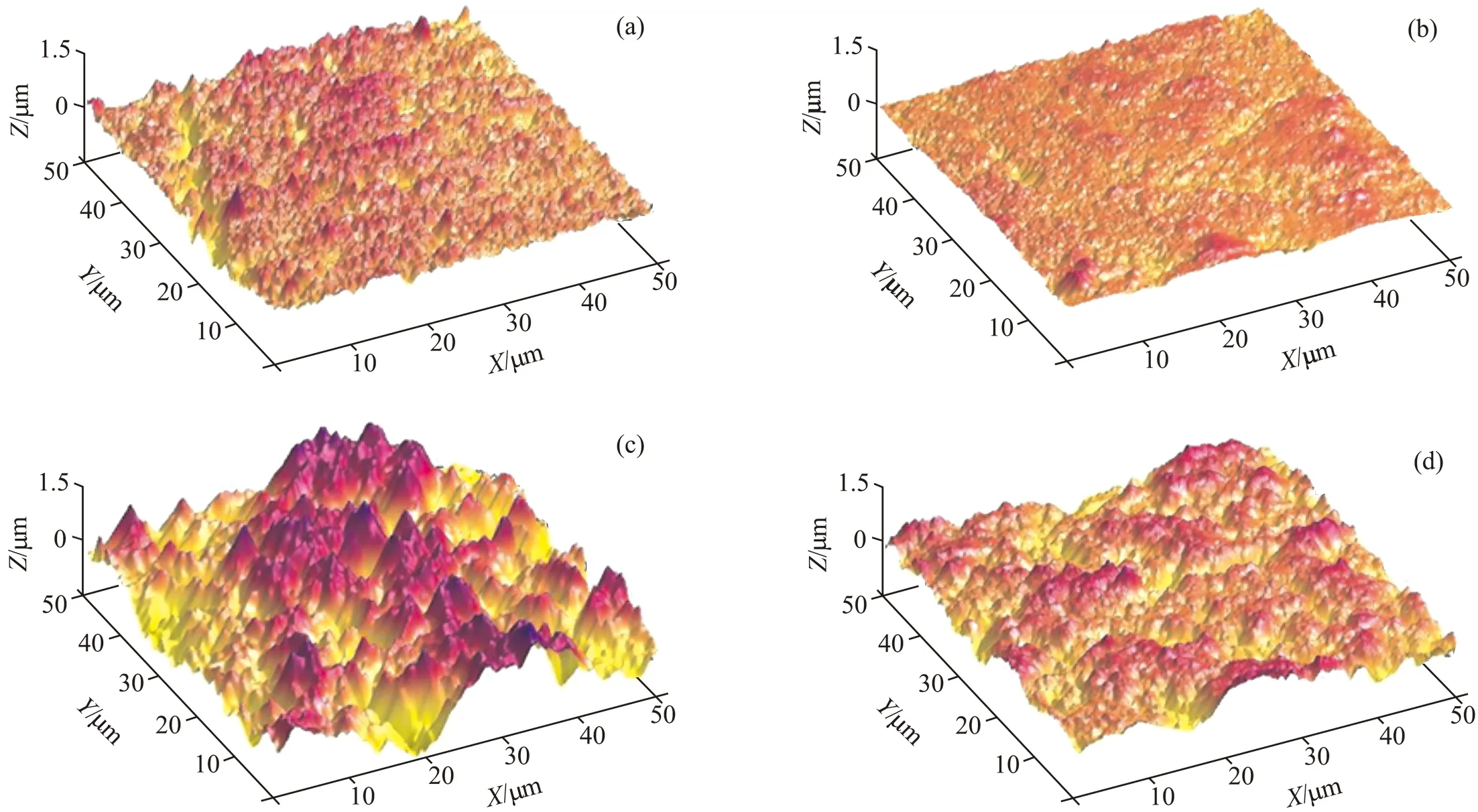
图4 试样浸泡在菌液(a、c)和无菌培养基(b、d)中不同时间后的AFM图
3 结论
本文通过紫外分光光度计测定了海洋微生物需钠弧菌的生长曲线,通过扫描电镜和原子力显微镜观测了该细菌在船舶用结构钢(DH32)钢样表面成膜过程及试样腐蚀形貌,结果表明生物膜的形成与微生物生命活动关系密切。在生长初期,细菌新陈代谢活性不高,试样表面附着的细菌也不多,试样的腐蚀以海水腐蚀为主,细菌对试样腐蚀行为的影响不大。但随时间推移,细菌大量繁殖,在试样表面形成分布不均的大小菌落,并逐渐形成一层致密的生物膜。在微生物膜的形成过程中,因为菌落分布不均以及细菌新陈代谢产物EPS对材料表面金属离子的络合,改变了试样表面的物理和化学状态,影响了材料腐蚀行为,并加速了材料的局部腐蚀速度。
[1] WANG Qing-fei,SONG Shi-zhe. Progress in marine biological influenced corrosion study[J]. Journal of Chinese Society for Corrosion and Protection,2002,22(3):184-188. 王庆飞,宋诗哲.金属材料海洋环境生物污损腐蚀研究进展[J].中国腐蚀与防护学报.2002,22(3):184-188.
[2] NATARAJAN K A.Biofouling and microbially influenced corrosion of stainless steels[J]. Century of Stainless Steels,2013,28(125):2 536-2 547.
[3] DONG Ze-hua, LIU Tao, LIU Hong-fang. Influence of EPS isolated from thermophilic sulphate-reducing bacteria on carbon steel corrosion[J]. Biofouling,2011,27(5):487-495.
[4] NIU Gui-hua. Electrochemical corrosion behavior of 316 stainless steel in marine microbial medium[J]. Chemical Research,2008,19(3):83-90. 牛桂华.海洋微生物对316不锈钢的电化学腐蚀行为[J].化学研究,2008,19(3):83-90.
[5] FUSHIMI K,YANAGISAWA K,NAKANISHI T,et al. Microelectrochemistry of dual-phase steel corroding in 0.1 M sulfuric acid[J]. Electrochim Acta,2013,114:83-87.
[6] MELCHERS R E. Microbiological and abiotic processes in modelling longer-term marine corrosion of steel[J]. Bioelectrochemistry,2014,97(S1):89-96.
[7] REMAZEILLES C, SAHEB M,NEFF D,et al. Microbiologically influenced corrosion of archaeological artefacts: characterisation of iron(II) sulfides by Raman spectroscopy[J]. J Raman Spectrosc,2010,41(25):1 425-1 433.
[8] JAVAHERDASHTI R, RAMAN R K S,PANTER C. Microbiologically assisted stress corrosion cracking of carbon steel in mixed and pure cultures of sulfate reducing bacteria[J]. Int Biodeterior Biodegrad,2006,58(01):27-35.
[9] BEECH I B.Corrosion of technical materials in the presence of biofilms-current understanding and state of the art methods of study[J].International Biodeterioration & Biodegradation,2004,53(3):177-183.
[10] OSIRO D, COLNAGO L A, OTOBONI A M, et al. A kinetic model forXylellafastidiosaadhesion, biofilm formation, and virulence[J]. FEMS Microbiology Letters,2004,236(2):313-318.
[11] ZHAO Jun, XU Gao-tian, QIN Zhe, et al. Composing of extracellular polymeric substances and its effect on sludge characteristics[J]. Safety and Environmental Engineering,2008,15(1):66-73. 赵军,徐高田,秦哲,等.胞外聚合物EPS组成及对污泥特性的影响研究[J].安全与环境工程,2008,15(1):66-73.
[12] MANSFELD F. The interaction of bacteria and metal surfaces [J]. Electrochimica Acta,2007,52(27):7 670-7 680.
[13] BEECH I B,SUNNER J. Biocorrosion: towards understanding interactions between biofilms and metals[J]. Current Opinion in Biotechnology,2004,15(3):181-186.
[14] BORENSTEIN S W. Microbiologically influenced corrosion handbook[M]. Cambridge, U.K: Woodhead Publishing,1994:310.
[15] CHANG E T,EARTHMAN J C. Axenic aerobic biofilms inhibit corrosion of SAE 1018 steel through oxygen depletion [J]. Journal of Industrial Microbiology and Biotechnology,1997,48(1):11-17.
[16] GONZDLEZ J E G,SANRANA F J H,MIRZA J C.Effect of bacterial biofilm on 316ss corrosion in natural seawater by EIS[J].Corrosion Science,1998,40(12):2 141-2 154.
[17]DONG Yao-hua, LIU Tao, SUN Shi-bin, et al. Preparation and characterization of SiO2/polydopamine/Ag nanocomposites with long-term antibacterial activity[J]. Ceramics International,2014,40(4):5 605-5 609.
[18] PIERSON J A. Real-time monitoring and control of sequencing batch reactors for secondary treatment of a poultry processing wastewater[J].Water Environment Research,2000,72(5):585-592.
The formation process of biofilm of marine microorganism and the influence on the corrosion of the ship structural steel
DONG Yao-hua, HE Zhong-yi, GUO Na, LIU Tao, DONG Li-hua*
(TheInstituteforMarineMaterialsScienceandEngineering,ShanghaiMaritimeUniversity,Shanghai201306,China)
In order to study the influence of the formation of biofilm on the corrosion of DH32 structural steel, the growth curve of a marine microorganism (Vibrionatriegens) was tested by UV-Vis spectra, the formation process of biofilm and the surface of the coupons were characterized by scanning electron microscope and atomic force microscope, respectively. The results show that the formation of biofilm closely associates with the growth of bacteria, the formation process of biofilm changes the chemical and physical state of the steel surface. Moreover, the formation of oxygen concentration cell and binding power of extracellular polymeric substances with metal ions greatly promotes the DH32 surface oxidation corrosion.
marine microorganism; biofilm; corrosion
10.3969/j.issn.1001-909X.2015.01.006.
2014-10-24
2014-12-10
国家重点基础研究发展计划(973计划)资助(2014CB643306);上海自然科学基金项目资助(14ZR1419800)
董耀华(1983-),男,湖北潜江市人,博士,讲师,主要从事海洋与船舶工程方面的研究。E-mail:yhdong@shmtu.edu.cn
*通讯作者:董丽华(1964-),女,教授,主要从事海洋与船舶工程方面的研究。E-mail:lhdong@shmtu.edu.cn
X17
A
1001-909X(2015)01-0039-06
10.3969/j.issn.1001-909X.2015.01.006
董耀华,贺中意,郭娜,等.海洋微生物在船舶用结构钢表面附着成膜过程及其腐蚀研究[J].海洋学研究,2015,33(1):39-44,
DONG Yao-hua,HE Zhong-yi,GUO Na, et al. The formation process of biofilm of marine microorganism and the influence on the corrosion of the ship structural steel[J]. Journal of Marine Sciences,2015,33(1):39-44, doi:10.3969/j.issn.1001-909X.2015.01.006.
