CdTe量子点DNA荧光纳米探针的合成及表征
2015-06-01张秋艳李珍珍潘玉瑾
张秋艳 孙 琳 李珍珍 潘玉瑾 王 青 赵 强
(四川大学化学工程学院,成都610065)
CdTe量子点DNA荧光纳米探针的合成及表征
张秋艳 孙 琳 李珍珍 潘玉瑾 王 青 赵 强*
(四川大学化学工程学院,成都610065)
采用水相合成法合成了巯基乙酸(TGA)修饰的水溶性CdTe量子点,通过反相微乳液法制备了二氧化硅及壳聚糖修饰的核壳型复合荧光纳米粒子,将其与DNA吸附连接,得到CdTe量子点DNA荧光纳米探针。用扫描电镜、透射电镜、荧光光谱、红外光谱、紫外光谱、ζ电位等测试方法对产物的理化性质进行了分析表征。结果表明制备了表面富含氨基的复合荧光纳米粒子,其对DNA具有良好的吸附作用。
CdTe量子点;氨基化;荧光;纳米探针;DNA
近年来,采用化学方法合成半导体纳米晶即量子点(Quantum Dots)[1]荧光纳米材料已成为化学和材料领域中的研究热点之一。由于量子点比传统有机荧光染料等具有更好的荧光特性[2],如较强的量子尺寸效应、较高的荧光量子产率、发射谱线窄和激发谱线宽等优点,其作为一种新型的荧光标记物已在生物分子探针[3-4]、生物传感器[5]、生物显像[6]及诊断[7]、生物分子相互作用[8-9]等研究中显示出了很好的应用前景。
量子点表面生物功能化后,便可与DNA、蛋白质等生物分子特异性结合,用于荧光探针标记[10]。本研究中所采用的DNA富含G碱基,与人体端粒DNA末端重复序列5′-TTAGGG-3′类似,经诱导可形成G-四链体结构。G-四链体DNA的形成能够有效地抑制端粒酶活性以及端粒的延长,进而遏制肿瘤细胞的大量增殖[11]。因而,富G碱基DNA荧光纳米探针的研究具有潜在的应用价值。
虽然各种功能基团修饰的量子点在生物领域已得到广泛应用[12],但采用二氧化硅与壳聚糖交联氨基化改性量子点形成核壳型的荧光复合纳米粒子,并研究其对DNA的吸附性能则鲜有报道。目前有研究工作者采用巯基乙胺[13]或APTES(3-氨丙基三乙氧基硅烷)[14]修饰量子点,但采用这些方法合成的量子点不稳定并且带有一定的毒性[15],不便与DNA连接进行后续研究。壳聚糖因为具有良好的生物相容性、无毒、可生物降解等优点[16],目前已被广泛用于DNA研究领域[17]。作为一种天然高分子化合物,壳聚糖结构中含有大量的-OH和-NH2,可通过静电吸附作用与带负电荷的DNA产生相互作用,形成荧光纳米探针。为此,本工作以巯基乙酸(TGA)为稳定剂在水相中制备了稳定的CdTe量子点,再采用反相微乳液法制备表面氨基改性的荧光复合纳米粒子,并研究其对DNA的吸附性能。
1 实验部分
1.1 实验试剂
硼氢化钠NaBH4(化学纯CP,天津海纳川);碲粉Te(>99%,Alfa Aesar);氯化镉CdCl2·2.5H2O(>99%,Acros organics);巯基乙酸TGA(98%,Acros organics);正硅酸乙酯TEOS(>96%,TCI Chemicals);曲拉通X-100(化学纯CP,成都科龙);三羟甲基氨基甲烷(生物试剂BR,成都科龙);环己烷、正己醇、氨水、丙酮(分析纯AR,成都科龙);1%壳聚糖(chitosan,CS,脱乙酰度不低于90%)溶液:准确称取1.000 g壳聚糖溶于100 mL 1%HOAc溶液中;DNA样品:S12-DNA 5′-TTAGGGTTAGGG-3′(OPC纯化,宝生物工程(TaKaRa)(大连)有限公司)。
1.2 水相合成TGA修饰的CdTe量子点
按照相关文献[18]水相合成TGA修饰的CdTe量子点。
1.3 CdTe@SiO2@CS复合荧光纳米粒子的合成
采用反相微乳液法[19]制备核壳型CdTe@SiO2@CS复合荧光纳米粒子,合成过程如图1所示。将7.5 mL环己烷、1.8 mL TritonX-100、1.8 mL正己醇加入50 mL圆底烧瓶中,混合均匀,磁力搅拌至澄清透明,接着加入500 μL CdTe水溶液(0.2 μg·mL-1)、250 μL 25%的氨水和500 μL的1%壳聚糖溶液,搅拌30 min,随后在剧烈搅拌下加入150 μL TEOS,密封避光反应24 h。反应结束之后,加入10 mL丙酮破乳,在10 000 r·min-1下高速离心15 min,弃去上清液,得到的产物分别用超纯水和乙醇反复清洗多次,50℃真空干燥备用。
CdTe@SiO2纳米粒子的制备方法同上,只是合成过程中不加入壳聚糖。
1.4 CdTe@SiO2@CS复合荧光纳米粒子对DNA的吸附作用
将DNA样品高速离心后(12 000 r·min-1)溶于Tris-HCl缓冲液(1 mol·L-1,pH=7.4)中配制成100 μmol·L-1贮备液。反应液总体积10 mL,固定DNA溶液浓度(10 μmol·L-1),依次增加CdTe@SiO2@CS复合荧光纳米粒子量(5 mg、10 mg、20 mg、30 mg…),混合后磁力搅拌反应至DNA被完全吸附。反应结束后,将产物在10 000 r·min-1下高速离心,收集上清液,紫外测试DNA残留含量。
1.5 表征测试

图1 荧光纳米探针的合成示意图Fig.1 Schematic illustration of the preparation of fluorescent nanoprobes
用FEI公司TecnaiG2F20S-TWIN型透射电镜及FEI公司INSPECT F型扫描电镜表征样品的形貌。红外光谱分析采用Nicolet公司NEXUS 670型傅立叶变换红外光谱仪,KBr压片测定。紫外及荧光光谱的测定分别采用紫外-可见分光光度计(TU-1901,北京普析通用仪器)和荧光分光光度计(F-4500型,Hitachi日立)。ζ电位的测定采用Malvern公司ZEN 3690型ζ电位分析仪。
2 结果与讨论
2.1 CdTe量子点及复合荧光纳米粒子的形貌表征
透射电镜(TEM)和扫描电镜(SEM)是研究纳米粒子的形貌、尺寸及粒径分布的有效手段。本研究中CdTe量子点的透射电镜图如图2(a)所示,由图可以看出CdTe纳米晶呈球状,粒径在3 nm左右,分布较为集中,分散性良好。CdTe@SiO2及CdTe@SiO2@CS复合荧光纳米粒子的扫描电镜图如图2(b)(c)所示,由图可看出粒子呈规则圆球形且尺寸分布较集中(平均粒径分别为73、66 nm)。图3为由图2(c)得到的粒径分布图。
2.2 CdTe量子点的紫外和荧光光谱分析
如图4所示,从CdTe量子点的紫外-可见吸收光谱图得出我们合成的量子点最大吸收波长值为541 nm,可以采取彭氏经验公式对CdTe量子点的粒径进行推算[20],有D=(9.812 7×10-7)λmax3-(1.714 7× 10-3)λmax2+1.006 4λmax-194.84,上式中,λmax为量子点的最大吸收波长值。用上述经验公式计算出量子点的尺寸约为3.14 nm。与图2(a)TEM统计算出的粒径大小基本吻合。
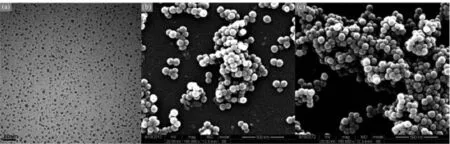
图2 CdTe量子点(a)的透射电镜图,CdTe@SiO2(b)及CdTe@SiO2@CS(c)复合荧光纳米粒子的扫描电镜图Fig.2 TEM image of CdTe QDs and SEM images of CdTe@SiO2(b)and CdTe@SiO2@CS(c)
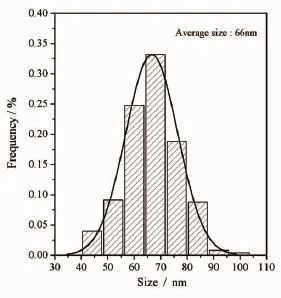
图3 CdTe@SiO2@CS复合荧光纳米粒子的粒径分布图Fig.3 Particle size distribution of CdTe@SiO2@CS
由CdTe量子点的激发光谱图可看出CdTe纳米晶体具有很宽的激发范围,从250~600 nm都可以激发。从发射光谱可看出CdTe量子点在600 nm具有最大发射峰,且荧光发射峰对称性很好,并未出现拖尾现象。
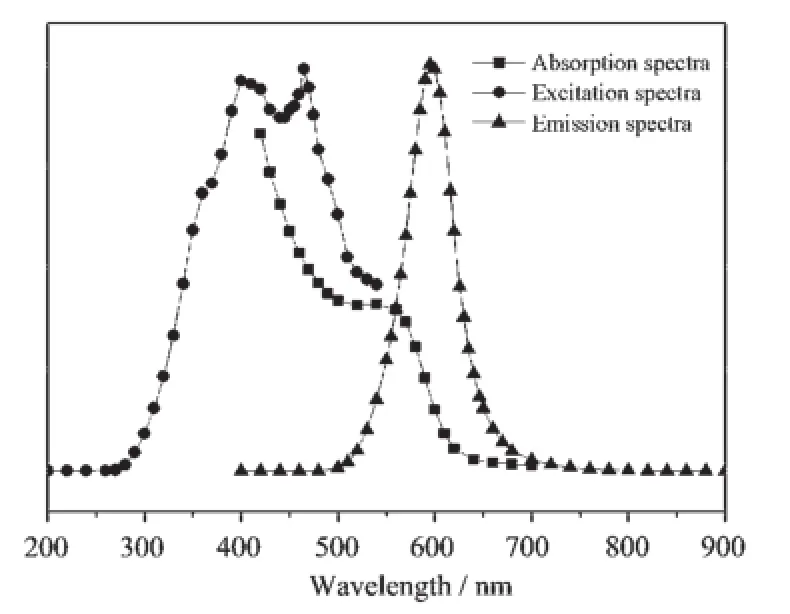
图4 CdTe量子点的紫外-可见吸收光谱和荧光光谱图(激发谱发射波长为600 nm,发射谱激发波长为350 nm)Fig.4 UV-Vis absorption spectra and fluorescence spectra(λem=600 nm,λex=350 nm)of CdTe QDs
2.3 复合荧光纳米粒子与DNA连接前后荧光性能
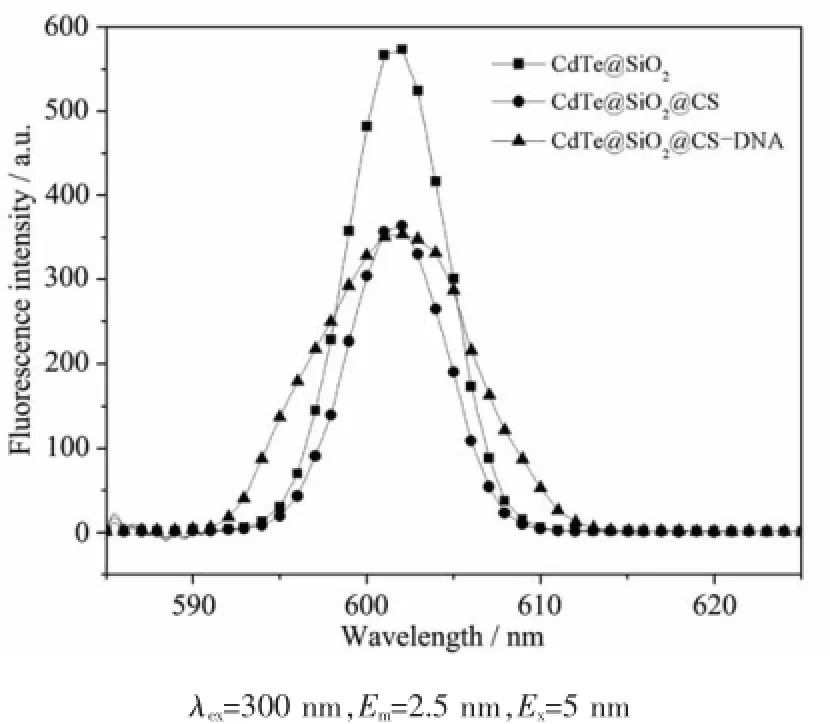
图5 CdTe@SiO2、CdTe@SiO2@CS及CdTe@SiO2@CS -DNA复合荧光纳米粒子荧光发射光谱图Fig.5 Fluorescence emission spectra of CdTe@SiO2、CdTe@SiO2@CS and CdTe@SiO2@CS-DNA
本研究中所制备的复合荧光纳米粒子均具有较高的荧光强度、半峰宽窄、发光性能良好,如图5所示,分别为CdTe@SiO2、CdTe@SiO2@CS及CdTe@ SiO2@CS-DNA(浓度均为1 mg·mL-1)在激发波长为300 nm下的荧光发射光谱图。与壳聚糖交联引入氨基-NH2后,荧光强度有所下降,但与DNA连接前后,仍具有较强的荧光性能。由图可知,连接DNA后,荧光半峰宽有所加大,这可能是由于复合荧光纳米粒子与DNA结合后粒径增大,表面结构发生变化,DNA共轭结构引起粒子表面电荷发生变化所导致的。
2.4 CdTe量子点及复合荧光纳米粒子的红外分析
图6(a)是CdTe量子点的红外光谱图。3 000~3 500 cm-1间宽峰为羧酸官能团中的-OH伸缩振动峰,图中在2 565 cm-1附近无-SH的特征峰,说明在量子点合成中,巯基乙酸的-SH与CdTe量子点表面Cd2+发生了配位,形成巯基乙酸稳定的CdTe量子点。
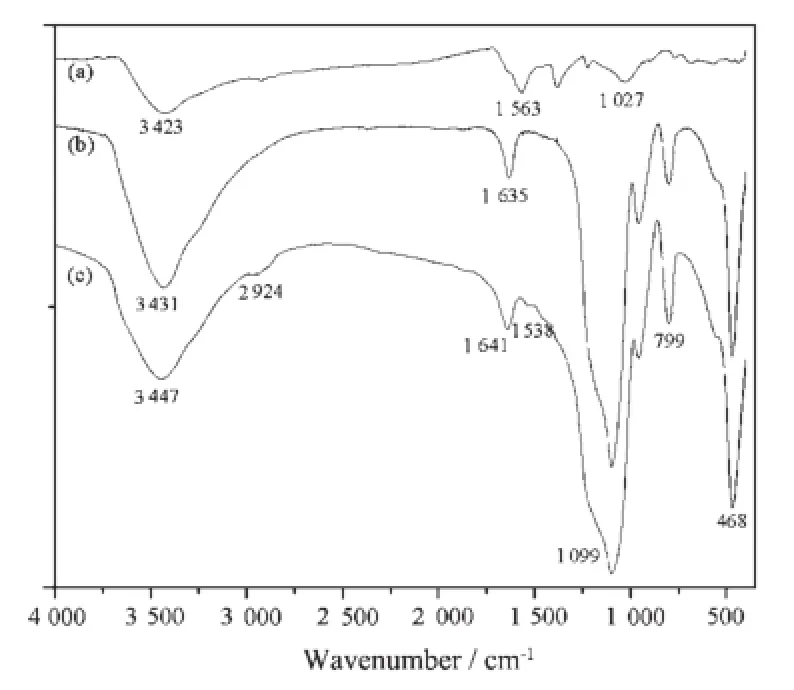
图6 CdTe量子点(a)、CdTe@SiO2(b)及CdTe@SiO2@CS (c)复合荧光纳米粒子的红外光谱图Fig.6 FTIR spectra of CdTe QDs(a)、CdTe@SiO2(b)and CdTe@SiO2@CS(c)
图6 (b)和(c)分别为接氨基前后复合荧光纳米粒子的红外光谱图,由图可知1 099、799、468 cm-1特征峰表明了量子点表面SiO2壳层的形成[21],其中1 099 cm-1对应Si-O-Si反对称伸缩振动,468 cm-1对应Si-O-Si弯曲振动。与图(b)相比,图(c)在2 924、1 538 cm-1处出现了新的吸收峰,应为壳聚糖的-CH2伸缩振动峰和-NH2弯曲振动峰。结果表明,壳聚糖已成功包裹在量子点外层,使粒子表面带有氨基基团。
2.5 CdTe量子点及复合荧光纳米粒子的ζ电位分析
CdTe@SiO2@CS复合荧光纳米粒子如与DNA之间是通过静电作用进行吸附的,壳聚糖结构中大量的-NH2使之带正电,粒子理论上应具有与壳聚糖一致的正电性。ζ电位测量中,CdTe量子点浓度为0.2 μg·mL-1,CdTe@SiO2及CdTe@SiO2@CS粒子浓度为1 mg·mL-1,缓冲液(buffer)为Tris-HCl溶液(1 mol·L-1,pH=7.4)。测定粒子表面电荷结果如表1所示,CdTe量子点及CdTe@SiO2的ζ电位值为负值,而包覆了壳聚糖的CdTe@SiO2@CS的ζ电位为正值。由此可看出,CdTe@SiO2@CS复合荧光纳米粒子表面已接上氨基基团且电位为正值,从而可以通过静电作用与DNA进行吸附。

表1 CdTe量子点、CdTe@SiO2及CdTe@SiO2@CS复合纳米粒子ζ电位值Table1 ζ Potential of CdTe QDs、CdTe@SiO2and CdTe@SiO2@CS
2.6 复合荧光纳米粒子对DNA吸附性能
CdTe@SiO2及CdTe@SiO2@CS复合荧光纳米粒子与DNA进行静电吸附作用后产物离心分离,通过测定上清液紫外吸收可得到不同粒子加入量对应的吸附DNA量,如图7所示。由图可看出,随着粒子加入量增加,CdTe@SiO2对DNA几乎没有吸附作用,而CdTe@SiO2@CS所吸附的DNA量随之增加,当粒子加入量达到60 mg时,所加入DNA被完全吸附,达到吸附平衡,因而可计算出CdTe@SiO2@CS复合荧光纳米粒子的吸附能力为Qmax=16.67 nmol·mg-1。由此可见,氨基修饰后的CdTe@SiO2@CS复合荧光纳米粒子对DNA具有良好的吸附作用。

图7 CdTe@SiO2及CdTe@SiO2@CS复合荧光纳米粒子加入量对DNA的吸附量Fig.7 Adsorption quantity of CdTe@SiO2and CdTe@SiO2@CS
3 结论
通过水相合成法合成了具有高荧光强度的CdTe量子点并通过反相微乳液法成功制备了表面氨基化、粒径均一的CdTe@SiO2@CS核壳型复合荧光纳米粒子。结果表明,复合荧光纳米粒子在Tris-HCl缓冲液中对DNA具有良好的吸附作用。富含G碱基DNA荧光纳米探针的成功制备对G-四链体结构在肿瘤治疗和抗肿瘤药物设计开发研究中具有潜在应用价值。与此同时,本研究中所制备的表面富含氨基的复合荧光纳米粒子也可与其他DNA、蛋白质等生物活性分子特异性结合,在生物探针、载药系统及基因诊断等生物医药领域显示出广阔的应用前景。
[1]Ron G,Maya Z,Itamar W.Angew.Chem.Int.Ed.,2008,47: 7602-7625
[2]Dong K Y,Tamil S,et al.J.Am.Chem.Soc.,2005,127: 4990-4991
[3]Zhao Y,Hao C L,Ma W,et al.J.Phys.Chem.C,2011, 115:20134-20140
[4]Igor L M,Lorenzo B,Thomas P,et al.Nano Lett.,2007,7(6): 1741-1748
[5]Aditya S,Chandra M P,Gajjala S,et al.Biosens.Bioelectron., 2012,38:107-113
[6]Weng J F,Song X T,Li L,et al.Talanta,2006,70:397-402
[7]Wang X,Lou X H,Guo Q C,et al.Biosens.Bioelectron., 2010,25:1934-1940
[8]LIN Zhang-Bi(林章碧),SU Xing-Guang(苏星光),ZHANG Hao(张皓),et al.Chem.J.Chinese Universities(高等学校化学学报),2003,24(2):216-220
[9]Han M Y,Gao X H,Su Jack Z,et al.Nat.Biotechnol., 2001,19:631-635
[10]Manuela F F,Nikos C.Anal.Bioanal.Chem.,2010,396: 229-240
[11]Gary N P,Michael P H L,Stephen N.Nature,2002,417: 876-880
[12]Akiyoshi H,Kouki F,Taisuke O,et al.Nano Lett.,2004,4 (11):2163-2169
[13]YANG Wei-Hai(杨卫海),LI Wan-Wan(李万万),SUN Kang (孙康).Chem.J.Chinese Universities(高等学校化学学报), 2008,29(4):681-685
[14]ZHANG Bing-Bo(张兵波),GONG Xiao-Qun(宫晓群),LIN Ting-Ting(林婷婷),et al.Chem.J.Chinese Universities(高等学校化学学报),2009,30(2):246-249
[15]Li Y B,Zhang H X,Guo C X,et al.Chem.Res.Chinese Univ.,2012,28(2):276-281
[16]Felippe J P,Luciano C,Osvaldo N O.Biomacromolecules, 2010,11:1897-1908
[17]Liu W G,Sun S J,Cao Z Q,et al.Biomaterials,2005,26: 2705-2711
[18]ZHANG Xue-Lian(张雪莲),LI Ya-Ru(李亚茹),PAN Yuan-Yuan(潘园园),et al.Chem.Res.Appl.(化学应用与研究), 2012,24(5):666-671
[19]Yang Y H,Gao M Y.Adv.Mater.,2005,17:2354-2357
[20]Yu W W,Qu L H,Guo W Z,et al.Chem.Mater.,2003,15: 2854-2860
[21]Wang Z Q,Zhou Y M,Yao Q Z,et al.Appl.Surf.Sci., 2009,256:1404-1408
Preparation and Characterization of CdTe QDs-DNA Fluorescent Nanoprobes
ZHANG Qiu-YanSUN LinLI Zhen-ZhenPAN Yu-JinWANG QingZHAO Qiang*
(College of Chemical Engineering,Sichuan University,Chengdu 610065,China)
The water-soluble CdTe quantum dots were synthesized with Thioglycolicacid(TGA)as stabilizer in the aqueous solution,and the ammonified core/shell nanoparticles coated with TEOS and chitosan were synthesized with reverse microemulsion method.The nanocomposites were connected with DNA by electrostatic adsorption. The property and morphology of these particles were characterized by SEM,TEM,FL,IR,UV and Zeta Potential. The results showed that the amino-modified nanocomposites were synthesized successfully and had high adsorption capacity for DNA.
CdTe Quantum Dots;ammonification;fluorescence;nanoprobe;DNA
O657.3
A
1001-4861(2015)03-0543-05
10.11862/CJIC.2015.093
2014-11-24。收修改稿日期:2015-01-07。
国家自然科学基金(No.20975072)资助项目。
*通讯联系人。E-mail:zhaoqiang@scu.edu.cn
