白细胞介素-18与深静脉血栓疾病的相关性研究
2015-06-01李光第赵学凌白云城周如丹
李光第,宋 恩,赵学凌,白云城,彭 志,周如丹
(昆明医科大学第一附属医院骨科,昆明 650032)
论著·基础研究
白细胞介素-18与深静脉血栓疾病的相关性研究
李光第,宋 恩,赵学凌,白云城,彭 志,周如丹△
(昆明医科大学第一附属医院骨科,昆明 650032)
目的 探讨白细胞介素-18(IL-18)的表达变化与深静脉血栓疾病(DVT)发生、发展的相关性及临床意义。方法 收集临床DVT病例(DVT组,n=40)、实验对照组(n=40)、健康对照组(n=20)的血液,以ELISA法检测其中IL-18的表达并分析差异;培养原代培养的人脐静脉内皮细胞(HUVECs)行目标蛋白免疫荧光检测明确其定位;构建人IL-18过表达和干扰病毒载体(IL-18-pCDH-GFP、IL-18-LMP-shRNAmir1)感染HUVECs并进行基因表达谱芯片检测和KEGG Pathway等生物信息技术,分析IL-18与疾病的相关性。结果 人血ELISA检测发现在DVT组和两对照组中IL-18 的表达差异均有统计学意义(F=11.248,P<0.01);实验对照组与健康对照组之间IL-18 的表达差异无统计学意义(P>0.05);免疫荧光检测显示目标蛋白定位于细胞质;人IL-18过表达和干扰载体经病毒转染后感染HUVECs;基因芯片检测发现与正常细胞比较,过表达载体IL-18-pCDH-GFP感染细胞有17条信号通路下调、16条上调;干扰载体IL-18-LMP-shRNAmir1感染细胞有23条信号通路下调、9条上调。结论 IL-18对HUVECs有确切影响,同时与DVT疾病密切相关,有希望作为深静脉血栓疾病临床预测诊断的候选分子标记物。
静脉血栓形成;白细胞介素18;分子标记物;人脐静脉内皮细胞
深静脉血栓(deep venous thrombosis,DVT)的诊断主要依赖影像学和有限的实验室检查,在血栓形成之后方能明确,以致无法针对性地进行预防和治疗。如能预测诊断,可实现更有针对性的预防、更早有效地治疗,减少危害。随着分子生物学技术的发展,DVT疾病中炎症细胞因子的参与及其在早期瀑布式反应中重要的激活作用得到广泛关注,越来越多的证据表明,炎性反应在静脉血栓疾病的发生、发展中起到了关键的作用[1]。白细胞介素-18(interleukin-18,IL-18)是上世纪90年代末发现的前炎症细胞因子[2-3],它参与体内炎性反应和免疫反应调节过程,尤其是在促进炎性细胞因子释放及细胞因子之间相互作用方面具有重要作用。本文对IL-18与下肢DVT的相关性进行研究,通过临床患者血中IL-18基因ELISA检测初步探讨疾病相关性,随后进一步行细胞及分子生物学实验研究,结合基因芯片等生物信息学手段,为IL-18与DVT发生、发展相关性的研究提供有效证据。
1 材料与方法
1.1 一般资料 本院2012~2013年骨科、血管外科、呼吸内科等相关科室中DVT病例40例、实验对照组40例、健康对照组20例,共100例血液标本。参考《静脉血栓栓塞症预防的NICE指南》(2012年)和《美国胸科医师协会抗栓与血栓预防临床实践指南-深静脉血栓形成的诊断》(2012年第9版)制订DVT诊断标准。DVT组:符合临床诊断标准的下肢DVT患者;实验对照组:骨科人工关节置换、脊柱术后无血栓诊断患者;健康对照组:健康志愿标准。为控制非试验因素干扰和影响,各组纳入者满足(1)年龄大于15岁;(2)无家族遗传性血栓病史;(3)无自身免疫性疾病、急性炎症、全身免疫反应综合征(SIRS)、肿瘤、怀孕等;(4)未服用抗凝药物。
1.2 材料 ELISA试剂盒购于Ebioscience公司;过表达慢病毒载体及逆转录病毒载体购于Ambion公司;转染试剂购于Qiagen公司;TRIzol、二抗IgG-HRP购于Invitrogen公司;逆转录试剂盒购于Fermentas公司;琼脂糖凝胶电泳试剂购于Omega公司;荧光定量引物由Invitrogen公司合成;荧光定量试剂盒购于Fermentas公司;聚偏氟乙烯(PVDF)膜购于Millipore公司;一抗购于Santan和康为公司;ECL显色试剂盒、Real-time PCR用96孔板及膜购于Bio-Rad公司。各规格离心管、枪尖、PCR管购于Axygen公司;X光片购于柯达公司;人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)原代及传代培养耗材购于Corning公司。
1.3 收集血清 无抗凝剂生化管/EDTA真空采血管收集空腹静脉血3~4 mL,3 000 r/min,4 ℃离心10 min。分离血清/血浆,冻存管-80 ℃保存。
1.4 ELISA检测IL-18 ELISA检测步骤按Ebioscience试剂盒说明书标准操作。按试剂盒标准品绘制标准曲线。标准曲线方程为Y=0.000 8X+0.009 5其中X为吸光度值、Y为浓度对数,可据其计算样本实际浓度。预实验随机选择1个样本进行梯度稀释(100、200、400及800倍),稀释后OD值依次为:0.876 9、0.413 2、0.097 6、0.001 3;可见稀释200倍OD值在标准曲线范围,是最佳血清稀释浓度。
1.5 HUVECs细胞培养及免疫荧光检测 原代HUVECs组在37 ℃,5% CO2条件下培养。免疫荧光检测:HUVECs制成2×104/mL细胞悬液,制作细胞爬片;以抗人IL-18孵育,FITC标记二抗与之结合,激光共聚焦荧光显微镜拍照观察IL-8蛋白在HUVECs中的定位,设置3次平行实验。
1.6 人IL-18慢病毒过表达载体构建 通过GenBank数据库搜索人IL-18基因完整CDS序列,Primer5.0软件设计特异性引物(正向引物:5′-GCA AGC TTA TGC CTT GTG TTC AGG CG-3′,反向引物:5′-GCC TCG AGT TAG AAA GGT AAG GTG TC-3′,产物长度582 bp,退火温度60 ℃),对人IL-18基因进行PCR扩增。然后进行胶回收实验,再行琼脂糖凝胶电泳检测;收集胶回收的目的片段和质粒载体进行连接,以pCDH-GFP为测序引物进行测序。
1.7 人IL-18逆转录病毒干扰载体构建 逆转录病毒Oligo片段扩增:搜索GenBank中人IL-18基因序列,利用Oligoengine设计2条22个碱基的候选siRNA靶序列,再根据MSCV-LMP逆转录病毒载体的特点,设计出相应的具有发夹结构的shRNA模板。将设计片段送生物工程合成部合成Oligo片段并按比例稀释,用规定引物(正向引物:5′-CAG AAG GCT CGA GAA GGT ATA TTG CTG TTG ACA GTG AGC G-3′,反向引物:5′-CTA AAG TAG CCC CTT GAA TTC CGA GGC AGT AGG CA-3′,退火温度52 ℃)进行PCR反应扩增。干扰片段扩增后,进行胶回收实验,再进行琼脂糖凝胶电泳检测。把胶回收的目的片段和质粒载体进行连接,以LMP为测序引物进行测序。
1.8 过表达及抑制效率检测
1.8.1 过表达/干扰载体病毒包装、感染 病毒宿主细胞为293T细胞,HUVECs为感染细胞。pCDH-GFP(12.0 g)的包装质粒为pCL-ECO,用量8.0 g;转染人IL-18-pCDH-GFP过表达质粒(过表达组),正常和转染空载体细胞分别作为实验对照组和正常对照组。MSCV-LMP(12.5 g)包装质粒分别是:pAPAX(7.5 g)、pMD2.G(5 g);分别转染人IL-18-LMP shRNAmir1、2(干扰1、2组),正常和转染空载体细胞分别作为实验对照2组和正常对照组;总感染48~72 h后,通过载体荧光观察感染效率,并抽提点RNA。
1.8.2 real-time PCR测定mRNA水平 TRIzol(Invitrogen)抽提细胞总RNA;依据RevertAid First Strand cDNA Synthesis Kit(Fermentas)试剂盒标准操作进行cDNA合成。通过GenBank基因数据库搜索基因的完整mRNA序列,用BLAST分析寻找特异性引物,引物设计软件为primer 5.0,以人-actin基因为内参(IL-18 正向引物:5′-TCA AGA CCA GCC TGA CCA ACA-3,反向引物:5′-CTC ACC ACA ACC TCT ACC TCCG-3′,152 bp;β-actin 正向引物:5′-ACG GCA AGT TCA ACG GCA CAG--3′,反向引物:5′-GAC GCC AGT AGA CTC CAC GACA-3′,180 bp)。荧光定量PCR检测相对表达量,依据MaximaTMSYBR Green/ROX qPCR Master Mix(2×)(Fermentas)操作。将引物稀释至10 μM;设计96孔板上样顺序,每个样品做3个重复,用水为模板作阴性对照;real time PCR扩增仪进行实验。结果分析:观察熔解曲线和扩增曲线,用软件DataAssistTMv3.0 Software(ABI)以2-ΔΔCt方法对结果进行分析。ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。
1.8.3 蛋白水平测定 细胞总蛋白提取:收集各组HUVECs后添加含PMSF(Sigma公司)的RIPA裂解液(Beyotime),冰浴30 min;4 ℃,12 000 r/min离心5 min;取上清液,用BCA法测定计算蛋白浓度。蛋白印迹法(Western blot)分析目标蛋白的表达情况,Bio-Rad膜成像系统下显色成像并用Quantity One软件对比分析。
1.9 人IL-18细胞系过表达沉默后转录谱变化 按前文转染步骤进行实验,收获转染了人的IL18-LMP-shRNAmir1、IL18-pCDH-GFP的细胞和未转染细胞作为对照,提取总RNA,进行基因表达谱芯片分析,每样品1张芯片,共3个基因芯片;样本送至康成生物进行基因芯片检测。
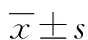
2 结果
2.1 ELISA检测人血中IL-18的表达情况 检测100例血清样品中IL-18基因的水平,编号1~40为DVT组、41~80为实验对照组、81~100为正常对照组。单因素方差分析显示:DVT组IL-18检测值明显高于两对照组,差异均有统计学意义(P=0.001);两对照组间差异无统计学意义(P>0.05)。见表1。

表1 人IL-18在各组中的差异
a:P<0.05,与DVT组比较。
2.2 HUVECs培养及免疫荧光检测 培养原代HUVECs并进行传代。早期细胞贴壁多呈小三角形、球形,少数细胞伸展呈短梭型,单个或团簇存在;此后细胞呈单层,互不重叠,呈铺路石样排列。HUVECs细胞爬片重复3次免疫荧光均显示IL-18目标蛋白定位于HUVECs细胞质,见图1。
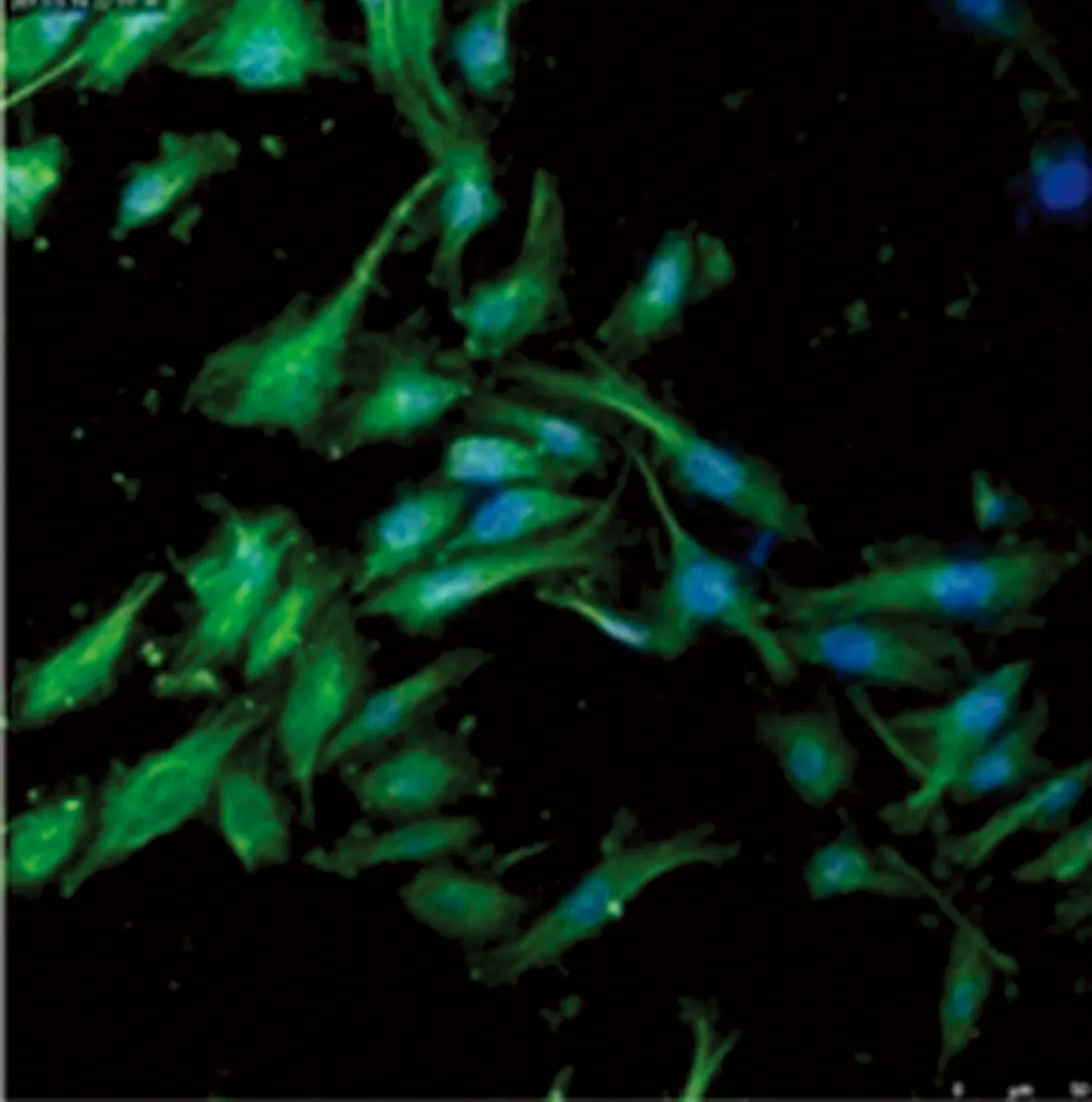
图1 免疫荧光激光共聚焦检测(×800)
2.3 人IL-18基因慢病毒过表达载体、逆转录病毒干扰载体构建
2.3.1 逆转录病毒过表达载体构建 PCR扩增人IL-18基因,琼脂糖电泳清晰可见单一的目的条带;本研究选取慢病毒载体pCDH-GFP中,EcoRⅠ和BamHⅠ两个酶切位点来连接载体与目的基因。人IL-18-pCDH-GFP的测序结果,经NCBI中的BLAST在线工具比对,均为正确序列。
2.3.2 逆转录病毒干扰载体构建 据逆转录病毒LMP质粒载体特点,选XhoⅠ和EcoRⅠ酶切位点进行连接;扩增人IL-18-LMP-shRNAmir1、2干扰载体,SacⅡ/XhoⅠ双酶切后酶切产物经1%琼脂糖电泳检测;条带在985 bp/7 019 bp表明已插入目的条带,属于阳性克隆。阳性克隆送上海生工测序部测序鉴定。人IL-18-LMP-shRNAmir1、2干扰载体测序结果,以NCBI中的BLAST在线工具比对测序结果,均为正确序列。
2.4 过表达及抑制效率检测
2.4.1 病毒包装及感染 包装和转染病毒48 h及72 h分别收集两次病毒原液,用病毒原液2~5 mL感染宿主细胞,48 h后观察感染情况;磷酸钙转染法在293T细胞长包装病毒的转染效率可以达到90%,甚至更高;病毒收集后,感染宿主细胞的感染效率可达80%以上;载体都携带绿色荧光蛋白标签,可见实验转染及感染均呈高效。
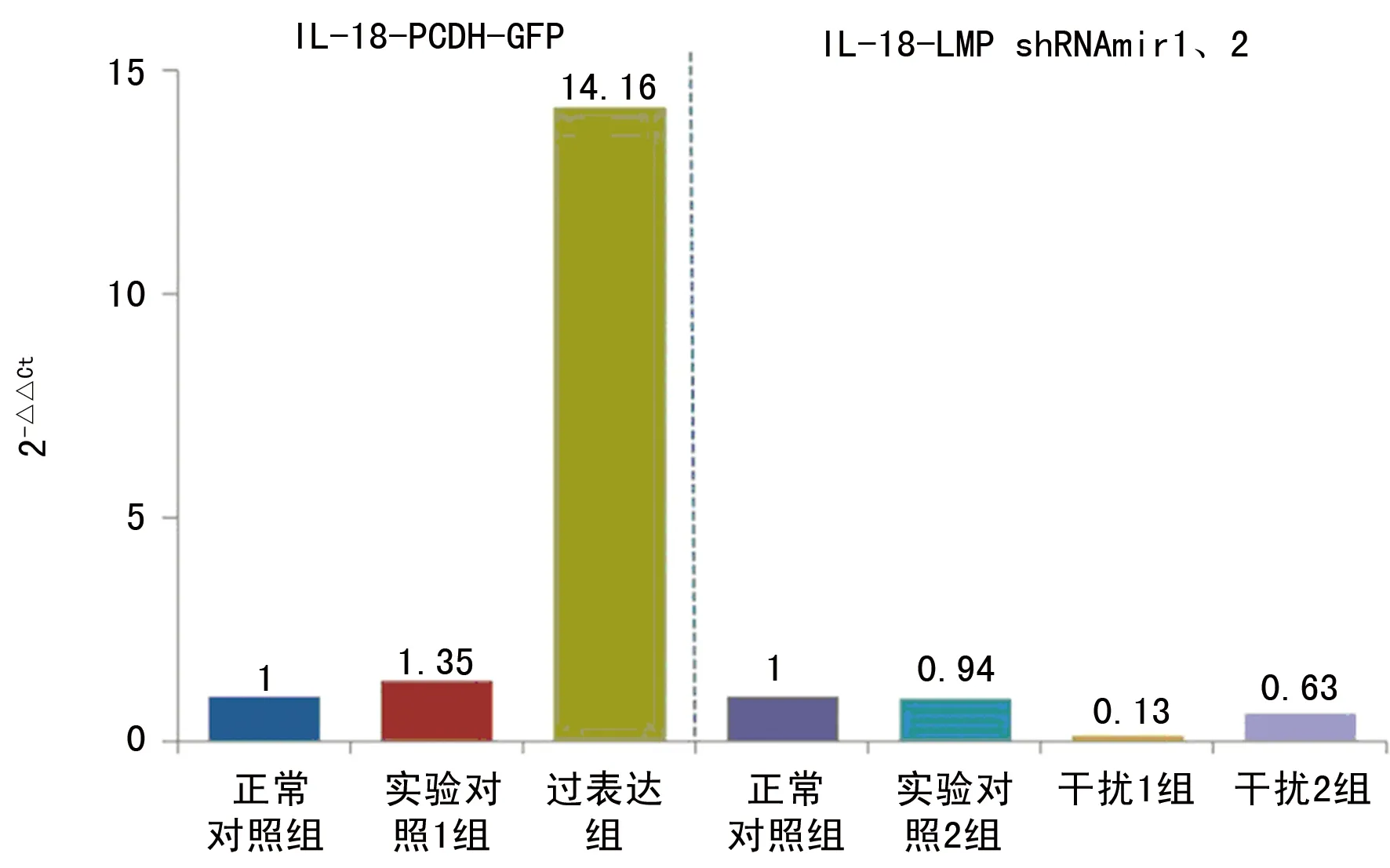
图2 real-time PCR检测基因的表达水平
2.4.2 real-time PCR结果 2-ΔΔCt法分析待测基因在实验各组间的相对表达量差异倍数。组间比较结果显示,IL-18在过表达组的表达情况明显高于正常对照组及干扰1、2组(P<0.05),而干扰1组明显低于其余组,差异均有统计学意义(P<0.05)。见图2。
2.4.3 蛋白印迹检测结果 采用Quantity One软件对膜成像系统拍下的Western blot结果图片进行分析,读取条带相应光密度值后,根据公式:相对表达水平(ratio)=目标蛋白/β-actin进行计算,结果显示IL-18表达水平在过表达组中明显增高,干扰1组中明显减低,见图3、表2。以正常对照组为1,分别计算其他处理组与正常对照组的比值,得到目的基因相对过表达率,见图4。
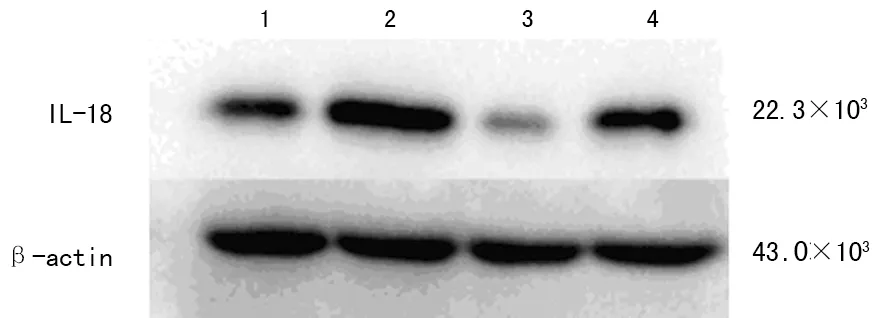
1:正常组;2:过表达组;3:干扰1组;4:干扰2组。
图3 IL-18的蛋白表达水平

表2 Western blot检测IL-18蛋白的相对表达水平
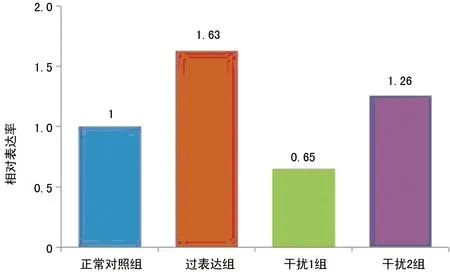
图4 目的基因相对过表达率

1:正常人静脉内支细胞;2:IL-18-PCDH-GFP转梁细胞;3:IL-18-LMP shRNA-Amir1转染细胞。
图5 基因芯片热谱图
2.5 人IL-18细胞系过表达或沉默后转录谱变化 根据real-time PCR和Western blot实验结果,选取过表达组、干扰1组、正常对照组细胞进行基因表达谱芯片分析,每样品做1张芯片,共3个基因芯片。图5为基因芯片检测到的所有表达变化的基因热谱图,其中红色表示相对高表达,绿色代表相对低表达。同时根据KEGG Pathway分析过表达组及干扰1组与正常对照组比较发现:过表达组细胞上调的基因共164个、涉及16条信号通路;下调的基因共177个、涉及17条信号通路。干扰1组细胞上调的基因有94个、涉及9条信号通路;下调的基因有290个、涉及23条信号通路。
3 讨论
DVT是一种多因素疾病,包括致病基因、基因突变及基因间相互影响和炎性反应中细胞因子的相互作用、凝血功能等诸多方面。静脉血栓形成的复杂因素中,内皮细胞、血小板、炎症因子参与等诸多方面已成为DVT疾病研究的热点。国内外炎症与血栓相关研究主要集中于动脉疾病,研究炎症与静脉血栓形成间的相互作用机制仍在探索,相关文献报道甚少。炎性反应一方面有防御性的保护作用;另一方面炎症过于强烈时,则可使损伤放大、加重,产生序列性连锁反应引发血栓性疾病[4-6]。血栓形成的局部微环境中,受损内皮分泌趋化因子,趋化白细胞到达炎症区域参与炎性反应,并分泌IL-1、IL-6、TNF-α等炎性介质促进血栓形成[7]。炎症因子与血栓的形成有较为密切的关系[8]。血栓形成过程中,炎症细胞分泌多种细胞因子和炎症介质作用于内、外源性凝血系统[9],可刺激内皮细胞,诱发组织因子表达,激活凝血途径,引起炎症使体内C-反应蛋白(CRP)含量增加,形成循环相加效应。
IL-18是上世纪90年代末新发现的前炎症细胞因子,具有多种生物学活性和功能,它参与炎性反应和免疫反应调节过程,尤其是对促炎性细胞因子释放及细胞因子相互作用具有重要意义。发现至今,国内外IL-18的相关研究主要集中于心血管系统疾病进展和发病机制等领域,已取得一定成果;然而关于IL-18与DVT相关性研究,国内外一直罕见报道。研究共收集DVT患者、实验对照组及正常对照组100例血液样本。ELISA检测发现DVT组较两对照组血清中IL-18的水平明显增高,且差异有统计学意义(P<0.05)。据研究结果可见IL-18在创伤、手术等情况下,血液检测较健康人有一定程度增高;临床确诊的下肢DVT患者血液中IL-18表达水平明显上升,说明其与下肢DVT疾病有明确的相关性。IL-18可诱导T淋巴细胞、巨噬细胞、NK细胞生成IFN-γ,而IFN-γ可以抑制血管平滑肌的增殖、生长及胶原合成,促使SMC吞噬(OX-LDL)增多;还可以诱导血管内皮细胞表达细胞间黏附分子(VCAM)和血管内皮黏附因子(ICAM),促进血管和细胞、细胞和细胞间黏附,加速疾病发展[10]。Chandrasekar等[11]研究表明心脏微血管内皮细胞(HCMEC)存在IL-18表达,并可以激活细胞凋亡信号通路诱导内皮细胞凋亡,引起心肌炎症性病变和损伤。许多早期炎性反应在造血与非造血系细胞中IL-18可以被检测到,已有报道巨噬细胞、血管内皮细胞、平滑肌细胞、中性粒细胞、树突细胞、NK细胞、角质细胞等中均有IL-18表达[12-15]。
本研究进行了临床患者血样的IL-18检测,为后期细胞、分子层面等机制研究提供有效实验证据。临床血样研究发现IL-18和下肢DVT疾病有明确相关性,有望成为DVT预测、诊断、疾病研究的分子标记物。因此,本研究继续对IL-18作为DVT疾病标记物在分子、细胞水平上进行探索。实验进行了IL-18与HUVECs的相关研究,免疫荧光检测证实IL-18定位与HUVECs细胞质中。随后构建IL-18-pCDH-GFP慢病毒过表达载体和IL-18-LMP-shRNAmir1、2逆转录病毒抑制载体转染HUVECs,用real-time PCR和Westen blot对转染/感染率进行检测,选定较为理想的IL-18-pCDH-GFP和IL-18-LMP-shRNAmir1感染HUVECs进一步行基因表达谱芯片检测。基因芯片检测结果结合KEGG Pathway分析与正常HUVECs比较:过表达载体感染细胞上调基因共164个,涉及16条信号通路;干扰载体感染细胞下调基因有290个,涉及23条信号通路。IL-18是具有多向生物学活性和功能的细胞因子,不仅在心血管疾病、免疫性疾病、肿瘤疾病、胃肠系统疾病以及呼吸系统疾病等多种疾病[16-20]的发生、发展过程中发挥重要作用。大量研究证实内皮细胞受损后与静脉内血栓性疾病联系紧密,本研究进行了临床血样检测、细胞分子层面的初步探索,研究结果证实IL-18的过表达及抑制等变化对HUVECs正常功能有确切影响,说明其与下肢DVT疾病的发生、发展存在联系,然而其作用机制至今尚未阐明。其表达变化与DVT疾病的相互关系仍需进一步探讨,针对其生物活性、作用及调节机制等仍有待深入研究。深静脉血栓疾病的预测诊断、病程进展机制等是国内外研究者的关注热点,而IL-18是值得关注的炎症细胞因子,可为探寻疾病早期诊断分子标记物提供新的选择。
[1]Levi M,van der Poll T,Schultz M.Infection and inflammation as risk factors for thrombosis and atherosclerosis[J].Semin Thromb Hemost,2012,38(5):506-514.
[2]Okamura H,Nagata K,Komatsu T,et al.A novel costimulatory factor for gamma interferon induction found in the livers of mice causes endotoxic shock[J].Infect Immun,1995,63(10):3966-3972.
[3]Ushio S,Namba M,Okura T,et al.Cloning of the cDNA for human IFN-gamma-inducing factor,expression in Escherichia coli,and studies on the biologic activities of the protein[J].J Immunol,1996,156(11):4274-4279.
[4]Goon PK,Watson T,Shantsila E,et al.Standardization of circulating endothelial cell enumeration by the use of human umbilical vein endothelial cells[J].J Thromb Haemost,2007,5(4):870-872.
[5]孙慧琳,湛奕,刘珍珍,等.人脐静脉内皮细胞的原代培养及鉴定[J].广东医学,2012,33(6):744-746.
[6]Strukova S.Blood coagulation-dependent inflammation.Coagulation-dependent inflammation and inflammation-dependent thrombosis[J].Front Biosci,2006,11(2):59-80.
[7]Roumen-Klappe EM,Janssen MC,Van Rossum J,et al.Inflammation in deep vein thrombosis and the development of post-thrombotic syndrome:a prospective study[J].J Thromb Haemost,2009,7(4):582-587.
[8]Jezovnik MK,Poredos P.Idiopathic venous thrombosis is related to systemic inflammatory response and to increased levels of circulating markers of endothelial dysfunction[J].Int Angiol,2010,29(3):226-231.
[9]Lin PH,Barshes NR,Annambhotla S,et al.Advances in endovascular interventions for deep vein thrombosis[J].Expert Rev Med Devices,2008,5(2):153-166.
[10]Samnegard A,Hulthe J,Silveira A,et al.Gender specific associations between matrix metalloproteinases and inflammatory markers in post myocardial infarction patients[J].Atherosclerosis,2009,202(2):550-556.
[11]Chandrasekar B,Vemula K,Surabhi RM,et al.Activation of intrinsic and extrinsic proapoptotic signaling pathways in interleukin-18-mediated human cardiac endothelial cell death[J].J Biol Chem,2004,279(19):20221-20233.
[12]Matsui K,Yoshimoto T,Tsutsui H,et al.Propionibacterium acnes treatment diminishes CD4+NK1.1+T cells but induces type Ⅰ T cells in the liver by induction of IL-12 and IL-18 production from Kupffer cells[J].J Immunol,1997,159(1):97-106.
[13]Leung BP,Culshaw S,Gracie JA,et al.A role for IL-18 in neutrophil activation[J].J Immunol,2001,167(5):2879-2886.
[14]Dziedziejko V,Kurzawski M,Paczkowska E,et al.The impact of IL-18 gene polymorphisms on mRNA levels and interleukin-18 release by peripheral blood mononuclear cells[J].Postepy Hig Med Dosw(Online),2012,66(66):409-414.
[15]Du G,Ye L,Zhang G,et al.Human IL-18,IL-2 fusion protein as a potential antitumor reagent by enhancing NK cell cytotoxicity and IFN-γ production[J].J Cancer Res Clin Oncol,2012,138(10):1727-1736.
[16]Blankenberg S,Luc G,Ducimetiere P,et al.Interleukin-18 and the risk of coronary heart disease in European men:the Prospective Epidemiological Study of Myocar dial Infarction[J].Circulation,2003,108(20):2453-2459.
[17]Sánchez E,Palomino-Morales RJ,Ortego-Centeno N,et al.Identification of a new putative functional IL-18 gene variant through an association study in systemic lupus erythematosus[J].Hum Mol Genet,2009,18(19):3739-3748.
[18]Ovsyannikova IG,Haralambieva IH,Kennedy RB,et al.Genetic variation in IL-18R1 and IL-18 genes and Inteferon γ ELISPOT response to smallpox vaccination:an unexpected relationship[J].J Infect Dis,2013,208(9):1422-1430.
[19]Wong CK,Ho AW,Tong PC,et al.Aberrant activation profile of cytokines and mitogen-activated protein kinases in type 2 diabetic patients with nephropathy[J].Clin Exp Immunol,2007,149(1):123-131.
[20]Ho LP,Davis M,Denison A,et al.Reduced interleukin-18 levels in BAL specimens from patients with asthma compared to patients wich sarcoidosis and healthy control subjects[J].Chest,2002,121(5):1421-1426.
Correlation between interleukin-18 and deep venous thrombosis disease
LiGuangdi,SongEn,ZhaoXueling,BaiYuncheng,PengZhi,ZhouRudan△
(DepartmentofOrthopedics,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650032,China)
Objective To investigate the correlation between IL-18 and deep venous thrombosis disease and its clinical signification.Methods To detect the expression of IL-18 by ELISA,we collected the blood samples of DVT patients as the experimental group(n=40) compared to the control group(n=40) and normal group(n=20).IL-18 over expression/interference vectors were constructed and transfected human vein endothelial cells,analyzed by microarray and KEGG Pathway as biology information technology.Then discuss the association between IL-18 and DVT.Results Results of ELISA showed that compared with control group and normal group,the expression of IL-18 gene in DVT patient were up-regulated(F=11.248,P<0.01).Compared with normal group,the IL-18 expression in control group have not been significantly up-regulated(P>0.05).Immunofluorescence detected IL-18 gene expression in cytoplasm of human umbilical vein endothelial cells(HUVECs).According to the microarray analysis we found in the IL18-pCDH-GFP transfected cells 17 signaling pathways were down-expressed while 16 signaling pathways were up-expressed.Compared with normal group cells,in the IL18-LMP-shRNAmir1 transfected cells 23 signaling pathways were down-expressed and 9 signaling pathways were up-expressed.Conclusion Based on the above experimental data,it is very clear that IL-18 influenced HUVECs and plays an important role in DVT,it is possible to predict the diagnosis of DVT and act as candidate molecular markers.
deep venous thrombosis;interleukin-18;biomarker;human umbilical vein endothelial cells
李光第(1981-),住院医师,博士,主要从事骨科常见疾病、深静脉血栓疾病的基础与临床研究。△
,E-mail:kittypku@qq.com。
10.3969/j.issn.1671-8348.2015.05.008
R619
A
1671-8348(2015)05-0600-05
2014-11-08
2014-12-10)
