Nek8在食管鳞癌中的表达及意义*
2015-06-01郭亚平付茂勇王朝莉李倩倩胡为民
郭亚平,朱 红,付茂勇,王朝莉,李倩倩,胡为民,△
(1.川北医学院微生物学与免疫学教研室,四川南充 637000;2.川北医学院附属医院胸心外科,
四川南充 637000;3.川北医学院免疫学与分子生物学研究所,四川南充 637000)
论著·基础研究
Nek8在食管鳞癌中的表达及意义*
郭亚平1,朱 红1,付茂勇2,王朝莉3,李倩倩1,胡为民1,3△
(1.川北医学院微生物学与免疫学教研室,四川南充 637000;2.川北医学院附属医院胸心外科,
四川南充 637000;3.川北医学院免疫学与分子生物学研究所,四川南充 637000)
目的 探讨食管鳞癌组织和细胞系中Nek8的表达及其与食管鳞癌临床病理特征和术后生存的关系。方法 采用RT-PCR法检测食管鳞癌细胞系Eca109细胞、2例配对的食管鳞癌组织和癌旁黏膜上皮中Nek8 mRNA表达情况;应用免疫组织化学法检测Nek8蛋白在食管鳞癌组织芯片中的表达情况,并结合临床病理资料和生存率进行统计学分析。结果 Nek8 mRNA在Eca109细胞、2例食管鳞癌患者的癌组织均有表达,而癌旁食管黏膜上皮中均未见明显的表达。组织芯片结果示Nek8蛋白主要表达于细胞质,在78例配对的标本中,Nek8在食管鳞癌组织中的表达显著高于其在癌旁黏膜组织的表达(P=2.16E-13)。其表达与肿瘤大小有关(P=0.008),而与性别、年龄、分化程度、浸润深度、淋巴结转移无关(P>0.05)。生存分析显示高表达和低表达Nek8的患者生存率差异无统计学意义(P>0.05)。结论 Nek8在食管鳞癌组织和细胞中表达上调,可能参与了食管鳞癌的发生、发展,可作为诊断的标志物和治疗的靶点。
免疫组织化学;Nek8;食管鳞癌;Eca109细胞
食管癌是世界第八大常见人类肿瘤,其病死率居癌症死因的第6位[1]。我国是食管癌发病率和病死率最高的国家,其发病率居恶性肿瘤的第4位。我国食管癌的发病率有明显的地区分布特点,其中,研究者所在的川东北地区是高发区之一。食管癌的形成是多因素作用、多基因变化和多阶段发展的过程,筛选和确定与食管癌发生发展相关的分子和信号通路,以及他们之间的互作关系,将为食管癌的发病机制、诊断、治疗、预后判断提供科学依据。1项食管癌相关的研究中,作者发现Nek8基因在食管鳞癌细胞系Eca109细胞中高表达,而正常食管黏膜上皮不表达。Nek8属NIMA相关激酶家族(never-in-mitosis a-related kinase,Nek),该家族为丝氨酸/苏氨酸激酶,在人类基因组中已发现包括Nek 1~11共11个成员[2]。目前关于Nek8的研究较少,多集中在与囊性肾病的关系,但Bowers等[3]发现Nek8水平在乳腺癌组织中比正常组织表达更高,提示Nek8可能是肿瘤相关基因。为进一步探讨Nek8与食管鳞癌的关系,本研究采用RT-PCR和组织芯片的方法,对Nek8在食管鳞癌组织中的表达进行了研究,作为探索Nek8与食管鳞癌或其他肿瘤是否相关的基础。
1 资料与方法
1.1 一般资料 食管鳞癌172点组织芯片(HEso-Squ172Sur-01)由上海芯超生物科技有限公司提供,含78例配对的癌组织及癌旁组织,8例癌组织,共86例。食管鳞癌的TNM分期、分级和病理诊断由公司提供。组织均来自经过患者知情同意的组织芯片库。其中男64例,女22例;年龄41~81岁,平均65岁;病理分化程度:Ⅰ级8例,Ⅰ~Ⅱ级20例,Ⅱ级40例,Ⅱ~Ⅲ级7例,Ⅲ级11例;无淋巴结转移者51例,有淋巴结转移者35例;肿瘤大小计算公式为:肿瘤大小=长×宽×高×π/6,其中22例小于或等于5 cm3,62例大于5 cm3,2例无相关资料。本研究调查的86例食管鳞癌患者,手术时间为2006年7月至2008年10月,随访时间2013年9月。随访时因食管癌死亡59 例,截尾数27例,分别占总人数的68.6%和31.4%。RT-PCR所用2例配对的食管鳞癌组织及癌旁食管黏膜上皮来自川北医学院附属医院胸心外科手术切除标本,均通过病理学诊断证实和患者知情同意。食管黏膜上皮为无菌条件下剪取远离癌组织的正常食管,除去结缔组织及血管,纵行剖开食管,PBS液洗涤,剪成大小约1 cm2小块,用眼科镊将黏膜层直接撕下。食管鳞癌Eca109细胞系购自中国典型培养物保藏中心。
1.2 主要试剂 兔抗人Nek8多克隆抗体购于Abcam公司。免疫组织化学试剂盒UltraVision Quanto Detection System HRP购自Thermo公司,包括信号放大剂Primary Antibody Amplifier Quanto和兔鼠结合二抗HRP Polymer Quanto等。DAB试剂盒购自Thermo公司。抗体稀释液购自DAKO公司。引物由上海生工合成。PrimeScriptTM RT-PCR试剂盒购自大连宝生物工程有限公司。TRIzol购自Invitrogen公司。其他试剂均为国产或进口分析纯。
1.3 方法
1.3.1 RT-PCR检测Nek8 mRNA的表达 用TRIzol提取细胞或组织总RNA,按照PrimeScriptTM RT-PCR试剂盒说明书提取总RNA进行逆转录合成cDNA并进行PCR。PCR引物如下,Nek8:上游引物为5′-CTG CGG CTG CCA ATG CTC AA-3′,下游引物为5′-AAC TCG CTG AGC TTC CTG TCC TGG-3′;β-actin:上游引物为5′-GAC GAG GCC CAG AGC AAG AGA-3′,下游引物为5′-ACG TAC ATG GCT GGG GTG TTG-3′。PCR条件为:94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共34个循环。
1.3.2 组织芯片免疫组织化学染色 将组织芯片放入烘箱中,烘蜡1 h;常规脱蜡水化;柠檬酸修复;内源性过氧化物酶阻断剂阻断10 min;滴加用DAKO抗体稀释液1∶3 000稀释的Nek8抗体,湿盒4 ℃孵育过夜,PBS冲洗;滴加信号放大剂作用10 min,PBS冲洗;滴加兔鼠结合二抗作用10 min,PBS冲洗;DAB显色,苏木素复染,脱水,中性树脂封固。以显色强度(intensity)和显色比例(percentage)的乘积(Q-score)作为结果判断的标准。显色强度分为0~3级,评级标准:0,不显色;1,弱显色;2,中度显色;3,强显色。显色比例分为0~9级,评级标准,0级:<5%;1级:5%~15%;2级:15%~25%……;9级:85%~100%。Q-score最小为0,最大为27。Q-score≤13.5为低表达,>13.5为高表达。
1.4 统计学处理 采用SPSS16.0统计软件进行分析,配对的癌组织及癌旁组织Nek8表达差异采用配对资料的非参数检验Wilcoxon检验。癌组织中Nek8表达情况与临床病理参数之间的关系采用χ2检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 RT-PCR检测Nek8 mRNA的表达 Eca109细胞、2例食管鳞癌患者的癌组织均有Nek8 mRNA表达,且Eca109细胞表达最强。在所检测的这2例患者癌旁食管黏膜上皮中均未见明显的Nek8表达,见图1。
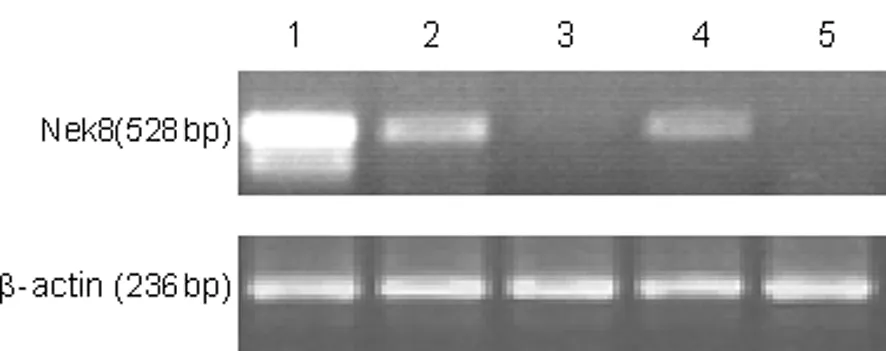
1:Eca109细胞;2、4:食管鳞癌组织;3、5:相应配对的癌旁食管黏膜上皮。
图1 RT-PCR检测Nek8 mRNA在食管鳞癌细胞系和组织中的表达
2.2 组织芯片食管鳞癌组织和癌旁组织中Nek8的表达 采用食管鳞癌组织芯片,用Nek8抗体进行免疫组织化学染色,结果如图2。Nek8主要表达在细胞胞质。检测的86例食管鳞癌标本中,癌组织均有Nek8表达,其中低表达38例,高表达48例。癌旁组织中,阴性16例,低表达61例,高表达1例。经Wilcoxon检验,在其中78例配对的标本中,Nek8在癌组织中的表达显著高于其在癌旁黏膜组织的表达,差异有统计学意义(P<0.05),见图3。

A:食管鳞癌组织;B:配对的癌旁组织。
图2 组织芯片免疫组织化学检测Nek8在配对的食管鳞癌组织和癌旁组织中的表达(×200)
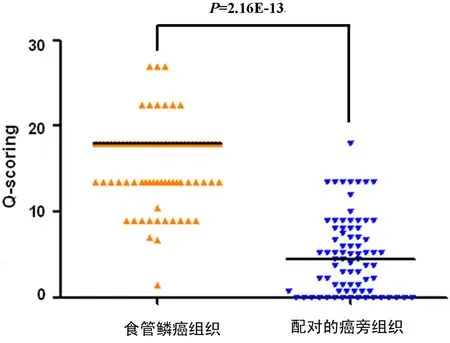
图3 Nek8在食管鳞癌组织和配对癌旁组织表达的统计学分析
2.3 Nek8表达与食管鳞癌临床病理参数的关系 经统计学分析,Nek8表达与性别、年龄、分化程度、浸润深度、淋巴结转移无关(P>0.05),与肿瘤大小有关(P<0.05),见表1。
2.4 Nek8表达与食管鳞癌患者术后生存的关系 采用Kaplan-Meier法和Log-rank检验,对癌组织Nek8表达与食管鳞癌患者生存率进行单因素生存分析发现,Nek8蛋白表达的高低与食管鳞癌患者术后生存无显著的相关性(P>0.05),见图4。
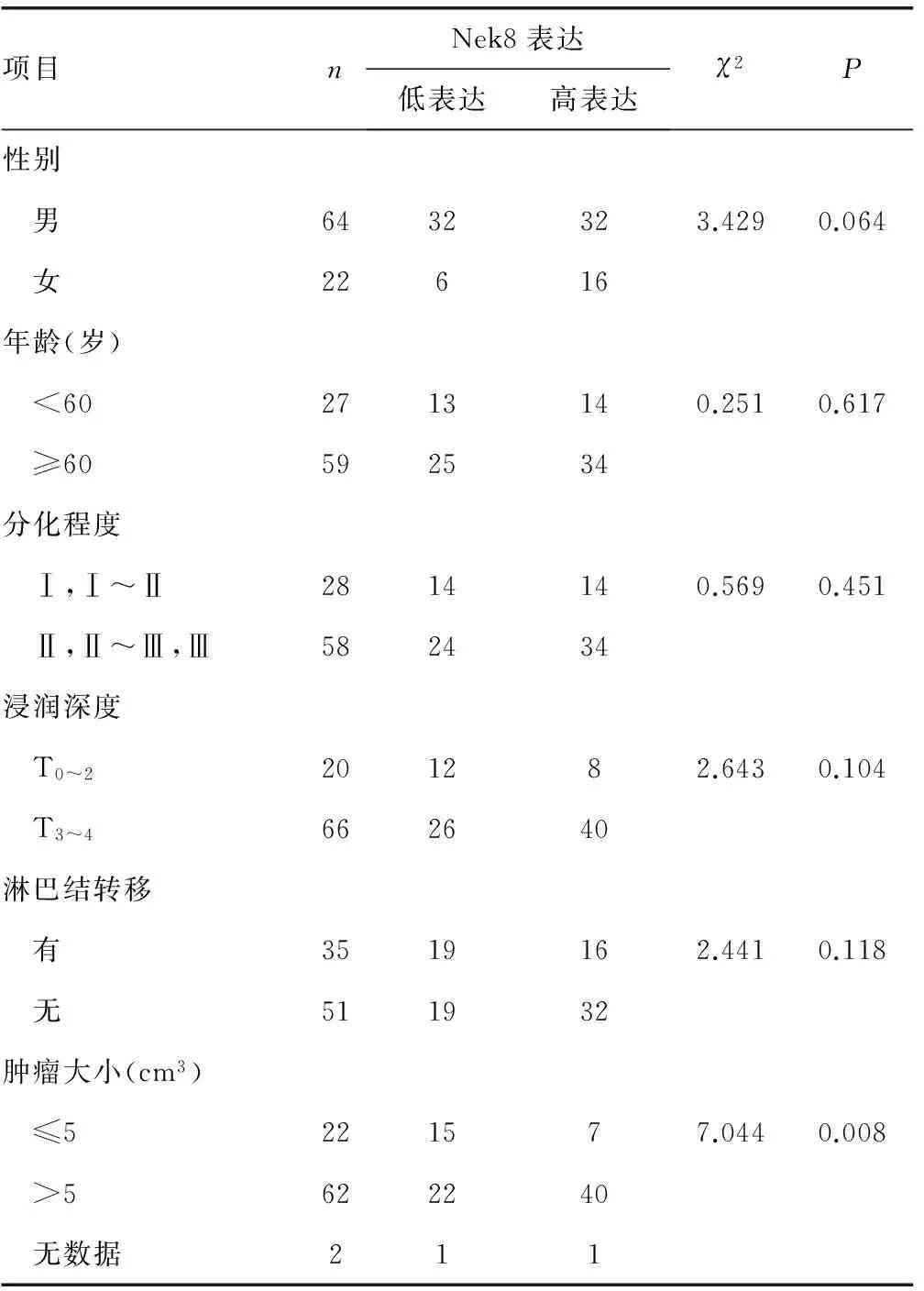
表1 Nek8表达与食管鳞癌临床病理特征的关系(n)

图4 Nek8表达与食管鳞癌患者术后生存的关系
3 讨论
在对丝状菌构巢曲霉的细胞分裂周期突变的遗传筛选中发现了与有丝分裂入口相关的丝氨酸/苏氨酸激酶NIMA。NIMA是G2/M期进展所需的重要蛋白酶,启动染色质凝聚和促进进入有丝分裂[3]。随后,在真核细胞中鉴定到NIMA的直系同源物Nek。目前在人类基因组中发现Nek家族包括Nek1~11共11个成员。其中,Nek2、Nek6、Nek7和Nek9与有丝分裂有关,Nek1和Nek8与纤毛形成有关,Nek1、Nek2和Nek11参与DNA损伤反应[4]。越来越多的研究表明,Nek家族部分成员的表达或功能异常与肿瘤的发生发展高度相关,其中以Nek2、Nek6研究最多。在多种恶性肿瘤组织和细胞系中,Nek2和/或Nek6的转录、蛋白、激酶活性水平上调,用小干扰RNA(siRNA)敲低Nek2或Nek6表达抑制了肿瘤细胞增殖,诱导细胞凋亡[5-6]。
在本研究前期1项与食管癌相关的研究中发现有一基因在食管鳞癌细胞系Eca109细胞中高表达,而正常食管黏膜上皮不表达。对该基因进行测序并在GenBank中进行比对,发现该基因为Nek8。Nek8首先被Holland和Liu等克隆[7-8],目前关于Nek8的研究较少,多集中在与囊性肾病的关系。人Nek8在分裂细胞中定位于中心体,在有纤毛细胞中定位于最接近纤毛的区域。在常染色体隐性多囊肾(ARPKD)模型jck小鼠中发现Nek8发生G448V突变。在肾集合管细胞中,突变改变了Nek8的定位,由明显的顶点定位改变为分散的细胞质定位。表达突变的Nek8导致细胞分裂失败,出现更大的和多核的细胞,肌动蛋白细胞骨架也出现异常。在斑马鱼中用反义寡核苷酸敲低Nek8导致形成前肾囊肿,敲除Nek8的小鼠其肾发育受到损害,提示Nek8功能丢失导致多囊肾病[3,8-9]。Nek8也与常染色体隐性肾疾病少年型肾单位肾痨(nephromophthisis,NPHP)相关(因此Nek8也被称为NPHP9)。在患者标本中发现了几个Nek8突变体(L330F,H425Y和A497P)。在小鼠内髓集合管上皮细胞系IMCD3细胞中过表达3个突变均显示Nek8在纤毛定位的减少,支持Nek8的错误定位导致肾囊肿的形成[10-12]。Nek8通过启动复制叉进程,抑制异常的起点激发,稳定失速的复制叉而保持基因组稳定性。Nek8丢失导致自发的DNA损伤和细胞对复制应激反应的缺失。Nek8可能是复制应激反应的关键效应分子,该反应失调可能导致肾纤毛疾病的发生[13-14]。
本研究针对食管鳞癌中Nek8的表达情况进行了研究。RT-PCR结果显示Eca109细胞、食管鳞癌组织均有Nek8 mRNA表达,而在检测的正常食管黏膜上皮中未见明显的Nek8表达。组织芯片包含的78例配对的标本中,Nek8在食管鳞癌组织中的表达显著高于其在癌旁黏膜组织的表达。提示Nek8可作为诊断食管鳞癌的分子标志物,并且可能与食管鳞癌的发生、发展相关。关于Nek8与肿瘤关系的研究,目前报道极少,只有两篇文献提及。Bowers等[3]研究发现,Nek8在乳腺癌中比乳腺正常组织表达更高;Chan等[15]针对41个配对的外科切除的肝细胞肝癌标本定量RT-PCR结果显示,Nek8在肿瘤组织中有1.29倍的增加。以上研究均提示Nek8可能是肿瘤相关基因,但其在肿瘤发生、发展中的作用尚不清楚。本研究还发现,Nek8表达与性别、年龄、分化程度、浸润深度、淋巴结转移无关(P>0.05),而与肿瘤大小有关(P<0.05),提示Nek8可能与细胞增殖关系密切。虽然Nek家族多数成员被认为是细胞周期调节子,Nek8是否参与细胞周期调节尚不清楚,在骨肉瘤U2-0S 细胞系中表达缺陷突变的Nek8导致肌动蛋白减少,Cdk1/cyclinB1微弱增加,提示Nek8可能与G2/M进程相关[3];另外,Habbig等[12]发现Nek8促进Hippo信号通路的癌基因转录因子TAZ转位入核,在乳腺癌细胞中敲低Nek8抑制了TAZ诱导的增殖,提示Nek8可能和TAZ共同控制细胞增殖。生存分析结果显示,高表达和低表达Nek8的患者生存率差异无统计学意义(P>0.05),提示Nek8与食管鳞癌患者的预后可能无显著的关联。
总之,Nek8是一潜在的肿瘤相关基因,可能与食管鳞癌等肿瘤发生、发展相关,但其具体机制尚不清楚。尚需进一步研究明确其功能,该分子有望作为诊断食管鳞癌的标志物和治疗食管鳞癌的靶点。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]FryAM,O′reganL,SabirSR,etal.Cellcycle regulation by the NEK family of protein kinases[J].J Cell Sci,2012,125(Pt 19):4423-4433.
[3]Bowers AJ,Boylan JF.Nek8,a NIMA family kinase member,is overexpressed in primary human breast tumors[J].Gene,2004,328:135-142.
[4]Malumbres M,Barbacid M.Cell cycle kinases in cancer[J].Curr Opin Genet Dev,2007,17(1):60-65.
[5]Tsunoda N,Kokuryo T,Oda K,et al.Nek2 as a novel molecular target for the treatment of breast carcinoma[J].Cancer Sci,2009,100(1):111-116.
[6]Nassirpour R,Shao L,Flanagan P,et al.Nek6 mediates human cancer cell transformation and is a potential cancer therapeutic target[J].Mol Cancer Res,2010,8(5):717-728.
[7]Holland PM,Milne A,Garka K,et al.Purification,cloning,and characterization of Nek8,a novel NIMA-related kinase,and its candidate substrate Bicd2[J].J Biol Chem,2002,277(18):16229-16240.
[8]Liu S,Lu W,Obara T,et al.A defect in a novel Nek-family kinase causes cystic kidney disease in the mouse and in zebrafish[J].Development,2002,129(24):5839-5846.
[9]Manning DK,Sergeev M,Van Heesbeen RG,et al.Loss of the ciliary kinase Nek8 causes left-right asymmetry defects[J].J Am Soc Nephrol,2013,24(1):100-112.
[10]Otto EA,Trapp ML,Schultheiss UT,et al.NEK8 mutations affect ciliary and centrosomal localization and May cause nephronophthisis[J].J Am Soc Nephrol,2008,19(3):587-592.
[11]Zalli D,Bayliss R,Fry AM.The Nek8 protein kinase,mutated in the human cystic kidney disease nephronophthisis,is both activated and degraded during ciliogenesis[J].Hum Mol Genet,2012,21(5):1155-1171.
[12]Habbig S,Bartram MP,Sägmüller JG,et al.The ciliopathy disease protein NPHP9 promotes nuclear delivery and activation of the oncogenic transcriptional regulator TAZ[J].Hum Mol Genet,2012,21(26):5528-5538.
[13]Choi HJ,Lin JR,Vannier JB,et al.NEK8 links the ATR-regulated replication stress response and S phase CDK activity to renal ciliopathies[J].Mol Cell,2013,51(4):423-439.
[14]Jackson PK.Nek8 couples renal ciliopathies to DNA damage and checkpoint control[J].Mol Cell,2013,51(4):407-408.
[15]Chan WL,Yuo CY,Yang WK,et al.Transcribed pseudogene ψPPM1K generates endogenous siRNA to suppress oncogenic cell growth in hepatocellular carcinoma[J].Nucleic Acids Res,2013,41(6):3734-3747.
Significance of Nek8 expression in esophageal squamous cell carcinoma*
GuoYaping1,ZhuHong1,FuMaoyong2,WangChaoli3,LiQianqian1,HuWeimin1,3△
(1.DepartmentofMicrobiologyandImmunology,NorthSichuanMedicalCollege,Nanchong,Sichuan637000,China;2.DepartmentofCardiothoracicSurgery,theAffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong,Sichuan637000,China;3.InstituteofImmunologyandMolecularBiology,NorthSichuanMedicalCollege,Nanchong,Sichuan637000,China)
Objective To investigate the expression of Nek8 in esophageal squamous cell carcinoma(ESCC) tissues and cell line,and to evaluate its correlation with the clinicopathological features of ESCC and the survival rate of ESCC patients after operation.Methods The expression of Nek8 mRNA in human ESCC Eca109 cell line and two pairs of ESCC tissues and adjacent normal esophageal mucosal epithelium were detected by semi-quantitative reverse transcription polymerase chain reaction(RT-PCR).Immunohistochemistry and tissue microarray technique were used to examine the expression of Nek8 protein in ESCC tissues and tumor-adjacent tissues.The correlation between Nek8 expression and clinicopathological features of ESCC and survival rate of ESCC patients was then analyzed.Results The expression of Nek8 mRNA was positive in Eca109 cells and two cases of ESCC tissue,and it was negative in paired normal esophageal mucosal epithelium specimens.In tissue microarray,the expression of Nek8 protein in ESCC tissues,which was mainly in the cytoplasm,was significantly higher than that in tumor-adjacent tissues(P=2.16E-13).The high expression of Nek8 was associated with tumor size(P=0.008),but not with sex,age,histological grade,infiltration degree,lymph node metastasis,and the survival rate(P>0.05).Conclusion The expression of Nek8 is up-regulated in ESCC tissues and cell line,and may be involved in tumorigenesis and development of ESCC.Nek8 could act as a potential biomarker for ESCC diagnose and target for therapy.
immunohistochemistry;Nek8;esophageal squamous cell carcinoma;Eca109 cell
10.3969/j.issn.1671-8348.2015.05.007
四川省科技厅重点科技自筹项目(2011JYZ023)。 作者简介:郭亚平(1958-),副教授,本科,主要从事肿瘤生物学与免疫方面研究。△
,E-mail:wmhu2002@163.com。
R735.1
A
1671-8348(2015)05-0597-03
2014-08-27
2014-10-16)
