可降解镁合金作为骨填充材料的研究和展望
2015-06-01王韦丹韩军杰万鹏谭丽丽杨柯
王韦丹,韩军杰,万鹏,谭丽丽,杨柯
中国科学院金属研究所,沈阳 辽宁110016
可降解镁合金作为骨填充材料的研究和展望
王韦丹,韩军杰,万鹏,谭丽丽,杨柯
中国科学院金属研究所,沈阳 辽宁110016
由于各种原因造成的骨缺损的修复是临床上一项具有挑战性的难题。自体骨移植被认为是理想的骨移植物,但是不可避免有其局限性:取骨区并发症和取骨量有限。伴随骨移植手术的增加对填充材料数量要求的激增,推动了合成骨填充材料的发展。可降解镁合金所具有的金属材料特性,其强度、塑性等都要远优于现已开始临床应用的钙磷陶瓷、硫酸钙和聚乳酸等可吸收材料,同时其弹性模量和密度更接近骨组织,因而具有在骨填充修复方面临床应用的优势和潜力。
镁合金;可降解;骨填充材料
骨损伤是医学中最常见的临床创伤,常见的骨损伤包括:普通骨折、粉碎性骨折、髋部骨折、关节部骨折、骨肿瘤、手外伤、颅骨损伤等。据报道,全球每年进行的骨科手术总数中的18%-20%需要进行骨移植填充。骨移植手术也是临床中仅次于输血而最常见的组织移植术,每年在美国有50万例,在全球有超过220万例骨移植应用于骨科、神经外科和口腔颌面外科[1-2]。随着世界人口老龄化的加剧以及骨科手术数量的增加,对骨填充材料的需求呈逐年增加的趋势。据统计,2010年全世界的骨填充产品市场价值为19亿美元,到2017年预计将达到33亿美元,年增长率将达到8.3%[3]。然而目前国内的医疗器械市场多数被国外产品垄断,国内生产的医疗器械基本上是仿制或技术含量较低的低端产品,根本无法满足目前国内的医疗需求。
由于各种原因造成的骨缺损的修复是临床上一项具有挑战性的难题。自体骨移植被认为是理想的骨移植物,但是不可避免有其局限性:取骨区并发症和取骨量有限。长期以来,人们认为骨移植的“金标准”是取自髂嵴的皮质骨和松质骨,然而供区的慢性疼痛成为患者术后随访的主要和长时间的主述[4]。异体骨具有良好的骨传导性以及通过使用某些特定的处理方法保留骨诱导性,也常用于骨填充术中,同样地其存在免疫排斥反应以及感染的弊端。伴随骨移植手术的增加对填充材料数量要求的激增,从而推动了合成骨填充材料的发展。
1 现有骨填充替代材料
目前市场上常见的骨填充材料主要包括磷酸钙陶瓷、硫酸钙、生物玻璃、可降解高分子材料等[5]。陶瓷材料是应用最多的一类,主要为羟基磷灰石(HA)和磷酸三钙(TCP)。HA的分子式为Ca10(PO4)6(OH)2,钙磷比为1.67。其来源主要有3种:人工化学合成、动物骨烧结而成和珊瑚热液转化而成。HA的分子结构和钙磷比与正常骨的无机成分非常近似,生物相容性好。β-TCP的分子式为Ca3(PO4)2,钙磷比为1.5,与正常骨组织的钙磷比接近,主要用化学合成的方式制备。β-TCP 最突出的特点是可在生物体内降解。Okuda等[6]的实验发现,β-TCP 在植入日本白兔的股骨髁后24周基本完全降解,而HA无降解。陶瓷材料能与骨组织产生化学结合或在体内降解,且强度也较高。但主要缺点是自身脆性较大,其弹性模量难以与正常骨相匹配,在一定程度上限制了陶瓷材料在临床上的应用。
硫酸钙用作骨缺损填充修复材料已经达百年之久。硫酸钙分为二水硫酸钙、半水硫酸钙和无水硫酸钙。二水硫酸钙也即熟石膏再次水化的人造石膏。众多研究表明,硫酸钙人工骨具有良好的生物相容性,体内可完全降解,是理想的骨移植替代材料。体外细胞培养研究证实,成骨细胞可以贴附在硫酸钙表面生长,硫酸钙对成骨细胞无毒性作用,并在一定程度上刺激成骨细胞的增殖和分化。植入动物骨缺损部位的硫酸钙会逐渐被新生骨组织替代,组织学检查未发现异物排斥反应和免疫排斥反应[7]。目前已广泛应用于矫形外科、五官科、齿科骨缺损的填充。硫酸钙存在的主要问题是其体内降解速度过快。Bell[8]研究发现,硫酸钙的降解速度比自体骨快两倍多,比异体骨和异种骨快得更多,硫酸钙在体内完全降解时间为33天,而自体骨为7周,异体骨为10周,异种骨为11.5周。
生物活性玻璃的主要成分是SiO2。该材料在体内可与体液及组织作用生成一层含钙和磷的磷灰石层,实际上是碳酸羟基磷灰石,与正常骨组织中的无机相成分近似[9]。多数生物活性玻璃以一种称为45S5的形式出现。Xynos[10]在45S5生物活性玻璃的体外实验中证实其不仅具有骨传导特性,而且具有成骨特性。但该材料在体内不能降解,植入体内后长期存留,因此其广泛应用受到了很大限制。
2 生物可降解镁合金的发展
从本世纪初开始,以生物可降解镁合金为代表的具有生物可降解(吸收)特性的新一代医用金属材料的研究发展迅速,受到了人们的特别关注。这类新型医用金属材料抛弃人们通常将金属植入材料作为生物惰性材料使用的传统思想,而巧妙地利用镁基金属材料(纯镁及镁合金)在人体环境中易发生腐蚀(降解)的特性,来实现金属植入物在体内逐渐降解直至最终消失的医学临床目的。此外,由于镁合金所具有的金属材料特性,其强度、塑性等都要远优于现已开始临床应用的陶瓷、硫酸钙和聚乳酸等可吸收材料,同时其弹性模量和密度更接近骨组织,因而具有在骨修复方面临床应用的优势和潜力。
生物可降解镁合金的研究与临床应用是一个循序渐进的过程。从1892年开始,奥地利医生Payr相继研究了镁金属在不同医学领域中的应用尝试,涵盖了骨科、肿瘤、肌肉、血管系统等,取得了大量实验结果,掀起了镁金属医学应用的研究热潮[11]。近10余年来,以德国为领先的多个国家科学家对生物可降解镁合金进行了大规模研究。Witte等[12]将多孔AZ91D镁合金植入兔子股骨中,并以自体骨移植作为参照进行对比研究。结果显示术后3个月,多孔AZ91D镁合金基本全部降解,植入物周围有更多的新骨形成和骨小梁生成。多孔镁合金的快速降解对周围组织没有引起有害作用,并且可以促进骨重塑和具有良好的生物相容性。到目前为止,全球现有相关临床试验中所使用的镁合金,在血液和骨环境下的短期试验观察中均没有发现不良后果。
3 可降解镁合金作为骨填充材料的优势
理想的骨填充材料应该具有促进新骨的再生,与植入部位骨近似的生物力学性能,以及体内的可吸收性等特点。对于可降解镁合金而言,相比目前使用的骨填充材料,其具有以下优势:
(1)优异的抗拉、抗压强度以及与人体骨骼接近的弹性模量等力学性能(表1)。

表1 不同材质骨填充材料的力学性能[19]
(2)良好的生物相容性:镁是人体正常生命活动及新陈代谢过程必不可少的元素,正常成人身体总镁含量约25 g,其中60%~65%存在于骨、齿,27%分布于软组织。镁影响细胞的多种生物功能:影响钾离子和钙离子的转运,调控信号的传递,参与能量代谢、蛋白质和核酸的合成;催化酶的激活和抑制及对细胞周期、细胞增殖及细胞分化的调控等[13];镁合金植入生物体内后,可在其表面形成磷酸盐类物质,进而周围会有大量成骨细胞生成[14]。
(3)骨激发(可控制的骨诱导):由于镁基金属骨填充材料与骨组织之间若干的物理、化学反应可促进骨细胞的增长、活化骨细胞的基因表达,相对于单纯的只有骨传导作用的骨修复材料而言,镁基金属能激发和加速骨缺损处的新骨生长,加快骨组织形成的速度。
(4)骨传导:镁基填充材料降解产生的碱性环境有利于类骨磷酸盐类物质沉积,在骨骼修复和重建过程中,提供骨传导特性的骨骼生长架构,促进新骨的爬行生长[15];镁基填充材料还具有促血管化的功能,能够促进骨重建的所需血运。
(5)充分吸收:镁基填充材料的绝大部分在植入的最初3~4个月内可被吸收。
(6)安全:镁的降解产物可以通过血液吸收和肾脏代谢出人体[16]。
(7)抗菌:镁降解产生的高碱性环境可有效地抑制和杀灭细菌,如金黄色葡萄球菌和大肠杆菌[17]。
(8)抗肿瘤:镁的降解对肿瘤细胞存活具有强烈的抑制作用[18]。
(9)镁基金属来源广泛,成本低廉。
表2中列出了不同骨填充材料的应用对比,镁合金优良的力学性能、促成骨、生物活性以及抗菌(感染)的独特优势,作为可吸收骨填充材料的应用具有巨大的优势和潜力及市场竞争力。
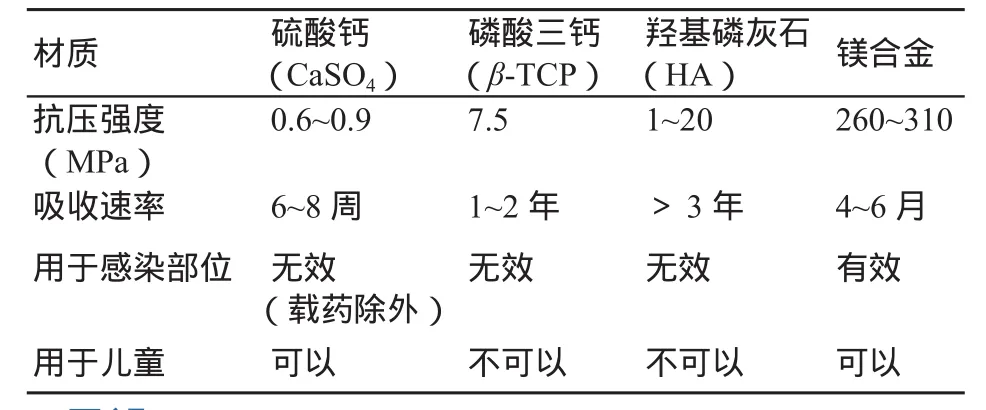
表2 不同骨填充材料的应用对比[4,19]
4 展望
理想的骨填充材料应该具有促进新骨的再生,与植入部位骨近似的生物力学性能,以及体内的可吸收性[20]。对于可降解镁合金而言,相比现有的骨填充材料,其具有优异的强度和塑性等生物力学性能;同时镁是人体中的必需元素,大量研究表明其促进成骨细胞的增殖及分化,具有良好的生物相容性和优异的生物活性。镁合金植入生物体内后,可在其表面形成磷酸盐类物质,周围会有大量成骨细胞生成。而现有骨填充材料并不能诱导新骨形成,只能通过添加生长因子及骨形态发生蛋白来提高骨诱导性。
目前可降解镁合金应用存在的最大问题是初期降解速度过快,并且降解产生的氢气对于植入组织的影响尚不清楚。而对于骨填充材料,研究发现有些被称之为可吸收的骨填充物在体内植入几年后仍然发现其存在[21-23]。另一方面过快的吸收速度而缺乏骨的形成也会造成有害的后果[24-25]。因此对于可降解镁合金应用于骨填充修复治疗中的探索,关键问题是镁合金的降解速度与骨修复过程的匹配,以及镁合金和涂层中的活性元素及其降解产物(氢气等)对于诱导促进骨形成和重建的影响。
到目前为止,德国Syntellix公司制造的MAGNEZIX®镁合金压缩螺钉已经通过了CE认证,韩国&I公司制造的镁合金螺钉也通过了KFDA的批准,用于指关节的骨折固定。国内的科研院所,如中国科学院金属研究所等,也正在配合东莞宜安、江苏创生等医疗器械厂商进行镁合金骨科产品的申报和上市。可降解镁合金作为新一代可吸收骨填充材料的产品开发与应用,在国际还未见有相关报道。镁基填充器件这一创新理念,结合产品性能优势和市场开发空间,将会成为今后骨科医疗器械行业的领先型产品,也有助于提升我国医疗器械产业的技术水平和核心竞争力。
[1]Habibovic P,Barralet JE.Bioinorganics and biomaterials:bone repair[J].Acta Biomaterialia,2011,7(8):3013-3026.
[2]Calo ri GM,M azza E,Co lom bo M,et al.The use of bone graft substitutes in large bone defects:any specific needs[J]. Injury,2011,42(2):56-63.
[3]Global Data Inc.(2011).N IH Stem Cell Registry.Bone Graft Substitutes-Global Pipeline Analysis,Competitive Landscape and Market Forecast to 2017[EB/OL].http://stem cells.nih.gov.
[4]Giannoudis P,Dinopoulos H,Tsiridis E.Bone substitutes:an update[J].Injury,2005,36:20-27.
[5]Van der Stok J,Van Lieshout EM,El-Massoudi Y,et al.Bone substitutes in the Netherlands-a systematic literature review[J]. Acta Biomater,2011,7(2):739-750.
[6]Okuda T,Ioku K,Yonezawa I,et al.The effect of the microstructure of beta-tricalcium phosphate on the metabolism of subsequently formed bone tissue[J].Biomaterials,2007,28(16):2612-2621.
[7]陈华,陶笙,张伯勋,等.硫酸钙作为骨填充修复材料的新观点与新认识[J].中国临床康复,2005,9(18):180-181.
[8]Bell DH.Resorption characteristics of bone and bone substitutes[J]. Oral Surg Oral Med Oral Pathol,1964,17:650-657.
[9]Kokubo T.Bioactive glass ceram ics:properties and appl ications[J]. Biomaterials,1991,12(2):155-163.
[10]Xynos ID,Hukkanen MV,Batten JJ,et al.Bioglass 45S5 stimulates osteoblast turnover and enhances bone formation In vitro:implications and applications for bone tissue engineering.[J]. Calcif Tissue Int,2000,67(4):321-329.
[11]W itte F.The history of biodegradable magnesium implants:a review[J].Acta Biomater,2010,6:1680-1692.
[12]W itte F,Reifenrath J,M ueller PP,et al.Cartilage repair on magnesium scaffolds used as a subchondral bone replacement[J]. Materialwiss Werkst,2006,37:504-508.
[13]Staiger MP,Pietak AM,Huadmai J,et al.M agnesium and its alloys as orthopedic biomaterials:a review[J].Biomaterials, 2006,27:1728-1734.
[14]Zhai Z,Qu X,Li H,et al.The effect of metallic magnesium degradation products on osteoclast-induced osteolysis and attenuation of NF-κB and NFATc1 signaling[J].Biomaterials, 2014,35(24):6299-6310.
[15]W itte F,Kaese V,Haferkam p H,et al.In vivo corrosion of four magnesium alloys and the associated bone response[J]. Biomaterials,2005,26:3357-3363.
[16]Tan L,Yu X,W an P,et al.Biodegradable M aterials for BoneRepairs:A Review[J].J Mater Sci Technol,2013,29(6):503-513.
[17]Ren L,Lin X,Tan LL,et al.Effect o f su rface coating on antibacterial behavior of magnesium based metals[J].Mater Lett, 2011,65:3509-3511.
[18]Zhang Y,Ren L,Li M,et al.Prelim inary Study on Cytotoxic Effect of Biodegradation of M agnesium on Cancer Cells[J].J Mater Sci Technol,2012,28(9):769-772.
[19]Liu C,W an P,Tan L,et al.Preclinical investigation of an innovative magnesium-based bone graft substitute for potential orthopaedic applications[J].JOT,2014,2(3):139-148.
[20]Zhang Z,Egana JT,Reckhenrich AK,et al.Cell-based resorption assays for bone graft substitutes[J].Acta Biomater,2012,8:13-19.
[21]Baron R.M olecular m echanism s of bone reso rption:An update[J].Acta Orthop Scand,1995,66(S266):88-91.
[22]Teitelbaum SL.Osteoclasts,integrins,and osteoporosis[J].J Bone M iner Metab,2000,18:344-349.
[23]Kraal T,Mullender M,de Bruine JH,et al.Resorbability of rigid beta-tricalcium phosphate wedges in open-wedge high tibial osteotomy:a retrospective radiological study[J].Knee,2008, 15:201-205.
[24]Grossterlinden L,Janssen A,Schm itz N,et al.Deleterious tissue reaction to an alkylene bis(dilactoyl)-m ethacrylate bone adhesive in long-term follow up after screw augmentation in an ovine model[J].Biomaterials,2006,27:3379-3386.
[25]Hutmacher DW.Scaffolds in tissue engineering bone and cartilage[J].Biomaterials,2000,21:2529-2543.
Research and Prospects of M g-Based M etals as Bone Graft Substitutes
WANG Wei-dan, HAN Jun-jie, WAN Peng, TAN Li-li, YANG Ke
Institute of Metal Research, Chinese A cadem y o f Sc iences, Shenyang Liaoning 110016, China
Bone defects are very challenging in orthopedic practice. There are many practical and clinical shortcom ings in the repair of the defects by using autografts, allografts or xenografts, which continues to motivate the search for better alternatives. Magnesium-based metals have been increasingly studied in the past decade, and most studies are involved in their potential to be used as biodegradable implants due to their bio-compatibility combined w ith outstanding physical and mechanical properties. Their mechanical strength, degradation rate and bio-compatibility are taken as predom inant advantages compared w ith commercialized bone substitutes. Thus, biodegradable Mg-based metals can be potential candidates as bone graft substitutes for future orthopaedic applications.
Mg alloys;biodegradable;bone substitutes
TG146.2
A
10.3969/j.issn.1674-1633.2015.09.003
1674-1633(2015)09-0012-04
国家“863”课题“新型轻质高强骨科植入材料研发”项目(No.2015AA033701)。
杨柯,研究员,博士生导师,研究领域包括新型医用金属材料、先进钢铁材料、储氢合金等。
通讯作者邮箱:kyang@im r.ac.cn
