与用量有关的离子方程式的书写
2015-05-30刘羽中
刘羽中
离子方程式是高考化学的热点,尤其是与反应物用量有关的离子反应方程式在近年来高考中出现的频率很高.这类题型因其灵活度大、综合性强、令学生倍感棘手.本文将对“与用量有关的离子方程式的书写”进行系统的归纳与小结,希望能对学生有所帮助.
首先必须弄清几个与用量有关的名词:少量——自身全部反应,但另一反应物有剩余;过量——自身有剩余,另一反应物全部反应;适量——自身和另一反应物刚好完全反应;足量——可以是过量或适量;一定量——没有明确限制,可以是过量、适量或足量.其中最常见的是少量和过量.
“与用量有关的离子方程式”主要有两种类型:复分解反应和氧化还原反应,下面分别介绍.
一、复分解反应(分为定性和定量两种情况)
1.定性分析
(1)多元弱酸或酸性氧化物与碱反应
例1书写离子方程式:①NaOH溶液中通入少量SO2;②NaOH溶液中通入过量SO2.
解析①NaOH过量,产物为正盐Na2SO3,离子方程式为:2OH-+SO2SO2-3
+H2O;
②SO2过量,生成酸式盐NaHSO3,离子方程式为:OH-+SO2HSO-3.
(2)弱酸盐与酸或酸性氧化物反应
例2书写用Na2CO3溶液吸收少量SO2的离子方程式.
解析本题实质是Na2CO3与H2SO3反应,SO2少量意味着H2SO3少量,提供H+也少量,只能将CO2-3转化为HCO-3,同时H2SO3将H+全部提供出来后转化为SO2-3.因此,离子方程式为:2CO2-3+SO2+H2O2HCO-3+SO2-3.
(3)某些弱酸酸式盐与碱反应
例3书写Mg(HCO3)2溶液中加入过量NaOH的离子方程式.
解析Mg(HCO3)2与NaOH反应,生成的沉淀可能有两种:一是MgCO3,二是Mg(OH)2.因为Mg(OH)2比MgCO3更难溶于水,离子反应总是向着离子浓度减小的方向进行,所以在过量NaOH情况下应生成Mg(OH)2.离子方程式为:Mg2++2HCO-3+4OH-Mg(OH)2↓+2H2O+2CO2-3.
(4)不同滴加顺序的影响
例4书写离子方程式:①将过量NaOH溶液滴入AlCl3溶液中②将过量AlCl3溶液滴入NaOH溶液中.
解析①开始时NaOH少量,发生反应:Al3++3OH-Al(OH)3↓,待Al3+完全转化为Al(OH)3后,NaOH继续与Al(OH)3反应:Al(OH)3+OH-AlO-2+2H2O,总反应式为:Al3++4OH-AlO-2+2H2O.
②开始时NaOH过量,发生反应:Al3++4OH-AlO-2+2H2O,AlCl3过量后发生:Al3++3AlO-2+6H2O4Al(OH)3↓,总反应式为:Al3++3OH-Al(OH)3↓.
2.定量分析
遵循“少量定系数”原则——即:量少物质全反应,系数定为1;量多物质“按需取量”,由量少物质决定系数.
例5书写下列离子方程式①NaHCO3溶液与少量Ba(OH)2反应②NaHCO3溶液与过量Ba(OH)2反应.
解析本题涉及两个反应:HCO-3+OH-CO2-3+H2O和CO2-3+Ba2+BaCO3↓,即OH-与HCO-3先反应,生成的CO2-3又与Ba2+反应.①根据“少量定系数”原则,当Ba(OH)2少量时,定Ba(OH)2系数为1 mol,即有1 mol Ba2+和2 mol OH-,2molOH-需要2 mol HCO-3生成2 mol CO2-3和2mol H2O,其中1 mol CO2-3与Ba2+生成BaCO3沉淀,另1 mol CO2-3以Na2CO3形式存在溶液中,离子方程式为:2HCO-3+Ba2++2OH-BaCO3↓+CO2-3+2H2O.
②当NaHCO3少量时,定NaHCO3系数为1 mol,即有1 mol HCO-3,需1 mol OH-生成1 mol H2O和1 mol CO2-3,1 mol CO2-3又需1 mol Ba2+生成BaCO3沉淀,此时虽然Ba(OH)2的配比Ba2+:OH-=1∶2,但参加反应的OH-只有1 mol(注:另1 mol OH-以NaOH形式存在溶液中),所以应“按需取量”,离子方程式为:HCO-3+Ba2++OH-BaCO3↓+H2O.
例6向明矾[KAl(SO4)2·12H2O]溶液中滴加Ba(OH)2溶液,写出符合下列条件的离子方程式.
①当Al3+完全沉淀时(即沉淀的物质的量最大时)
②当SO2-4完全沉淀时(即沉淀的质量最大时)
③当KAl(SO4)2·12H2O与 Ba(OH)2的物质的量之比为1∶1.8时.
解析本题涉及两组离子,3个简单离子方程式,即Ba2+和SO2-4:Ba2++SO2-4BaSO4↓;Al3+和OH-:Al3++3OH-Al(OH)3↓或Al3++4OH-AlO-2+2H2O.设KAl(SO4)2有1 mol,即有1 mol Al3+和2 mol SO2-4.
①当Al3+完全沉淀时,1 mol Al3+需3 mol OH-,即需要1.5 mol Ba(OH)2,1.5 mol Ba2+只需1.5 mol SO2-4就可以生成BaSO4沉淀;所以离子方程式为Al3++1.5SO2-4+1.5Ba2++3OH-Al(OH)3↓+1.5BaSO4↓,化简后得到反应的离子方程式为:2Al3++3SO2-4+3Ba2++6OH-3BaSO4↓+2Al(OH)3↓,此时沉淀共有2.5 mol,为物质的量最大时.
②当SO2-4完全沉淀时,2 mol SO2-4需2 mol Ba2+,即需要2 mol Ba(OH)2,电离出的4 mol OH-与1 mol Al3+正好生成1 mol AlO-2和2 mol H2O,反应的离子方程式为:Al3++2SO2-4+2Ba2++4OH-2BaSO4↓+AlO-2+2H2O.此时沉淀虽只有2 mol,但质量有2 mol×233 g·mol-1=466 g,为沉淀质量最大时.
③设KAl(SO4)2·12H2O有1 mol,Ba(OH)2有1.8 mol,则Al3+有1 mol,SO2-4有2 mol;Ba2+有1.8 mol,OH-有3.6 mol,发生的反应有:1.8Ba2++1.8SO2-41.8BaSO4↓,Al3++3OH-Al(OH)3↓,0.6 Al(OH)3+0.6OH-0.6AlO-2+1.2H2O,Al(OH)3的物质的量为1 mol-0.6 mol=0.4 mol,总反应式为:Al3++1.8SO2-4+1.8Ba2++3.6OH-1.8BaSO4↓+0.6AlO-2+0.4Al(OH)3↓+1.2H2O,化简即得结果:5Al3++9SO2-4+9Ba2++18OH-9BaSO4↓+3AlO-2+2Al(OH)3↓+6H2O.
二、氧化还原反应
注意点:
1.电子守恒,即还原剂失电子数等于氧化剂得电子数;
2.若氧化剂或还原剂的离子不止一种,应注意“先后原则”,即氧化性强或还原性强的离子先反应,弱的后反应.
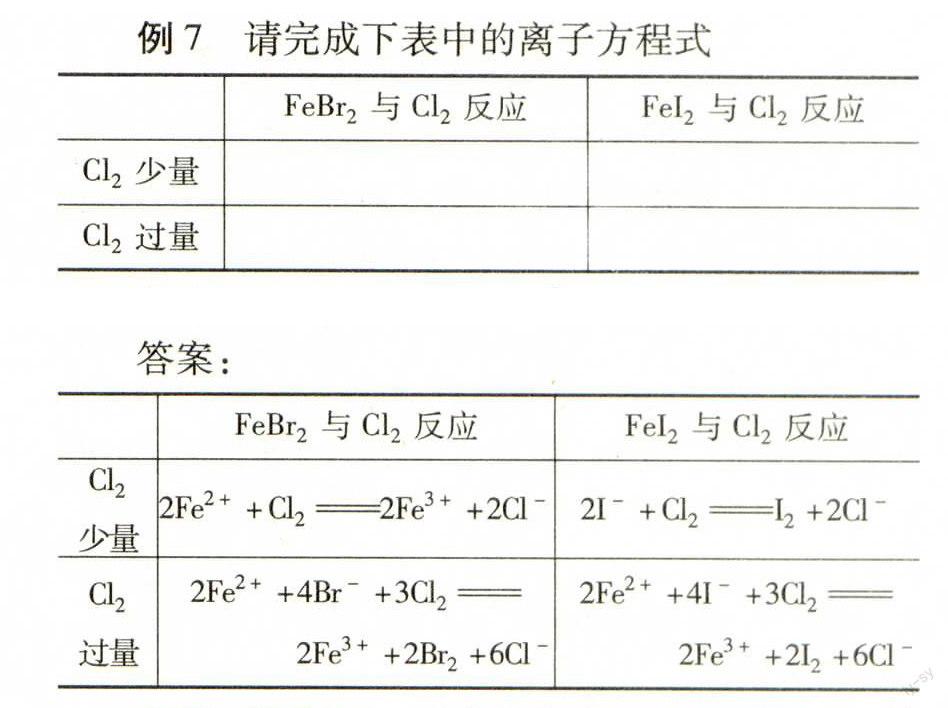
例7请完成下表中的离子方程式
FeBr2与Cl2反应FeI2与Cl2反应
Cl2少量
Cl2过量
解析还原性:I->Fe2+>Br-,按“先后原则”,在FeBr2中通Cl2,Cl2先氧化Fe2+,后氧化Br-.当Cl2少量时,只能氧化Fe2+,离子方程式为:2Fe2++Cl22Fe3++2Cl-;当Cl2过量时,Fe2+、Br-都全部被氧化,设FeBr2有1 mol,1 mol Fe2+和2 mol Br-总共失3 mol e-,能与1.5 mol Cl2反应,所以离子方程式为Fe2++2Br-+1.5 Cl22Fe3++Br2 +3Cl-,再化简即可.在FeI2中通Cl2情况类似,只不过还原性I->Fe2+,Cl2先氧化I-,后氧化Fe2+.
答案:
FeBr2与Cl2反应FeI2与Cl2反应
Cl2少量2Fe2++Cl22Fe3++2Cl-2I-+Cl2I2+2Cl-
Cl2过量2Fe2+ +4Br-+3Cl2
2Fe3++2Br2+6Cl-
2Fe2+ +4I-+3Cl2
2Fe3++2I2+6Cl-
拓展:书写0.1 mol/L FeI2与0.12 mol/L Br2等体积混合的离子方程式.
解析设FeI2有1 mol,Br2有1.2 mol,FeI2电离成1 mol Fe2+和2 mol I-,发生的反应为:2I-+Br2I2+2Br-,0.2Br2+0.4Fe2+0.4Fe3++0.4Br-,两式相加得:0.4Fe2++2I-+1.2Br20.4Fe3++I2+2.4Br-,再将系数化简可得反应的离子方程式为:2Fe2++10I-+6Br22Fe3++5I2+12Br-.
例8书写FeCl2与Na2O2等物质的量反应的离子方程式.
解析设FeCl2和Na2O2都有1 mol.1 mol Fe2+失1 mol e-,1 mol Na2O2若全部做氧化剂得2 mol e-,说明Na2O2既做氧化剂,又做还原剂.设做氧化剂的Na2O2为x mol,做还原剂的Na2O2为(1-x)mol,根据电子守恒:1+2(1-x)=2x,解得x=0.75,所以做还原剂的Na2O2为0.25 mol,生成的O2也为0.25 mol,再用H2O来满足质量守恒,可得:Fe2+ +Na2O2+1.5H2OFe(OH)3↓+2Na++0.25O2↑,化简得到离子方程式:4Fe2+ +4Na2O2+6H2O4Fe(OH)3↓+8Na++O2↑.
(收稿日期:2014-05-03)
