碱金属高考题分类例析
2015-05-30马亚楼赵小娟
马亚楼 赵小娟
碱金属是高中元素化合物的重要组成部分,其化学性质活泼、钠及其化合物用途广泛,因而受到高考命题者的青睐.现就其常见高考题型分类例析,以期对读者有所帮助.
一、以钠及其化合物为载体考查离子共存
例1(全国高考题)在溶液中加入中量Na2O2后仍能大量共存的离子组是().
A.NH+4、Ba2+、Cl-、NO-3 B.K+、AlO-2、Cl-、SO2-4
C.Ca2+、Mg2+、NO-3、HCO-3
D.Na+、Cl-、CO2-3、SO2-3
解析由于过氧化钠具有强的氧化性,其溶于水后,与水发生化学反应生成氢氧化钠,因此凡具有还原性的离子以及能与OH-反应的离子都不能大量共存.A项中NH+4+OH-NH3·H2O,NH+4不能大量共存,故A项错误;B项,各种离子都不与过氧化钠反应,也不与氢氧化钠反应,能大量共存,B项正确.C项Mg2++2OH-Mg(OH)2,Ca2++2OH-Ca(OH)2,HCO-3+OH-CO2-3+H2O,C项错误; D.项SO2-3具有还原性,能与过氧化钠发生氧化还原反应, D.错误.此题选(B)
二、以钠及其化合物为载体考查物质的性质
例2(2014·上海卷)下列试剂不会因为空气中的氧气而变质的是().
A.过氧化钠 B.氢硫酸
C.硫酸亚铁 D.苯酚
解析该题主要考查了物质的性质,由于过氧化钠和空气中的二氧化碳、水蒸气反应而变质(2Na2O2+2CO22Na2CO3+O2、2Na2O2+2H2O4NaOH+O2↑),与氧气无任何关系,故A正确;氢硫酸易被空气中的氧气氧化而变质(2H2S+O22S↓+2H2O),所以B不正确;硫酸亚铁中的铁元素是+2价,易被空气中的氧气氧化生成+3价而变质,因此C不选;苯酚中的酚羟基易被空气中的氧气氧化而显紫色,D也不正确.
答案:A
例3(2011北京高考题)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是().
A.取a克混合物充分加热,最终剩b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
解析该题借助与钠及其化合物,实质考查了物质的有关性质.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3的质量分数,故A正确;Na2CO3和NaHCO3均可与盐酸反应生成氯化钠、水和二氧化碳,所以b g固体是氯化钠,利用守恒法可计算出Na2 CO3质量分数,B也正确;混合物与足量稀硫酸充分反应,也会生成水和二氧化碳,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,因此选项C不能测出混合物中Na2CO3质量分数;Na2CO3和NaHCO3都与Ba(OH)2反应,反应的离子方程式为CO2-3+Ba
2+BaCO3↓、HCO-3+OH-+Ba2+H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,选项D也正确.
答案:C
三、以钠及其化合物为载体考查化学计算
例4(2013四川卷)1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀.下列说法不正确的是( ).
A.该合金中铜与镁的物质的量之比是2∶1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
解析A. 设混合物中Cu为x g, Mg为y g. 则
x+y=1.52①x64×98+y24×58=2.54②
解得:n(Cu)=0.02 mol,n(Mg)=0.01 mol
B. c(HNO3)=1000ρ/M
=1000×1.40×0.63/63=14.0(mol/L )
C. 根据电荷守恒:n(NO2)+(0.05-n(NO2)×2=2.54 g-1.52 g17 g/mol=0.06 mol,得
n(NO2)=0.04 mol,n(N2O4)=0.01 mol,可知C正确.
D. 与硝酸反应的NaOH:n(NaOH)=0.7-
0.04-0.02=0.64 ,与金属离子反应的NaOH的物质的量 : n(NaOH)=0.06 总NaOH的物质的量n总=0.64+0.06=0.7 mol,故需要NaOH 700 mL
答案:D
例5(2013上海卷)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO2-4)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为().
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
解析由题意,依据铜守恒可知CuS与Cu2S中含有n(Cu)=12.0g/80 g·mol-1=0.15 mol,利用
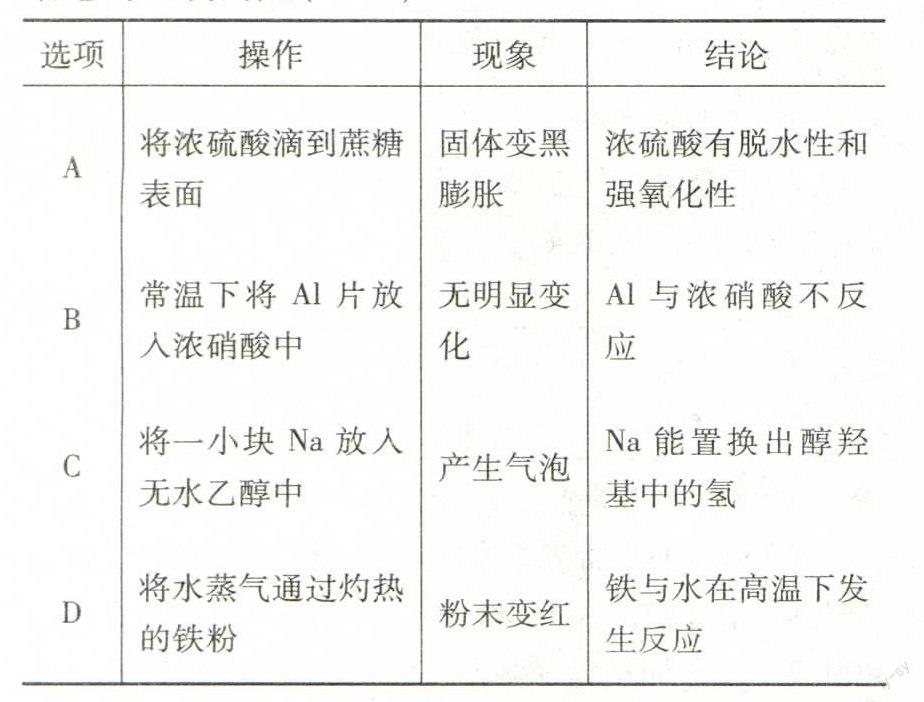
“极端假设法”,当混合物全部为CuS时,转移电子数为8,可得:0.15 mol×8=n(NO)×3+n(NO2) ×1,因n(NO)=n(NO2),解之得n(NO)=n(NO2)=0.3 mol,则反应所得混合气体在标况下的体积V=(0.3 mol+0.3 mol)×22.4 mol·L-1=13.44 L;当混合物全部为Cu2S时可得:10×0.15 mol/2=n(NO)×3+n(NO2) ×1,因n(NO)=n(NO2),解之得n(NO)=n(NO2)=0.1875 mol,则反应所得混合气体在标况下的体积V=(0.1875 mol+0.1875 mol)×22.4mol·L-1=8.4 L,所以收集到气体体积:8.4 L 答案:A 例6(2013年上海卷)碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等.工业上用纯碱溶液碳酸化制取碳酸氢钠. (1)某碳酸氢钠样品中含有少量氯化钠.称取该样品,用0.1000 mol/L盐酸滴定,耗用盐酸20.00 mL.若改用0.05618 mol/L硫酸滴定,需用硫酸 mL(保留两位小数). (2)某溶液组成如表1: 表1 化合物Na2CO3NaHCO3NaCl 质量(kg)814.8400.397.3 问该溶液通入二氧化碳,析出碳酸氢钠晶体.取出晶体后溶液组成如表2: 表2 化合物Na2CO3NaHCO3NaCl 质量(kg)137.7428.897.3 计算析出的碳酸氢纳晶体的质量(保留1位小数). (3)将组成如表2的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8 kg降为400.3 kg,补加适量碳酸纳,使溶液组成回到表1状态.计算补加的碳酸纳质量(保留1位小数). (4)某种由碳酸钠和碳酸氢钠组成的晶体452 kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504 kg.通过计算确定该晶体的化学式. 解析(1)利用消耗盐酸的量求出样品中含有碳酸氢钠的量,即可求出需耗硫酸的体积.由关系式:2NaHCO3~2HCl~H2SO4可知V消耗(H2SO4)=[(0.1000 mol/L×0.020 L)÷2]/0.05618mol·L-1=17.80 mL.(2)通入CO2后,碳酸钠生成碳酸氢钠晶体的质量m新生成(NaHCO3)=[(814.8×103 g-137.7×103g)/106 g·mol-1]×168 g·mol-1=1073.1 kg,故析出NaHCO3的质量为:1073.1 kg+400.3 kg-428.8 kg=1044.6 kg.(3)受热时NaHCO3分解生成的Na2CO3的质量为[(428.8×103g-400.3×103g)/168 g·mol-1]×106 g·mol-1=18.0 kg,因此需要加入m(Na2CO3)=814.8 kg-137.7 kg-18.0 kg=659.1 kg.(4)设该晶体的化学式为xNa2CO3·yNaHCO3·zH2O,452 kg晶体中含有n(Na2CO3)=(44.8×103L)/22.4 L·mol-1= 2000 mol,则452 kg晶体中含有n(NaHCO3)=[(504×103g)/84g·mol-1]-2000 mol×2= 2000 mol,452 kg晶体中含有n(H2O)=(452×103g-2000 mol×106 g·mol-1-2000 mol×84 g·mol-1)/18 g·mol-1=4000,即x∶y∶z=1∶1∶2,故晶体的化学式为:Na2CO3·NaHCO3·2H2O. 答案:(1)17.80 (2)1044.6 (3)659.1 (4)Na2CO3·NaHCO3·2H2O 四、以钠及其化合物为载体考查化学实验 例7(2013广东卷)下列实验的现象与对应结论均正确的是(). 选项 操作现象结论 A将浓硫酸滴到蔗糖表面固体变黑膨胀浓硫酸有脱水性和强氧化性 B常温下将Al片放入浓硝酸中无明显变化Al与浓硝酸不反应 C将一小块Na放入无水乙醇中产生气泡Na能置换出醇羟基中的氢 D将水蒸气通过灼热的铁粉粉末变红铁与水在高温下发生反应 解析该题借助于金属,考查了化学实验的现象及结论的知识.由将浓硫酸滴到蔗糖表面,浓硫酸因脱水性使蔗糖脱水炭化,浓硫酸因强氧化性与碳反应生成二氧化碳和二氧化硫气体,可知蔗糖固体变黑膨胀,A正确;Al放入浓硝酸,因浓硝酸具有强氧化性使Al钝化,阻碍反应继续进行,B错误;Na放入无水乙醇中,会与活泼性较强的羟基反应,置换出氢气,C正确;铁与水蒸气在高温下反应生成黑色的四氧化三铁和氢气,D错误. 答案:AC 例8(2013·江苏化学)下列依据相关实验得出的结论正确的是(). A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 D.向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ 解析本题属于常规实验与基本实验考查相结合.A选项不能排除碳酸氢盐与SO2-3、HSO-3形成的盐的干扰,B选项中这里焰色反应火焰呈黄色也可能是钠的单质或钠的其他化合物,C.其他还原气体或钠的碱等都可使溴水褪色.D.Fe2+检验方法及过程均合理.
答案:D.
五、以钠及其化合物为载体考查无机推断
例9(2013·天津化学)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
.
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式).
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
ACDB(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式;D的电子式.
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为.
由A转化为B的离子方程式.
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因.A、B浓度均为0.1 mol/L的混合溶液中,离子浓度由大到小的顺序是;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
解析该题以元素周期律和周期表为基础知识,考查元素推断、重要元素化合物的性质、化学用语、电解质溶液中离子浓度大小比较等重要知识.
根据短周期元素X、Y元素的X、Y两元素最高正价与最低负价之和均为0;推知X、Y元素分别为H和C,Q与X同主族推知Q为Na元素,Z、R分别是地壳中含量最高的非金属元素和金属元素,推知Z为O元素,R为Al元素.
(1)原子半径大小顺序为Na>Al>C>O>H
(2)C和H形成的物质是有机化合物,含极性键又含非极性键,分子质量最小的只能是C2H2
(3)C溶于水显酸性的气体只能是CO2,D是淡黄色固体,只能是过氧化钠,C的结构式为:O=C=O,D的电子式Na+[∶O····∶O····∶]Na+.
①B为两性不溶物,A、B均由三种元素组成,根据转化关系A为NaAlO2,
B为Al(OH)3由A转化为B的离子方程式AlO-2+2H2O+CO2Al(OH)3+HCO-3或
2AlO-2+3H2O+CO22Al(OH)3+CO2-3;②A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,A是Na2CO3,B是NaHCO3.A显碱性的原因是CO2-3的水解.水解的离子方程式为CO2-3+H2OHCO-3+OH-,二者等浓度的混合溶液中,离子浓度的大小顺序为c(Na+)>c(HCO-3)
