透骨消痛胶囊干预兔膝骨关节炎蛋白多糖与MMP—2、MMP—13表达的实验研究
2015-05-30陈赛楠等
陈赛楠等


【摘 要】目的:通过透骨消痛胶囊对兔膝骨关节炎软骨基质多糖与基质金属蛋白酶(MMP)-2、MMP-13表达影响的实验研究,进一步探讨该药保护骨关节炎软骨基质的作用机制。方法:将72只新西兰大白兔随机分为空白对照组,模型对照组,奥泰灵组,透骨消痛胶囊低、中、高剂量组,每组12只。除空白对照组外,其余各组均采用改良Hulth法造模,造模后5周给予药物治疗,灌胃8周。甲苯胺蓝染色、AB-PAS染色观察软骨蛋白多糖的表达,Western Blot检测MMP-2、MMP-13的表达。结果:与空白对照组比较,模型对照组甲苯胺蓝染色、AB-PAS染色显著减弱,MMP-2、MMP-13表达显著升高。与模型对照组比较,透骨消痛胶囊组甲苯胺蓝染色、AB-PAS染色均匀深染,MMP-2、MMP-13表达显著降低。结论:透骨消痛胶囊可通过下调软骨MMP-2、MMP-13表达,减缓软骨基质降解,降低软骨损伤程度,延缓骨关节炎病理进程。
【关键词】 骨关节炎,膝;透骨消痛胶囊;蛋白多糖;MMP-2;MMP-13
doi:10.3969/j.issn.2095-4174.2015.07.001
Experimental Study on Tougu Xiaotong Capsule(透骨消痛胶囊) Interfering in the
Expression of Proteoglycan,MMP-2 and MMP-13 in Rabbits with Knee Osteoarthritis
CHEN Sai-nan,HUANG Yun-mei,CHEN Wen-lie,HUANG Mei-ya,WU Guang-wen,LIN Yu,
LIN Ru-hui,LI Xi-hai,YU Chao,FENG Fang-fang,LI Xiao-dong,LIU Xian-xiang
【ABSTRACT】Objective:By study on Tougu Xiaotong Capsule (透骨消痛胶囊) interfering in the expression of proteoglycan,MMP-2 and MMP-13 in rabbits with knee osteoarthritis to further explore the action mechanism of the drug to protect cartilage matrix.Methods:72 New Zealand rabbits were randomly divided into a blank control group,a model control group,an Aotailing (Glucosamine Hydrochloride Capsules) group,and Tougu Xiaotong Capsule groups (low,medium and high dose groups).Except for the blank control group,models were established in the other groups with modified Hulth method,and treated with drugs after 5 weeks—given intragastric administration for 8 weeks.Toluidine blue staining and AB-PAS staining were used to observe the expression of cartilage proteoglycan,and Western Blot was used to detect the expression of MMP-2 and MMP-13.Results:Compared with the blank control group,Toluidine blue staining and AB-PAS staining in the model control group were significantly weakened,while the expression of MMP-2 and MMP-13 significantly increased.Compared with the model control group,Toluidine blue staining and AB-PAS staining in the Tougu Xiaotong Capsule groups were homogeneously hyperchromatic and the expressions of MMP-2 and MMP-13 were significantly decreased.Conclusion:By the down regulation of the expressions of MMP-2 and MMP-13,Tougu Xiaotong Capsule can slow down the degradation of cartilage matrix,reduce the severity of cartilage injury,and delay the pathological process of osteoarthritis.
【Keywords】 osteoarthritis,knee;Tougu Xiaotong Capsule(透骨消痛胶囊);proteoglycans;MMP-2;MMP-13
骨关节炎(osteoarthritis,OA)是常见的慢性退行性关节疾病,病理变化涉及软骨、滑膜、软骨下骨等,是多结构、全方位关节病变,其发病率与年龄呈正相关,严重影响患者生活质量[1]。软骨退变是OA最基本的变化,其损伤将进一步促进软骨下骨结构破坏,在病程中占核心地位。
软骨基质的合成与分解代谢的失衡,在OA软骨变性损伤中起重要作用[2]。基质金属蛋白酶(matrix metalloproteinase,MMPs)属锌离子依赖性的内切蛋白水解酶家族,广泛存在于各种结缔组织中,在软骨基质的正常代谢与病理降解中起重要作用[3-4];其中MMP-2可将变性的Ⅱ型胶原进一步裂解,胶原崩解、蛋白多糖降解,软骨基质破坏[5],MMP-13可直接降解软骨基质中的Ⅱ型胶原,破坏骨架结构[6-7]。因此,通过调节MMP-2、MMP-13
的表达,调控基质的降解速率,改善软骨结构,延缓OA病理进程,已成为防治热点。
透骨消痛胶囊由巴戟天、白芍、川芎、肿节风组成,治疗OA具有多靶点、多途径等特点[8],有较好的临床效果[9]。前期研究发现,该复方可抑制软骨细胞凋亡[10],促进软骨细胞增殖[11]及细胞外基质合成[12],抑制炎症因子表达[13-14],改善软骨结构与功能[15]。本实验拟通过透骨消痛胶囊治疗新西兰大白兔膝OA模型,并以盐酸氨基葡萄糖作为阳性对照药,分析其在体内对软骨蛋白多糖的保护作用及MMP-2、MMP-13表达的影响,探讨其治疗OA的相关机制。
1 实验材料
1.1 实验动物 6月龄新西兰大白兔72只,雌性,体质量(2.0±0.3)kg,购自上海斯莱克实验动物有限责任公司,动物许可证号码:SCXK(沪)2012-0011,合格证编号:2007001101785。实验动物饲养于福建中医药大学实验动物中心,使用许可证号:SYXK(闽)2009-0001,分笼饲养,自由饮水,颗粒饲料喂养。
1.2 实验药物 透骨消痛胶囊是福建中医药大学附属第二人民医院院内制剂(闽制字Z20100006),盐酸氨基葡萄糖胶囊(奥泰灵,香港澳美制药厂生产,批准文号:HC20110004,规格0.75 g)。
2 方 法
2.1 分组、造模、灌胃、取材 取新西兰大白兔72只,随机分为空白对照组,模型对照组,奥泰灵组,透骨消痛胶囊低、中、高剂量组,每组12只。除空白对照组外,其余5组均按照改良Hulth法建立OA模型,麻醉后右膝关节屈曲90 °,取内侧入路,切断内侧副韧带、前交叉韧带,摘除内侧半月板。术后1周起,强迫动物运动,每日30 min,共4周,OA模型建立。
术后第5周起,奥泰灵组给予盐酸氨基葡萄糖胶囊75 mg·kg-1·d-1灌胃;透骨消痛胶囊低、中、高剂量组分别给予透骨消痛胶囊0.93,1.86,
3.72 g·kg-1·d-1灌胃,空白对照组、模型对照组给予等量生理盐水灌胃,每日1次,持续8周。分别于灌胃后4周、8周取材,各取6只动物股骨。
2.2 甲苯胺蓝染色 取股骨内髁,4%多聚甲醛固定,10% EDTA-PBS脱钙。修切约1.2 cm×
1.2 cm×0.5 cm大小,乙醇脱水、二甲苯透明、石蜡包埋,矢状面为切面,切片4 ?m。切片脱蜡,0.5%甲苯胺蓝染液染色30 min,光镜下观察酸性蛋白多糖表达。每张切片选取5个不同视野,50倍镜下拍照,Motic Med 6.0显微图像分析系统分析甲苯胺蓝平均光密度。
2.3 AB-PAS(阿尔新蓝-过碘酸雪夫反应)染色 切片脱蜡,3%醋酸3 min,1%AB染液染色
60 min;1%过碘酸10 min;Schiff染液染色20 min;
光镜下观察酸性、中性蛋白多糖表达。每张切片选取5个不同视野,50倍镜下拍照,Motic Med 6.0显微图像分析系统分析AB、PAS平均光密度。
2.4 蛋白质印迹法(Western Blot) 取股骨外髁软骨,提取总蛋白,BCA蛋白定量。取20 ?g蛋白上样,SDS-PAGE电泳分离,蛋白转至PVDF膜,脱脂奶封闭;分别用1∶200的MMP-2或MMP-13
第一抗体、1∶8000的β-actin第一抗体,置4℃摇床上孵育过夜;TBST洗膜,分别加入相应的第二抗体,室温摇床孵育1 h;TBST洗膜,曝光显影;采用BIO-RAD Image Lab图像处理软件,分析灰度值,计算蛋白相对表达量。
2.5 统计学方法 采用SPSS 18.0软件进行统计分析。计量资料以表示,采用单因素方差分析。以P < 0.05为差异有统计学意义。
3 结 果
3.1 软骨蛋白多糖甲苯胺蓝染色观察 造模术后9周(治疗4周),空白对照组软骨中上部呈深蓝紫色,为透明软骨;下部呈浅蓝紫色,为软骨钙化层;二者之间为潮线;软骨下骨呈淡蓝色,钙化层与软骨下骨之间为粘合线,清晰可见,见图1(1)。与空白对照组比较,模型对照组染色重度减弱,呈淡蓝色,见图1(2),蛋白多糖含量显著降低
(P < 0.01);与模型对照组比较,奥泰灵组染色中重度减弱、呈浅蓝紫色,染色较均匀,见图1(3),蛋白多糖含量未见显著提升;透骨消痛胶囊低、高剂量组染色轻度减弱、染色均匀,见图1(4)、
1(6),蛋白多糖含量升高(P < 0.01);透骨消痛胶囊中剂量组染色未见丢失、呈深蓝紫色,染色均匀,见图1(5),蛋白多糖含量显著升
高(P < 0.01)。
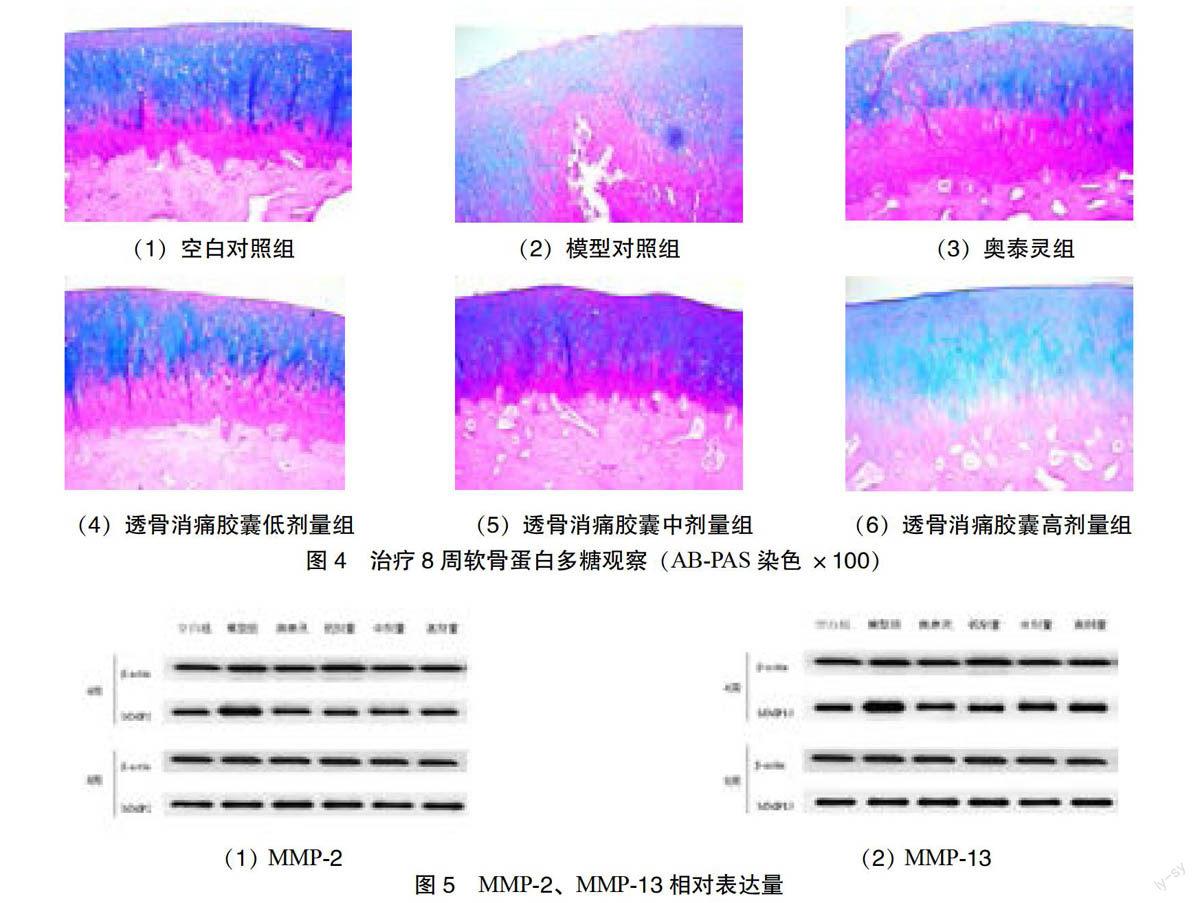
造模术后13周(治疗8周),空白对照组软骨呈浅蓝紫色,考虑实验动物自然衰老,蛋白多糖分泌减少,甲苯胺蓝染色减弱,见图2(1)。与空白对照组比较,模型对照组软骨大面积失染、不着色,见图2(2),蛋白多糖含量显著降低(P < 0.01);与模型对照组比较,奥泰灵组染色重度减弱,见图2(3),蛋白多糖含量未见提升;透骨消痛胶囊低、高剂量组浅表层染色重度减弱,辐射层呈淡紫色,见图2(4)、2(6);透骨消痛胶囊中剂量组染色呈深蓝紫色、染色均匀,且染色强于同期空白对照组,见图2(5),中剂量可促进蛋白多糖合成分泌
(P < 0.01)。甲苯胺蓝染色平均光密度见表1。
3.2 软骨蛋白多糖AB-PAS染色观察 治疗4周,空白对照组:AB将软骨浅表层染成淡紫红色、钙化层染成深紫红色,PAS将移行层、辐射层染成湖蓝色,见图3(1)、图4(1)。与空白对照组比较,模型对照组AB、PAS染色均重度减弱,浅表层、钙化层呈淡粉色,辐射层呈淡蓝色,见图3(2),
蛋白酸性多糖含量显著降低(P < 0.01),中性多糖显著降低(P < 0.05);与模型对照组比较,奥泰灵组染色中重度减弱,钙化层呈淡紫红色,移行层、钙化层呈浅蓝色,染色较均匀,见图3(3),蛋白多糖含量未见提升;透骨消痛胶囊组:染色未见明显丢失,染色均匀,见图3(4)、3(5)、3(6),蛋白多糖含量呈提升趋势,以中剂量组对酸性多糖改善效果最为显著(P < 0.05)。
治疗8周,与空白对照组比较,模型对照组辐射层、钙化层呈深紫红色,移行层呈浅湖蓝色、染色中度减弱,见图4(2),酸性多糖含量显著降
低(P < 0.05)。与模型对照组比较,奥泰灵组辐射层、钙化层呈深紫红色,移行层呈深湖蓝色,见图4(3),多糖含量未见提升;透骨消痛胶囊组:低剂量组浅表层、小部分辐射层、钙化层呈深紫红色,移行层、辐射层大部分呈深湖蓝色,见图4(4);中剂量组染色与空白对照组相似,见图4(5),多糖含量呈提升趋势(酸性多糖P < 0.01,中性多糖P < 0.05);高剂量组浅表层、钙化层呈淡紫红色,移行层、辐射层呈淡蓝色,染色中度减弱,见图4(6),多糖含量未见提升。AB-PAS染色平均光密度见表2。
3.3 MMP-2、MMP-13相对表达量 治疗4周,与空白对照组比较,模型对照组MMP-2、MMP-13
表达量显著升高(P < 0.01);与模型对照组比较,奥泰灵组、透骨消痛胶囊组MMP-2、MMP-13表达量显著降低(P < 0.01)。治疗8周,各组间未见显著变化趋势。见表3、图5。
治疗4周,与空白对照组比较,模型对照组MMP-13表达量显著升高(P < 0.01);与模型对照组比较,奥泰灵组、透骨消痛胶囊组MMP-13表达量显著降低(P < 0.01)。治疗8周,各组间未见显著变化趋势。见表3、图5。
4 讨 论
软骨组织由软骨细胞、软骨基质组成;软骨细胞是唯一细胞,主要功能是合成、分泌软骨基质;软骨基质主要由蛋白多糖、Ⅱ型胶原组成。胶原纤维构成基质网状骨架,蛋白多糖填充其中,结合透明质酸、硫酸软骨素、硫酸角质素等,形成毛刷样结构,具有良好亲水性、抗压性;两者共同维持软骨形态。软骨细胞变性坏死、基质合成降解代谢失衡,可导致OA的发生。
MMPs是降解软骨基质的主要酶系,MMPs的异常表达,引起蛋白多糖降解、胶原骨架断裂,导致软骨变性破坏,在OA病理进程中起重要作用。MMPs属内切蛋白水解酶家族,根据不同的作用底物,分5个亚型。①胶原酶:MMP-1、MMP-8、
MMP-13。②明胶酶:MMP-2、MMP-9。③基质溶解素:MMP-3、MMP-10、MMP-11。④膜型:MMP-14、MMP-15、MMP-16。⑤多相亚群:MMP-7、MMP-12、MMP-18。MMP-2降解Ⅳ、Ⅴ、Ⅵ型胶原,参与胶原骨架的破坏,可特异性降解变性的Ⅰ、Ⅱ型胶原片段,胶原崩解、蛋白多糖裂解,软骨组织弹性降低、结构破坏,进一步加速OA病程[16]。MMP-13是MMPs家族中作用底物最广,对Ⅱ型胶原的降解能力最强,可直接降解软骨基质胶原骨架,是OA早中期基质降解的关键酶[17-18]。
甲苯胺蓝是常用于蛋白多糖染色的碱性染料,可与软骨基质中酸性蛋白多糖相结合,呈蓝紫色,故本染色可用于蛋白多糖的半定量分析。AB是碱性染料,可与软骨基质中含阴离子集团的蛋白多糖结合,呈湖蓝色;PAS染色可与软骨基质中糖原结合,呈紫红色;软骨基质呈红蓝相间,清晰显示酸性、中性蛋白多糖。甲苯胺蓝染色、AB-PAS染色可显示OA病程中软骨基质蛋白多糖的分布与含量的变化。
软骨组织形态学显示,OA模型处于中后期,造模术后9周,MMP-2、MMP-13表达显著上升,甲苯胺蓝染色、AB-PAS染色重度减弱,蛋白多糖含量降低,显示基质成分降解。经药物治疗4周后,透骨消痛胶囊组MMP-2、MMP-13表达量显著降低,蛋白多糖含量增加,显示其对软骨基质良好的保护作用。造模术后13周,模型对照组MMP-2、MMP-13表达较前均下降;甲苯胺蓝染色、AB-PAS染色大面积失染,显示基质显著破坏。经药物治疗8周后,透骨消痛胶囊组MMP-2、MMP-13表达未见显著变化,甲苯胺蓝染色、AB-PAS染色深于模型对照组,以中剂量组最为显著,且优于奥泰灵组,显示中剂量可促进软骨基质合成分泌,较好地维持软骨结构。
综上所述,透骨消痛胶囊治疗OA,可通过下调MMP-2、MMP-13表达以调控蛋白多糖、胶原等基质成分的降解速率,维持软骨基质的形态,减缓软骨变性损伤程度,改善软骨形态,这可能是该药对OA软骨的保护机制之一。
5 参考文献
[1] 中华中医药学会.骨性关节炎[J].风湿病与关节炎,2013,2(2):71-72.
[2] Hunter DJ.Imaging insights on the epidemiology and pathophysiology of osteoarthritis[J].Rheum Dis Clin North Am,2009,35(3):447-463.
[3] Haseeb A,Haqqi TM.Immuopathogenesis of osteoarthritis[J].Chin Lmmunol,2013,146(3):185-196.
[4] Meszaros E,Malemud CJ.Prospects for treating osteoarthritis:enzyme-protein interactions regulating matrix metalloproteinase activity[J].Ther Adv Chronic Dis,2012,3(5):219-229.
[5] Fiorentini C,Bodei S,Bedussi F,et al.GPNMB/OA protein increases the invasiveness of human metastatic prostate cancer cell lines DU145 and PC3 through MMP-2 and MMP-9 activity[J].Exp Cell Res,2014,323(1):100-111.
(下转第60页)
(上接第10页)
[6] Niebler S,Schubert T,Hunziker EB,et al.Activating enhancer-binding protein-2 epsilon (AP-2ε)-deficient mice reveal an increased matrix metalloproteinase 13 expression and a progressive osteoarthritis devel-
opment[J].Arthritis Res Ther,2015,17(1):119.
[7] Zhang D,Zhou Y.The protective effects of Donepezil (DP) against cartilage matrix destruction induced by TNF-α[J].Biochem Biophys Res Commun,2014,454(1):115-118.
[8] Zheng CS,Ye HZ,Xu XJ,et al.Computational Pharmacology study of tougu xiaotong granule inPreventing and treating knee osteoarthritis[J].Chin J Integr Med,2009,15(5):371-376.
[9] 林木楠.透骨消痛方治疗膝骨性关节炎30例[J].福州总医院学报,2009,16(3):242.
[10] 吴追乐,李西海,吴广文,等.透骨消痛胶囊含药血清对软骨细胞线粒体凋亡通路的影响[J].中华中医药杂志,2011,26(2):343-346.
[11] 叶蕻芝,李西海,陈加守,等.透骨消痛胶囊含药血清对软骨细胞Cyclin D1 mRNA表达的影响[J].中医正骨,2012,24(7):3-7.
[12] 吴广文,叶锦霞,郑春松,等.骨性关节炎模型大鼠关节软骨变化及透骨消痛胶囊干预的作用[J].中国组织工程研究,2014,18(49):7924-7929.
[13] 吴广文,叶锦霞,许惠凤,等.透骨消痛胶囊对KOA大鼠关节软骨uPA系统相关调节因子的影响[J].世界中西医结合杂志,2015,10(1):22-26,55.
[14] 肖晓金,包侠萍,陈文列,等.透骨消痛胶囊对兔膝骨关节炎模型血清与关节液炎症因子的影响[J].风湿病与关节炎,2013,2(11):35-38.
[15] 黄云梅,陈文列,刘献祥,等.透骨消痛颗粒对骨性关节炎影响的组织化学研究[J].中国中医骨伤科杂志,2011,19(1):1-3.
[16] Lipari L,Gerbino A.Expression of gelatinases (MMP-2,
MMP-9) in human articular cartilage[J].Int J Immunopathol Pharmacol,2013,26(3):817-823.
[17] Loeuille D,Chary-Valckenaere I,Champigneulle J,et al.
Macroscopic and microscopic features of synovial membrane inflammation in the osteoarthritic knee:correlating magnetic resonance imaging findings with disease severit[J].Arthritis Rheum,2005,52(11):
3492-3501.
[18] Dorothea P,Jürgen W,Heike K,et al.Novel selective MMP-13 inhibitors reduce collagen degradation in bovine articular and human osteoarthritis cartilage explants[J].Inflamm Res,2010,59(5):379-389.
收稿日期:2015-05-23;修回日期:2015-06-19
