灵芝木质素降解酶研究及其潜在应用进展
2015-05-30王庆福黄清铧梁磊李奇伟安玉兴
王庆福 黄清铧 梁磊 李奇伟 安玉兴


摘 要 灵芝不仅具有很好的药理活性,而且具有高效降解木质素的潜在特性。为进一步了解灵芝木质素降解酶作用机制及其表达调控,促进灵芝木质素降解酶研究和相关产业发展,分别对木质素降解酶组成和生物降解机制、灵芝木质素降解酶表达调控以及灵芝木质素降解酶潜在应用前景进行评述,并针对灵芝降解木质纤维素过程研究中存在的问题提出相关研究建议。
关键词 灵芝;木质素降解酶;生物降解;作用机制
中图分类号 S567.31 文献标识码 A
Abstract Ganoderma is famous for its good pharmacological activities and has valuable features of to decompose lignin. The biodegradation mechanism, types of ligninolytic enzymes from the genus Ganoderma, the expression regulation of the lignin modifying enzymes, as well as the potential applications of these enzymes are summarized in this article. This review would provide an insight in the current issues and research direction of Ganoderma spp. in the process of lignocellulose degradation.
Key words Ganoderma spp.; Ligninolytic enzymes; Biodegradation; Mechanism of action
doi 10.3969/j.issn.1000-2561.2015.07.029
木质素主要存在于木材和秸秆中,是农林产业的主要副产物,每年全世界产量约1 500亿t,是储量巨大的潜在绿色资源,然而这类副产物利用率只有11%左右,主要是作为造纸工业原料、直接燃烧或掩埋,甚至直接废弃,不仅造成资源的巨大浪费,同时也造成环境的污染。木质素是由苯丙烷单元形成的三维网状结构组成的无定型聚合物,木质素难于降解正是由于木质素本身这些复杂的不规则的结构,木质素共有3种基本结构:愈创木基丙烷、紫丁香基丙烷和对羟苯基丙烷,这些结构主体之间主要通过醚键和碳碳键联结[1]。自然界中,木质素与半纤维素以共价健形式结合,将纤维素分子包埋在其中,形成一种天然屏障,导致了这类生物质的难降解和利用率低。传统的木质素的去除方法大多采用物理方法和化学分解法,不但造成纤维素理化性能改变、成本高,而且木质素的去除率低还污染环境[2-3]。因此利用微生物进行木质素生物降解成为生物质资源绿色分离和开发利用的热点问题。
白腐菌是自然界中最主要的木质素降解菌,其降解过程主要依赖胞外木质素降解酶系[4-5],白腐菌首先降解木质纤维素中的木质素,同时能够较好的保持纤维素结构不被破坏[6],并且在降解木质素时不产生色素,被认为是目前最理想的一类木质素降解真菌。灵芝(Ganoderma spp)为真菌界(Fungi)担子菌门(Basidomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)灵芝科(Ganodermataceae)灵芝属(Ganoderma)[7],数千年一直都作为药用菌来研究,因其具有多方面的治疗作用被世人广为称颂[8-9],灵芝也是主要的白腐菌,具有高效降解木质纤维素和其他潜在特性[10-12],灵芝木质素降解酶应用的核心在于调控木质素降解酶表达,因此笔者从木质素降解酶种类和作用机制、灵芝木质素降解酶表达调控及其应用进行综述,以期为灵芝木质素降解酶深入研究和开发利用提供参考。
1 木质素降解酶种类和作用机制
真菌是生态系统中主要的分解者,具有降解木质纤维素的能力,其木质素降解酶系主要包括木质素过氧化物酶(LiPs)、锰过氧化物酶(MnPs)、漆酶(Laccases)以及产生一些过氧化氢的氧化酶[13]。表1是真菌主要参与木质素降解的相关酶。
1.1 过氧化物酶
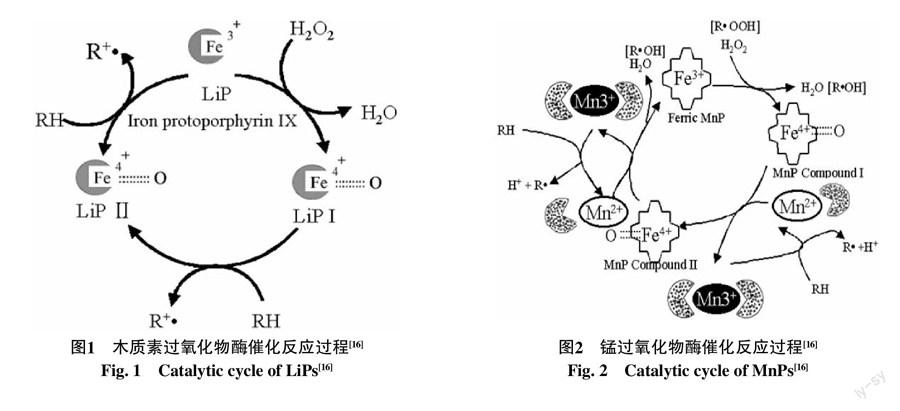
灵芝降解木质素的过氧化物酶类主要包括木质素过氧化物酶(LiPs)和锰过氧化物酶(MnPs)[13-14],LiPs属于胞外酶,是被发现最早的木质素降解相关酶,分子量在38~43 ku左右,与MnPs类似,LiPs带有糖基的胞外血红素蛋白,又称血红素过氧化物酶。LiPs催化过程如图1所示,催化反应依赖于过氧化氢,在氧气和低浓度过氧化氢存在的条件下,能够催化木质素结构单元中的苯环发生单电子氧化反应形成苯氧自由基,随后通过甲氧基的脱除、侧链上Cα-Cβ、Cβ-Cγ及烷基芳基醚键的断裂等一系列非酶催化的自由基反应[15],从而使苯环裂解,这一过程中,LiPs被过氧化氢氧化而丢失两个电子,形成带有Fe4+的LiPs化合物Ⅰ铁-氧-卟啉环自由基,然后进行两步对芳香底物的单电子的氧化作用而重新回到初始状态[16]。MnPs分子量在38~62.5 ku左右。MnPs有多种同工酶,这类同工酶具有不同的等电点,最适pH值一般在3~4左右,最适酶促反应温度为30~40 ℃。MnPs与LiPs类似的,如图2所示,在反应过程中都需要过氧化氢启动,形成过氧化铁复合体,然后复合体氧氧双键断裂并从亚铁血红素上转移2个电子形成化合物Ⅰ并释放一分子H2O,通过螯合Mn2+,再释放Mn3+,从而获得一个电子,形成化合物Ⅱ,然后Mn2+被化合物Ⅱ氧化,释放出MnPs并形成另一个H2O[17]。由于MnPs的氧化还原电位较低,只能氧化酚型结构的木质素,而LiPs具有非常高的氧化还原电势,是迄今为止发现的唯一一种可以单独氧化降解非酚型木质素结构的过氧化物酶[18]。
1.2 漆酶
漆酶是一种含Cu2+的蓝色多酚氧化酶,分子量在60~80 ku之间,是糖基化的,其中含有15%~20%的碳水化合物[19]。漆酶催化反应是一种多铜反应,根据光谱特性,可将漆酶分子分成3类,分别为1个Ⅰ型(T1)铜(Cu+)、1个Ⅱ型(T2)和2个Ⅲ型(T3)铜(Cu2+和Cu3+)。由于漆酶氧化还原电位低,一般只能降解酚型木质素模型化合物。漆酶的催化过程如图3所示[20],催化反应过程包括4个连续的单电子氧化作用,其中Ⅰ型(T1)铜结合2个组氨酸残基和一个半胱氨酸,将底物氧化并提供氧化还原电势,显蓝色,在610 nm处有特征吸收峰;Ⅱ型(T2)铜结合2个组氨酸和2个Ⅲ型(T3)铜,每个结合3个组氨酸形成一个三核中心(TNC)[21],这是最后的电子受体。Ⅱ型(T2)在可见光区没有吸收峰,Ⅲ型(T3)铜在330 nm处有特征吸收峰。漆酶催化反应包括4个连续的单电子氧化酚型底物的氧化还原反应,将酚环氧化形成以氧为中心的苯氧基团,再通过非酶催化的自由基链式反应裂解,从而导致芳基与α碳原子之间的化学键断裂,再经过氧化还原反应将电子转移到分子氧中形成水分子,而酶回到初始状态。漆酶还参与了木质素芳香环脱甲氧基以及木质素单体的聚合和解聚等生物反应过程,是参与灵芝木质素生物降解的重要酶类。
2 灵芝木质素降解酶表达调控
近年来,灵芝木质纤维素降解酶的研究备受关注,其在工业领域的应用前景也逐步体现出来,然而在规模化生产应用过程中,成本问题成为制约产业发展的首要问题[22],因此如何提高灵芝木质素降解相关酶产量成为相关领域的核心问题,而培养条件、菌株差异和诱导物添加等条件是影响灵芝分泌木质素降解酶种类和产量的主要因素。
2.1 灵芝木质降解酶培养基质调节
灵芝木质素降解酶培养基质调控主要是通过调控影响灵芝木质素降解酶合成的菌种、碳源、氮源等因素,从而促进木质素降解酶表达[23-24]。Adaskaveg等[25]研究了来源不同的6株灵芝菌株木质素降解能力发现,不同灵芝菌株分泌的木质素降解酶存在差异,这与笔者前期研究结果一致,因此进行灵芝木质素降解优良菌种选育有助于提高灵芝木质素降解酶产量。Sasidhara[26]通过液态发酵酶活实验发现野生灵芝具有更强的木质素降解酶活力,由此为液态发酵生产灵芝木质素降解酶提供了新的思路。灵芝降解木质纤维素具有选择性,其针对不同的培养基质产生的木质素降解酶类型和活力各不相同,Asgher等[27]利用麦秸、稻草秸秆、香蕉花柄、甘蔗渣、玉米芯和玉米秸秆等为培养基,探索灵芝木质素降解酶表达情况,结果表明:木质纤维素的类型差异和组成会影响灵芝木质纤降解酶的分泌,所有实验培养基均能产生Lac、MnP和LiP三种酶,但3种酶活力存在差异。Trevo[28]通过研究不同培养条件灵芝木质素降解酶表达实验发现,在培养基高氮条件(24 mmol/L)下漆酶产生量远大于低氮(2.4 mmol/L)条件;Stajic[29]研究显示NH4NO3是灵芝产漆酶和锰过氧化物酶的最佳氮源,但是灵芝产总过氧化物酶的最佳氮源是蛋白胨。Mehboob[30]发现以玉米芯进行灵芝固态发酵能够增强灵芝产木质素过氧化物酶能力,实验结果显示,在pH值4.5、温度35 ℃、酵母提取物4%、 (NH4)2SO4 2%、甘蔗糖蜜3%、含水量80%和发酵96 h时LiPs活力达到最大,酶活为2 807 U/mL。有研究发现白腐菌木质素过氧化物酶在复杂有机氮源(如酵母浸汁和牛肉膏等)培养基中酶活力更高,而(NH4)2C4H4O6、L-谷氨酸、(NH4)2SO4和NH4NO3等也是有利于白腐菌木质素降解酶的合成主要氮源[31]。王茂成等[32]指出灵芝具有良好的木质素降解能力,适合的培养基质配比有利于增强木质素降解酶活力,实验结果显示灵芝产木质素降解酶最佳碳氮比为15 ∶ 1,其中木质素过氧化物酶、漆酶和锰过氧化物酶分别达到234.2 U、614.3 U和174.6 U,并推断培养基氮素含量是影响灵芝木质素降解酶表达的重要因素。
2.2 木质素降解酶诱导调控
诱导调控主要是在灵芝培养过程中调控木质素和木质素衍生的各种芳香族化合物[33]、金属元素[34]和其他诱导因子添加,从而促进灵芝木质素降解酶表达,作为木质素降解酶调控的新领域,诱导调控已成为研究的又一热点。Ryu等[35]通过添加邻苯二甲酸二丁酯和木屑调控分离的6个锰过氧化物酶基因片段表达,实验结果显示,两种方法均能显著提高片段4表达,片段5只能通过添加邻苯二甲酸二丁酯提高酶基因表达,片段6诱导表达只能通过添加木屑诱导,通过添加不同诱导物调控MnP基因能够显著提高机体MnP酶活力。据有关报道,调控漆酶和过氧化物酶异源和同源表达能够促进漆酶和过氧化物酶表达[36]。Sun等[37]通过研究灵芝漆酶基因GlLCC1表达时发现K+、Na+、Cu2+、Mg2+能够强力激活灵芝漆酶基因,增强漆酶表达活性,其中10 mmol/L K+、Na+提高漆酶活性分别为159.71%和171.79%,而Fe2+、Fe3+、Al3+、Zn2+等金属离子则会降低漆酶催化能力。姚强[38]通过研究筛选的产漆酶菌株产酶条件诱导发现Cu2+在一定浓度范围内能够促进灵芝菌株产生漆酶,当Cu2+浓度为1.0 mmol/L时,漆酶的酶活力达到最大,而真菌诱导因子在一定范围内同样能够显著增强灵芝漆酶的生产,低浓度真菌诱导因子时随着浓度的升高,灵芝漆酶的酶活性也逐渐提高,当浓度达到120 μg/mL时,灵芝漆酶酶活达到最高。Batol[39]以灵芝IBL-05为出发菌株固态发酵小麦秸秆,通过调节碳氮比、温湿、pH值和添加适量Zn2+、4-MMA固态发酵增强了灵芝Lips酶活力,而添加吐温80、吐温20和SDS等表面活性剂则会降低灵芝Lips酶活力。陈岳文[40]通过将150 μmol/L的Cu2+加入到灵芝菌株培养基中,发现Cu2+能够诱导调控漆酶同工酶表达, 随着培养时间增长漆酶酶活逐渐增强,在第12天时被诱导上调4.00倍,基因转录表达分析发现在Cu2+加入后Laccl、Lacc2、Lacc3、Lacc6、Lacc9基因相比于其他基因表达量显著上调, Lacc4和Lacc10则在不同生长阶段几乎不受Cu2+的诱导调控,且它们的上游启动子中均含有金属响应元件,由此推断这些基因中可能存在金属响应途径,但是基因上游启动子区域的金属相应原件数量与金属离子诱导基因表达作用的强弱并无直接关系,通过比较试验研究发现Lacc8与灵芝胞外漆酶的表达有极大的关联。
综上所述,通过添加菌种选育、培养条件优化和诱导因子添加等方法调控灵芝木质素降解酶表达,进而调控灵芝对基质的降解,这为生物质基原料生物转化提供理论和现实依据,应用前景广泛。
3 灵芝木质素降解酶应用
灵芝木质素降解酶成功应用于生产实践尚未见报道,但其在造纸、环境、饲料、肥料等工业领域的研究已经显现出诱人的前景。木质素降解酶可应用于生物化学制浆、纸浆生物漂白、造纸废水生物处理等过程;据报道,在含有没食子酸的体系中,利用漆酶处理牛皮纸浆,其纸浆耐破指数提高了34%,干裂断长和湿裂断长分别提高了20%和72%[41];利用漆酶-1-羟基苯并三唑体系漂白高品质亚麻纸浆,纸浆卡伯值下降了85%左右,其纸浆白度提高了40%[42];Shweta等[43]研究发现白腐菌在没有添加营养物质的基础上能显著降低手工造纸工业废水生态毒性参数至安全范围,在工业废水处理方面应用前景良好;目前灵芝木质素降解酶在降解木质素结构类似环境污染物已有相关报道,Revankar等[44]利用灵芝处理含有2%淀粉和0.125%酵母提取物的100 mg/L的苋菜红染料废液,在作用8 h后的染料废液脱色率达到96%;Rigas等[45]利用灵芝菌对农用杀虫剂六氯环己烷污染的土壤进行生物修复;木质素降解酶在除草剂降解[46]和污水处理[47-48]方面应用也有良好的效果。Sitarz[49]研究发现,相比研究的其他白腐菌,灵芝在添加甘蔗渣等木质纤维素的基础培养基上生长旺盛,具有很强的漆酶活力,且在添加纤维素酶制剂进行木质纤维素生物质预处理时能显著增加纤维素产量,这一特性在木质纤维生物转化上有广阔的应用前景。在饲料、肥料工业中,利用灵芝或灵芝木质素降解酶的生物处理农作物秸秆,可明显增加粗蛋白含量、提高动物对秸秆的消化率,且安全性好,对动物的生长有明显的促进作用,具有很高的商业价值[50-51]。Shrivastava等[52]通过灵芝固态发酵小麦秸秆发现,发酵15 d酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)、半纤维素、木质素和纤维素含量显著降低,动物实验表明喂食灵芝固态发酵饲料实验组山羊干物质摄入(DMI)、可消化粗蛋白(DCP)和总的可消化营养摄入(TDN)则显著增加。Ke等[53]通过灵芝和酵母共培养发现,对比单一菌发酵,共培养蛋白含量显著增加,且木质素过氧化物酶、锰过氧化物酶和漆酶活力也得到增强。同时,由于灵芝菌丝体本身含有的有效成分能够提升生命机体免疫力,因此利用灵芝菌糠制备饲料或饲料添加剂有很大的经济和社会效益[54];笔者团队利用蔗渣栽培灵芝所得菌糠进行功能饲料制备,实验结果显示所得饲料蛋白含量大于15%,而且富含灵芝多糖和灵芝三萜,其中灵芝三萜含量大于2.5 mg/g,在饲料加工领域应用前景良好,笔者团队还开展菌糠胺化改性制备功能性材料等相关研究,其中丙烯酰胺接枝率在200%以上。有研究发现,栽培灵芝菌剩余的菌糠中,N、P、K等三大营养元素以及Mg、Fe、Mn和Zn等微量元素的含量均明显提高,是理想的生物肥料原料[55];海南农垦利用芝-胶间作模式,实现了多物种良性循环[56],不仅经济节约,又保护环境。在食品发酵工业,漆酶用于去除啤酒、葡萄酒、果汁中含有的酚和芳胺类物质,可提高饮料的澄清度与储藏性[57]。
4 小结与展望
灵芝具有很强的木质纤维素降解能力,同时也具有丰富的保健功效。目前随着相关研究的深入,灵芝的功效不断被开发[58-60],各类灵芝保健品层出不穷,然而对灵芝降解木质纤维素的研究仍处在探索性的研究阶段,其开发利用也相对滞后,因此开展灵芝降解木质素分子机理研究进而调控灵芝木质纤维素降解酶表达,是促进灵芝生物质降解及其产业化应用的关键,为取得进一步研究成果,其研究工作可从以下方面开展:(1)灵芝既是木质素降解菌也是重要的药用真菌,然而木质纤维素降解酶表达与灵芝有效成分积累关系研究目前还鲜有报道,开展相关领域研究有助于促进灵芝相关产业多层次发展;(2)灵芝木质纤维素酶结构及其表达调控分子机理亟待深入研究,为产业化研究提供理论依据;(3)目前国内灵芝品种丰富,评价体系主要在于提高子实体和孢子粉产量方面,建立和完善灵芝种质资源鉴定、降解能力评价体系有待开展。同时利用现代育种技术选育具有较高选择性的灵芝菌种是菌种选育研究的新方向;(4)目前利用微生物降解进行生物质预处理往往存在降解不够彻底等问题,开展灵芝木质纤维素降解酶类进行生物质预处理结合其它工业领域应用的相关技术协同处理生物质资源还有待深入研究;(5)目前灵芝降解利用后的菌糠主要用于饲料、肥料等产业,随着灵芝降解木质纤维素相关研究深入,通过精细化加工形成高附加值产品也是灵芝木质纤维素分解产业化的热点问题。
参考文献
[1] 路 瑶, 魏贤勇, 宗志敏, 等. 木质素的结构研究与应用[J]. 化学进展, 2013, 25(05): 838-858.
[2] Moubarik A, Grimi N, Boussetta N, et al. Isolation and characterization of lignin from Moroccan sugar cane bagasse: Production of lignin-phenol-formaldehyde wood adhesive[J]. Industrial Crops and Products, 2013, 45: 296-302.
[3] Soares M L, Gouveia E R. Influence of the alkaline delignification on the simultaneous saccharification and fermentation(SSF)of sugar cane bagasse[J]. Bioresource Technology, 2013, 147(0): 645-648.
[4] Guillén F, Martínez M J, Gutiérrez A. Biodegradation of lignocellu-losics: microbial, chemical, and enzymatic aspects of the fungal attack of lignin[J]. International Microbiology, 2005, 8: 195-204.
[5] Iqbal H M N, Asgher M, Bhatti H N. Optimization of physical and nutritional factors for synthesis of lignin degrading enzymes by a novel strain of Trametes versicolor[J]. Bio-resources, 2011, 6(2): 1 273-1 287.
[6] Maria de Lourdes T M P, Mahendra R. Fungal Enzymes[M]. Boca Raton, CRC Press, 2013: 258-274.
[7] 戴玉成. 中国多孔菌名录[J]. 菌物学报, 2009 (3): 315-327.
[8] Pan D, Zhang D, Wu J, et al. A novel proteoglycan from Ganoderma lucidum fruiting bodies protects kidney function and ameliorates diabetic nephropathy via its antioxidant activity in C57BL/6 db/db mice[J]. Food and Chemical Toxicology, 2014, 63: 111-118.
[9] Pan K, Jiang Q, Liu G, et al. Optimization extraction of Ganoderma lucidum polysaccharides and its immunity and antioxidant activities[J]. International Journal of Biological Macromolecules, 2013, 55: 301-306.
[10]张金萍, 王敬文, 姜景民, 等. 灵芝属木质素降解高效菌株筛选[J]. 林业科学研究, 2005, 18(1): 106-108.
[11] Ríos S, Eyzaguirre J. Conditions for selective degradation of lignin by the fungus Ganoderma australis[J]. Applied Microbiology and Biotechnology, 1992, 37(5): 667-669.
[12] Bechtold R, González A E, Almendros G, et al. Lignin alteration by Ganoderma australe and other white-rot fungi after solid-state fermentation of beech wood[J]. Holzforschung-International Journal of the Biology, Chemistry, Physics and Technology of Wood, 1993, 47(2): 91-96.
[13] Wesenberg D, Kyriakides I, Agathos S N. White-rot fungi and their enzymes for the treatment of industrial dye effluents[J]. Biotechnology Advances, 2003, 22(1): 161-187.
[14] Mehboob N, Asad M J, Imran M, et al. Production of lignin peroxidase by Ganoderma leucidum using solid state fermentation[J]. African Journal of Biotechnology, 2013, 10(48): 9 880-9 887.
[15] 林 鹿, 何北海, 孙润仓, 等. 木质生物质转化高附加值化学品[J]. 化学进展, 2007, 19(7): 1 206-1 216.
[16] 池玉杰, 伊洪伟. 木材白腐菌分解木质素的酶系统-锰过氧化物酶, 漆酶和木质素过氧化物酶催化分解木质素的机制[J]. 菌物学报, 2007, 26(1): 153-160.
[17] Ambert-Balay K, Dougherty M, Tien M. Reactivity of manganese peroxidase: site-directed mutagenesis of residues in proximity to the porphyrin ring[J]. Archives of Biochemistry and Biophysics, 2000, 382(1): 89-94.
[18] 张建军, 罗勤慧. 木质素酶及其化学模拟的研究进展[J]. 化学通报, 2001, 64(8): 470-477.
[19] Hariharan S, Nambisan P. Optimization of lignin peroxidase, manganese peroxidase, and Lac production from Ganoderma lucidum under solid state fermentation of pineapple leaf[J]. BioResources, 2012, 8(1): 250-271.
[20] Jouanin L. Lapierre C, et al. Lignins: biosynthesis, biodegradation and bioengineering[M]. New York: Academic Press, 2012.
[21] 葛宏华, 武 赟, 肖亚中. 漆酶空间结构, 反应机理及应用[J]. 生物工程学报, 2011, 27(2): 156-163
[22] Piscitelli A, Giardina P, Lettera V, et al. Induction and transcriptional regulation of laccases in fungi[J]. Current Genomics, 2011, 12(2): 104.
[23] Soden D M, Dobson A D W. Differential regulation of laccase gene expression in Pleurotus sajor-caju[J]. Microbiology, 2001, 147(7): 1 755-1 763.
[24] Collins P J, Dobson A. Regulation of laccase gene transcription in Trametes versicolor[J]. Applied and Environmental Microbiology, 1997, 63(9): 3 444-3 450.
[25] Adaskaveg J E, Gilbertson R L, Dunlap M R, et al. Effects of Incubation Time and Temperature on In Vitro Selective Delignification of Silver Leaf Oak by Ganoderma colossum[J]. Applied and Environmental Microbiology, 1995, 61(1): 138-144.
[26] Sasidhara R, Thirunalasundari T. Lignolytic and lignocellulosic enzymes of Ganoderma lucidum in liquid medium[J]. European Journal of Experimental Biology, 2014, 4(2): 375-379.
[27] Asgher M, Sharif Y, Bhatti H N. Enhanced production of ligninolytic enzymes by Ganoderma lucidum IBL-06 using lignocellulosic agricultural wastes[J]. International Journal of Chemical Reactor Engineering, 2010, 8(1): DOI: 10.2202/1542-6580.2203.
[28] D'souza T M, Merritt C S, Reddy C A. Lignin-Modifying Enzymes of the White Rot Basidiomycete Ganoderma lucidum[J]. Applied and Environmental Microbiology, 1999, 65(12): 5 307-5 313.
[29] Stajic M, Kukavica B, Vukojevic J, et al. Wheat straw conversion by enzymatic system of Ganoderma lucidum[J]. BioResources, 2010, 5(4): 2 362-2 373.
[30] Mehboob N, Asad M J, Imran M, et al. Production of lignin peroxidase by Ganoderma leucidum using solid state fermentation[J]. African Journal of Biotechnology, 2013, 10(48): 9 880-9 887.
[31] 张 力, 韩大勇, 邵喜霞. 白腐真菌木质素降解酶系研究进展[J]. 中国牧业通讯, 2009(23): 6-8.
[32] 王茂成, 李 勇, 李世忠, 等. 食用菌木质素降解菌的筛选及产酶条件优化[J]. 贵州农业科学, 2013, 41(5): 83-86.
[33] Terrón M C, González T, Carbajo J M, et al. Structural close-related aromatic compounds have different effects on laccase activity and on lcc gene expression in the ligninolytic fungus Trametes sp.I-62[J]. Fungal Genet Biol, 2004, 41: 954-962.
[34] Galhaup C, Goller S, Peterbauer C K, et al. Characterization of the major laccase isoenzyme from Trametes pubescens and regulation of its synthesis by metal ions[J]. Microbiology, 2002, 148: 2 159-2 169.
[35] Ryu S H, Kim B, Kim M, et al. Molecular characterization of manganese peroxidases from white-rot fungus Polyporus brumalis[J]. Bioprocess and Biosystems Engineering, 2014, 37(3): 393-400.
[36] Janusz G, Kucharzyk K H, Pawlik A, et al. Fungal laccase, manganese peroxidase and lignin peroxidase: gene expression and regulation[J]. Enzyme and Microbial Technology, 2013, 52(1): 1-12.
[37] Sun J, Peng R H, Xiong A S, et al. Secretory expression and characterization of a soluble laccase from the Ganoderma lucidum strain 7071-9 in Pichia pastoris[J]. Molecular Biology Reports, 2012, 39(4): 3 807-3 814.
[38]姚 强, 高兴喜, 宫志远, 等. 灵芝漆酶高产菌株的筛选及产酶诱导[J]. 中国酿造, 2010, 29(11): 29-31.
[39] Batool S, Asgher M, Sheikh M A, et al. Optimization of physical and nutritional factors for enhanced production of lignin perosidase by Ganodama lucidum IBL-05 in solid state culture of wheat straw[J]. JAPS, Journal of Animal and Plant Sciences, 2013, 23(4): 1 166-1 176.
[40] 陈岳文. 灵芝基因组中漆酶基因簇的生物信息学分析及Cu~(2+)诱导表达[D]. 长沙: 湖南农业大学, 2013.
[41] Chandra R P, Lehtonen L K, Ragauskas A J. Modification of high lignin content kraft pulps with laccase to improve paper strength properties. 1. Laccase treatment in the presence of gallic acid[J]. Biotechnology Progress, 2004, 20(1): 255-261.
[42] Camarero S, Garcia O, Vidal T, et al. Efficient bleaching of non-wood high-quality paper pulp using laccase-mediator system[J]. Enzyme and Microbial Technology, 2004, 35(2/3): 113-120.
[43] Shweta K. Aerobic treatment of handmade paper industrial effluents by white rot fungi[J]. Journal of Bioremediation and Biodegradation, 2012, 3(5): 2-7
[44] Revankar M S, Lele S S. Synthetic dye decolorization by white rot fungus, Ganoderma sp. WR-1[J]. Bioresource Technology, 2007, 98(4): 775-780.
[45] Rigas F, Papadopoulou K, Dritsa V, et al. Bioremediation of a soil contaminated by lindane utilizing the fungus Ganoderma australe via response surface methodology[J]. J Hazard Mater, 2007, 140(1-2): 325-332.
[46] Jaqueline da Silva Coelho-Moreira, Giselle Maria Maciel, Rafael Castodi, et al. Involvement of lignin-modifying enzymes in the degradation of herbicides[J]. Herbicides-Advances in Research, 2013: 165-187.
[47] Ntougias S, Baldrian P, Ehaliotis C, et al. Biodegradation and detoxification of olive mill wastewater by selected strains of the mushroom genera Ganoderma and Pleurotus[J]. Chemosphere, 2012, 88(5): 620-626.
[48] Saparrat M, Balatti P A, Martínez M J, et al. Differential regulation of laccase gene expression in Coriolopsis rigida LPSC No. 232[J]. Fungal Biol, 2010, 114: 999-1 006.
[49] Sitarz A K, Mikkelsen J D D, Hojrup P, et al. Identification of a laccase from Ganoderma lucidum CBS 229.93 having potential for enhancing cellulase catalyzed lignocellulose degradation[J]. Enzyme and Microbial Technology, 2013, 53(6): 378-385.
[50] Zhang S S, Chen X B, et al. On production performance and blood biochemical parameters of dairy cows[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2014(01):
[51] Sharma K K, Shrivastava B, Sastry V R B, et al. Middle-redox potential laccase from Ganoderma sp.: its application in improvement of feed for monogastric animals[J]. Scientific Reports, 2013, 3: 1 299-1 307.
[52] Shrivastava B, Nandal P, Sharma A, et al. Solid state bioconversion of wheat straw into digestible and nutritive ruminant feed by Ganoderma sp. rckk02[J]. Bioresource Technology, 2012, 107: 347-351.
[53] Ke L, Wu Q, Zhang D. Bioconversion of rape straw into a nutritionally enriched substrate by Ganoderma lucidum and yeast[J]. African Journal of Biotechnology, 2013, 10(29): 5 648-5 653.
[54] 林占熺, 高怀宾, 林 辉. 菌草灵芝, 菌糠和中草药饲料添加剂防治仔猪肠炎的效果[J]. 福建农林大学学报: 自然科学版, 2005, 33(1): 85-88.
[55] Peksen A, Yakupoglu G, Yakupoglu T, et al. Changes in chemical compositions of substrates before and after Ganoderma lucidum cultivation[J]. World Journal of Microbiology and Biotechnology, 2011, 27(3): 637-642.
[56]冀春花, 张永北, 史欧阳, 等. 海南农垦鹿角灵芝循环农业模式分析及技术创新[J]. 中国热带农业, 2012(4): 14-16.
[57]钱亚鹏, 钱世钧. 真菌漆酶及应用生物工程进展[J]. 生物工程进展, 2001, 21(5): 23-28.
[58] 张桂兴, 严学东, 杨佛新, 等. 灵芝的功效及其高产栽培技术研究[J]. 安徽农业科学, 2013, 41(27): 10 958-10 959.
[59] 姜芳燕, 马 军, 陈永敢, 等. 灵芝活性成分的研究进展[J]. 黑龙江农业科学, 2014(8): 40.
[60] 于海洋, 弥春霞, 吴 薇, 等. 灵芝多糖提取方式比较及多糖应用研究进展[J]. 安徽农业科学, 2014(8): 2318-2324, 2400.
