液相色谱法分析龙眼及其种植土壤中的烯酰吗啉残留
2015-05-30刘景坤武春媛邓晓李怡李勤奋
刘景坤 武春媛 邓晓 李怡 李勤奋
摘 要 紫外扫描确定250 nm作为烯酰吗啉检测波长,优化后选取甲醇+水(V ∶ V=6 ∶ 4)作为流动相不易受样品中杂质峰的干扰且两个组分峰具有较好的分离度。建立了烯酰吗啉标准曲线,0.05~5 mg/kg范围内线性关系良好(R2=0.999 7)。选择乙腈高速匀浆提取后经过佛罗里硅藻土萃取柱净化处理龙眼样品,避免了杂质对目标峰的干扰,回收率77%~97%,变异系数<7%;选择丙酮+水(V ∶ V=1 ∶ 1)作为提取剂采用2种方法(振荡3 h、超声振荡各30 min)提取后土壤样品用二氯甲烷萃取后不经净化直接分析,结果表明对目标物分析无影响,对比2种提取方法选取超声振荡各30 min的方法不仅节约时间,而且回收率较高为83%~96%,变异系数<7%。
关键词 烯酰吗啉残留;提取净化;液相色谱法
中图分类号 S482;O657.7 文献标识码 A
Residue Analysis of Dimethomoph in Longan
and Soil by HPLC
LIU Jingkun1,2, WU Chunyuan1,2, DENG Xiao1,2, LI Yi1,2, LI Qinfen1,2
1 Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
2 Danzhou Scientific Observing and Experimental Station of Agro-Environment, Ministry of Agriculture, Danzhou, Hainan 571737, China
Abstract 250 nm was selected as the detection wavelength by the UV spectrophotometer. 60% methanol in water was selected as the mobile phase after optimization. Two peaks with a good separation were detected without interference from the matrix. The standard curve was developed and the linear was good from 0.05 mg/kg to 5 mg/kg. Residue in longan samples were extracted by homogenate in acetonitrile and purified by florisil column, which avoided the matrix interference to the aim peaks. The recovery of the method was 77%-97% with a RSD less than 7%. At the same time, soil samples were extracted using 50% acetone in water solution via two methods, oscillation for 3 hours and ultrasonic for 30 min combined with oscillation for 30 min. Then the residues were extracted using dichloromethane from the extraction solution. Ultrasonic treatment for 30 min combined with oscillation for 30 min had a higher recovery rate 83%-96% with a RSD less than 7%.
Key words Dimethomoph residue; Extraction and purify; HPLC method
doi 10.3969/j.issn.1000-2561.2015.08.019
.
烯酰吗啉是一种内吸型治疗性专用低毒杀菌剂,专一防治卵菌纲真菌性病害,化学式C21H22ClNO4,存在两种异构体(E、Z)如图1所示。其作用机制[1-2]是破坏病菌细胞壁膜的形成,引起孢子囊壁的分解而使病菌死亡,对卵菌生活史的其他阶段(除游动孢子外)均有作用[3-5]。该药广泛用于葡萄、荔枝、龙眼、番茄等作物的霜霉病、霜疫霉病、疫腐病、腐霉病等病害,与甲霜灵等苯酰胺类杀菌剂没有交互抗性。
龙眼是人们喜爱的热带水果,海南四季气候温暖湿润是重要的龙眼产地,但是由于温润的气候条件使得龙眼种植过程中细菌、真菌等病害发生也较为常见,其中烯酰吗啉是防治此类病害的重要农药品种,由于该药内吸性强[6],根部施药,可通过根部进入植株的各个部位;叶片喷药,可进入叶片内部,因此,对于荔枝、龙眼等热带水果的质量安全就较为重要。大量或者不当使用容易造成残留超标现象,对消费者身体健康和农田生态环境构成较大威胁。文献有关于甘蓝、番茄、葡萄中烯酰吗啉残留分析的报道[7-10],但龙眼中残留的检测方法未见报道,因此,建立龙眼中烯酰吗啉的分析方法对保证消费者身体健康具有重要意义。
1 材料与方法
1.1 材料
1.1.1 样品及试剂 龙眼:采集自东方市月大龙眼果园(剥皮去核备用);土壤:采集自东方市月大龙眼果园(除去石块、植物根等其他杂物后风干处理,然后过2 mm筛室温下保存备用);烯酰吗啉标准品(>96%):购自农业部农药检定所;甲醇(色谱纯)、佛罗里硅藻土净化小柱(自制)。
1.1.2 仪器 戴安高效液相色谱仪(U-3000,配PDA-100二极管阵列检测器,Waters SYMMETRY 5 μm×4.6 mm×250 mm C18液相色谱柱)、高速匀浆机(T18,IKA)、组织粉碎机(Ashoo)、紫外-可见分光光度计(岛津UV-2600)、旋蒸仪(金叶RE-3000,上海亚荣生化)、氮吹仪(美国OA-SYS)、万分之一天平(岛津)。
1.2 方法
1.2.1 紫外检测波长的确定 用甲醇配制适当浓度的的烯酰吗啉标准溶液,用紫外分光光度计进行200~380 nm波长扫描,调整烯酰吗啉浓度使其最大吸光度值位于0.2~0.8,结果表明,烯酰吗啉的最大吸收峰处波长为250 nm,作为液相色谱紫外检测器的检测波长。
1.2.2 流动相的确定 以甲醇和超纯水为流动相配比,进标准样品,初步确定流动相配比为甲醇 ∶ 水=60 ∶ 40(V ∶ V)。
1.2.3 标准曲线的建立 称取10.00 mg烯酰吗啉标准品用甲醇定容至10.00 mL,作为储备液。用此储备液配制系列浓度为5、2、0.5、0.1、0.05 μg/mL的标准溶液(溶剂均为甲醇)建立标准曲线。
1.2.4 样品处理
(1)龙眼样品的提取与净化[7-11]。我国尚未制定龙眼中烯酰吗啉的最大残留限量,参照烯酰吗啉在葡萄上、草莓上的最大残留限量[12],设定本方法3个加标浓度为0.1、0.5、1.5 mg/kg。
提取:将龙眼剥皮去核后称取4份,每份120 g,其中1份作为空白,另外3份加入烯酰吗啉的标准溶液,使其浓度分别为0.1、0.5、1.5 mg/kg。将4份龙眼果肉用粉碎机分别打碎(打前用甲醇充分洗净刀头),每份均称取20 g,加入40 mL乙腈高速匀浆1 min后滤至加入6 g NaCl的100 mL具塞试管中,剧烈震荡1 min,静置30 min后吸取上清液20 mL,氮吹至近干后取出挥干待净化,每个浓度设置5个平行样品。
净化:将1.0 g佛罗里硅藻土加入10 mL规格的固相萃取空柱中用真空泵加压压实;用10 mL正己烷+乙酸乙酯(V ∶ V=4 ∶ 1)预淋洗萃取柱,弃去淋洗液;用5 mL正己烷将上述提取液转移至固相萃取柱中,弃去流出液;用15 mL正己烷+乙酸乙酯(V ∶ V=1 ∶ 1)洗脱,收集洗脱液减压浓缩,氮气吹干,用甲醇复溶后定容至1 mL,待分析。
(2)土壤样品的提取。环刀法[13]测定风干土壤的最大持水量,称取4份×120 g风干土壤,用烯酰吗啉的标准溶液的水溶液调节土壤含水量的最大持水量为60%,土壤中农药浓度分别为0(空白)、0.1、0.5、1.5 mg/kg,25 ℃避光密封3 h后加入50 mL丙酮+水混合液(V ∶ V=1 ∶ 1),采取两种方式进行提取,方法一:25 ℃避光密封摇3 h;方法二:25 ℃避光密封超声30 min后摇动30 min。将上述土壤溶液离心后,取上清20 mL用30 mL×4次二氯甲烷提取,混合二氯甲烷层,用无水硫酸镁干燥后旋转蒸发至近干后挥干,用甲醇复溶后定容至1 mL,待分析。
2 结果与分析
2.1 流动相比例的选择
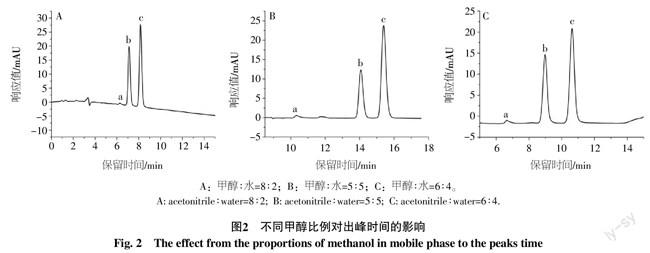
烯酰吗啉分子结构存在异构体(图1)产生双峰[图2中b(E体),c(Z体)]。选择80%的甲醇(图2-A)时,出峰时间较早,b、c距离较近,分离度相对较低,同时由于标准品纯度的原因产生a峰,距离b较近干扰目标峰的积分,而且容易受到样品分析中可能存在的极性较大的杂质干扰,因此需要将其目标峰时间延长以获得较佳的分离度并避免干扰;当甲醇比例减小至50%时,烯酰吗啉在14 min左右开始出峰(图2-B),尽管b、c两峰有较好的分离度,并且不受杂峰a的干扰,但分析时间相对较长;当甲醇比例为60%时,既能获得较好的分离度,又能完全避开杂峰的干扰,而且分析时间相对适中(图2-C),增加了分析的效率,节省了成本。
2.2 提取方法的比较
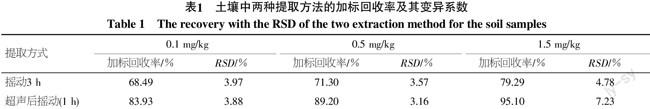
在土壤样品的提取前,放置3 h使农药与土壤发生吸附耦合等作用[14],考查两种提取方法对农药的提取效率,结果如表1所示,摇动3 h后加标回收率比超声后摇动稍低,同时超声后摇动所需时间较摇动大大缩短,较大的提高了分析的效率,因此采用超声后摇动结合的方式进行。
2.3 方法准确度与精密度
加标回收率来体现方法的准确度,其变异系数来衡量方法的精密度。龙眼中烯酰吗啉残留回收率在77%~97%之间,变异系数均<7%(表2),土壤中残留的回收率在83%~96%,变异系数<8%,说明两种方法稳定性均较好,回收率满足检测工作要求,方法检出限0.015 mg/kg,可以用于实际样品的检测。
2.4 标准曲线的建立
将烯酰吗啉异构体的两个峰进行面积加和计算含量,按照优化的条件建立烯酰吗啉的标准曲线,如图3所示,R2达到0.999 7(n=5),在0.05~5 μg/mL范围内线性关系良好,能够准确定量烯酰吗啉的残留。
2.5 烯酰吗啉样品及标准溶液色谱图
烯酰吗啉标准溶液、龙眼及土壤空白样品、龙眼及土壤加标样品溶液色谱峰如图4所示。烯酰吗啉存在顺反异构体,产生两个吸收峰(图4标准溶液),龙眼样品经过净化后对烯酰吗啉的两个样品峰的分析均无干扰(图4龙眼样品加标),土壤样品未经过净化在11.5 min左右出现一个杂质峰,但由于烯酰吗啉两个峰在11.0 min左右完全流出,因此即使未经过净化对目标物的分析也未构成干扰(图4土壤样品加标)。
3 讨论与结论
植物组织中农药残留的提取常用乙腈,能够在保证提取效率的同时尽量减少脂肪和色素的提取[14]。因此,龙眼中烯酰吗啉的提取采用乙腈匀浆来进行。从化学结构可以看出,烯酰吗啉极性相对较小,而且龙眼果肉中存在较为大量的糖分、维生素等极性较大的物质,因此采用佛罗里硅藻土柱进行净化,将杂质组分净化掉的同时获得了较好的回收效果。土壤是农药污染最主要的对象之一,而且许多农药在施入农田后会和土壤产生较强的耦合作用,使得其提取比在植物组织中更加困难,因此在空白土壤样品加标后放置3 h以便使土壤和农药分子进行吸附和耦合后再进行提取,综合文献所报道,采用丙酮-水的混合溶液进行提取,比较了振荡3 h和超声波30 min加振荡30 min两种提取方法,结果表明后者的提取率较高,而且提取时间大大缩短,提高了工作质量和效率。
本研究参照烯酰吗啉在葡萄、草莓中的最大残留限量[12],加标建立了烯酰吗啉在龙眼果肉和栽培土壤中残留的检测方法,回收率均介于77%~97%,准确度较高,变异系数<7%,精密度较高,可以用于实际样品的检测,鉴于龙眼和荔枝果实成分的相似性,可以尝试将本方法用于荔枝中烯酰吗啉残留的检测,对保证重要的热带水果质量安全和环境生态保护具有重要意义。
参考文献
[1] 宋春国, 于建垒, 李瑞娟, 等. 烯酰吗啉在黄瓜中的残留消解动态[J]. 中国蔬菜, 2006(11): 28-291.
[2] 张文斌, 冯光泉, 曾鸿超, 等. 三七及栽培土壤中烯酰吗啉残留降解动态研究[J]. 中草药, 2009, 40(5): 809-812.
[3] 蒋木庚, 王鸣华. 拟除虫菊酯化学[M]. 南京: 南京农业大学, 1998: 121.
[4] Stein J M, Kirk W W. The Generation and quantification of resistance to dimethomorph in Phytophthora infestans[J]. Plant Disease, 2004, 88(9): 930-934.
[5] 黄青春, 叶钟音. 烯酰吗啉的特性及其作用机制[J]. 农药科学与管理, 2002, 21(5): 18-31.
[6] 胡 燕, 王开运, 许学明, 等. 烯酰吗啉对我国烟草黑胫病菌的毒力研究[J]. 农药学学报, 2006, 8(4): 339-343.
[7] 王 岩, 姚威风, 梁 爽, 等. 甘蓝和土壤中吡唑醚菌酯·烯酰吗啉残留分析[J]. 农药, 2011, 50(1): 46-47, 57.
[8] 李荣玉, 谢庆艳, 王 梅, 等. 烯酰吗啉在土壤及番茄中残留量的气相色谱分析[J]. 山地农业学报, 2013, 32(6): 495-498.
[9] 范东升. 烯酰吗啉在葡萄上的残留及消解动态[J]. 农药, 2009, 48(9): 675-676, 682.
[10] Matt J H, Takayuki S. Gas Chromatographic-Mass Spectrometric Method for the Analysis of Dimethomorph Fungicide in Dried Hops[J]. J Agric Food Chem, 2000, 48: 5 824-5 828.
[11] 王惠云, 张爱美, 刘永波. 固相萃取-GC/MS法测定蔬菜水果中烯酰吗啉残留[J]. 环境监测管理与技术, 2009, 21(5): 49-51.
[12] 国家卫生和计划生育委员会与农业部联合发布. GB 2763-2014食品中农药最大残留限量[S]. 2014-03-20.
[13] 中华人民共和国农业部发布. NY/T 1121.22-2010土壤检测: 土壤田间持水量的测定-环刀法[S]. 2010-07-08.
[14] 张 艳. 农药残留分析中不同提取溶剂的评价[J]. 甘肃农业科技, 2006(9): 28-29.
