钩枝藤生物碱对斜纹夜蛾幼虫的毒杀活性
2015-05-30王军等
王军等

摘 要 探讨钩枝藤总生物碱及3个单体化合物[(1)Ancistrocline,(2)5′-O-demethylhamatintine,(3)N-methylphylline]对斜纹夜蛾幼虫的毒杀活性,旨在开发新型植物源农药。采用浸虫法测定钩枝藤总碱对斜纹夜蛾3龄幼虫的毒杀活性和采用饲料混毒法测定钩枝藤单体化合物对斜纹夜蛾初孵幼虫毒杀活性。结果表明:钩枝藤总碱对斜纹夜蛾3龄幼虫具有较强的毒杀作用,其第3天和第5天的LC50值分别为2.61 mg/mL和0.91 mg/mL。单体化合物对斜纹夜蛾初孵幼虫具有明显的抑制生长发育作用,其中以化合物(2)抑制作用最强,主要表现为化蛹率(23.33%)、羽化率(13.33%)显著低于对照(化蛹率90.00%、羽化率86.67%)。
关键词 钩枝藤;生物碱;斜纹夜蛾;毒杀活性;抑制生长发育
中图分类号 S481.1 文献标识码 A
Insecticidal Activity of the Alkaloids from Ancistrocladus
tectorius Against the Larvae of Spodoptera litura
WANG Jun1, YAN Chao2, CAI Caihong1, FENG Gang2, ZHANG Jing2 *, DAI Haofu1 *
1 Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory
of Biology and Genetic Resources of Tropical Crops, Ministry of Agriculture / Hainan Key Laboratory for Research
and Development of Natural Products from Li Folk Medicine, Haikou, Hainan 571101, China
2 Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract The insecticidal activity of the total alkaloids and its 3 compounds[(1): Ancistrocline,(2): 5′-O-demethylhamatintine,(3): N-methylphylline]of Ancistrocladus tectorius against the larvae of Spodoptera litura were discussed for the development of new type of botanical pesticides. The toxicity of the total alkaloids to the 3rd instar larvae of S. litura was determined by insect-dip method. The toxicity of 3 compounds to the larvae of S. litura was tested by diet-incorporation. The results indicated that the total alkaloids of A. tectorius had strong toxic effect on the 3rd instar larvae and the LC50 values of 3 d and 5 d was 2.61 mg/mL and 0.91 mg/mL respectively. The growth of newly hatched instar larvae of S. litura was also inhibited by the three compounds. The compound(2)had the strongest inhibition effects with pupation rate 23.33% and eclosion rate 13.33%, which was significantly lower than those of control(pupation rate 90.00%, eclosion rate 86.67%).
Key words Ancistrocladus tectorius; Alkaloids; Spodoptera litura; Insecticidal activity; Growth and development inhibition
doi 10.3969/j.issn.1000-2561.2015.09.017
斜纹夜蛾(Spodoptera litura Fabricius)属鳞翅目(Lepidoptera)、夜蛾科(Noctuidae),是世界重要的农业害虫之一。以幼虫取食寄主植物的果实、花、叶等,寄主植物多达99科290多种[1]。在我国淮河以北间歇性发生为害,淮河以南常年发生为害。在大田栽培作物中主要为害棉花、大豆、烟草、甘薯、花生等[2];而在蔬菜中则以十字花科蔬菜和水生蔬菜受害最为严重。近年来,斜纹夜蛾在各地大发生的频率明显提高,且呈上升趋势[3-5]。由于化学药剂的施用造成环境污染和害虫耐药性的问题,新型天然、高效、安全的物质被用来开发杀虫剂已成为一种必然趋势。
运用植物生物碱对斜纹夜蛾的研究较少,如烟碱能抑制斜纹夜蛾3龄幼虫CarE的活性,并诱导谷胱甘肽-S-转移酶的活性[6];雷公藤碱对斜纹夜蛾有强烈的忌避、拒食作用[7];白前生物碱对斜纹夜蛾3龄和5龄幼虫具有较好的拒食活性[8],因而,植物生物碱具有广阔的开发利用前景,值得深入研究。
钩枝藤[Ancistrocladus tectorius(Lour.)Merr.]为钩枝藤科(Ancistrocladaceae)钩枝藤属(Ancistrocladus Wall.)植物,该科全世界仅1属,约20种。我国有1种,生于山坡、山谷密林中或山地热带雨林中,海拔500~700 m,见于海南各地[9-10]和广西大青山[11-13],分布于柬埔寨、印度、印度尼西亚、老挝、马来西亚、缅甸、新加坡、泰国、越南等国家[2]。钩枝藤作为一种民间常用药物[14-16],具有抗寄生虫感染、消炎止泻、行气散结之功效,可用于治疗疟疾、痢疾、胃痛、跌打损伤、蛇毒等[15,17]。钩枝藤的化学成分主要为生物碱类[18-28],其生物活性主要有抗疟原虫[29]、抗寄生虫[30]、抗菌[14,30-32]、抗病毒[30]、抗肿瘤[29-30]、抗HIV[27]等方面,但对于在斜纹夜蛾上的应用研究未见报道。本研究在室内测定了钩枝藤总生物碱及其单体化合物对斜纹夜蛾幼虫的毒杀活性和抑制生长发育作用,将为充分利用钩枝藤植物资源开发新型植物源杀虫剂提供理论依据。
1 材料与方法
1.1 材料
钩枝藤枝条于2011年5月采自海南省昌江县,经中国热带农业科学院热带生物技术研究所代正福副研究员鉴定,凭证标本(No. TX20110512)存放于中国热带农业科学院热带生物技术研究所。斜纹夜蛾卵用采自海南省海口市美兰区桂林洋福云村未施药的莲藕叶,在室内饲养繁殖多代,试验时挑选大小一致、健康活泼的初孵幼虫和3龄中期幼虫供试。
1.2 方法
1.2.1 钩枝藤总碱提取及单体化合物分离方法
钩枝藤枝条(68.00 kg)晒干后加工成粉末,用体积分数95%的乙醇浸提3次,每次7 d。所得滤液经真空减压浓缩至无乙醇味,得到乙醇提取物。将乙醇提取物用2%的盐酸溶液反复溶解,过滤得酸水液,酸水液用氯仿萃取3次,减压浓缩回收溶剂后得到酸水氯仿萃取物总碱A(179.00 g)。萃取后所剩的酸水相加入25%氨水至pH值为10.0,之后再用氯仿萃取3次,减压浓缩回收溶剂后得到碱水氯仿萃取物总碱B(17.20 g)。
总碱A的分离纯化:将酸水氯仿萃取物总碱A经减压硅胶柱色谱,以氯仿-甲醇(1 ∶ 0~0 ∶ 1)梯度洗脱得到9个部分(Fr.1~Fr.9)。其中Fr.1(77.00 g)再经减压硅胶柱色谱,以石油醚-乙酸乙酯(1 ∶ 0~0 ∶ 1)梯度洗脱得到7个部分(Fr.1.1~Fr.1.7),Fr.1.6(6.60 g)经硅胶柱色谱,以石油醚-丙酮(12 ∶ 1~1 ∶ 1)梯度洗脱得到6个亚组分(Fr.1.6.1~Fr.l.6.6),其中Fr.l.6.6(2.90 g)经反相柱色谱甲醇-水(1 ∶ 9~1 ∶ 0)、硅胶柱色谱以石油醚-乙酸乙酯(10 ∶ 1~1 ∶ 1)洗脱,并且经甲醇重结晶得到化合物(1)(120.20 mg)。Fr.6(2.50 g)经Sephadex LH-20柱色谱(纯甲醇)得到5个部分(Fr.6.1~Fr.6.5),其中Fr.6.1(1.10 g)经反相柱色谱、硅胶柱色谱,以氯仿-甲醇(10 ∶ 1)洗脱得到化合物(2)(6.30 mg)。
总碱B(17.00 g)经减压硅胶柱色谱,以氯仿-甲醇(1 ∶ 0~0 ∶ 1)梯度洗脱得到8个组分(Fr.1~Fr.8)。Fr.5(2.50 g)经反相柱色谱和重结晶得到化合物(3)(70.00 mg)。
1.2.2 化合物鉴定 Ancistrocline(1)无色结晶(氯仿),mp 229~233 ℃,[α]2D2+61.7(c2.1,氯仿),遇10%的硫酸显墨绿色,改良碘化铋钾喷雾显橘红色,初步推测该化合物可能为生物碱。EI-MS m/z: 421[M]+,结合1H NMR和13C NMR谱数据推定其分子式为C26H31NO4。1H NMR(CDCl3, 500 MHz)δ 0.94(3H, d, J=6.3 Hz, CH3-3), 1.42(3H, d, J=6.2 Hz, CH3-1), 1.86(1H, m, H-4a), 2.09(1H, m, H-4b), 2.12(3H, s, CH3-2'), 2.29(1H, m, H-3), 2.43(3H, s, CH3-N), 3.72(1H, m, H-1), 3.85(3H, s, OCH3-8), 3.93(3H, s, OCH3-4'), 3.98(3H, s, OCHs-5'), 6.50 (1H, s, H-7), 6.75(1H, d, J=7.9 Hz, H-6'), 6.80 (1H, s, H-3'), 6.83(1H, d, J=7.9 Hz, H-8'), 7.18(1H, t, J=7.9 Hz, H-7')。13C NMR(CDCl3, 125 MHz)。上述波谱数据与文献[33]报道基本一致,故鉴定为ancistrocline。
5'-O-Demethylhamatintine(2)黄色油状,遇10%的硫酸显蓝黑色,改良碘化铋钾喷雾显橘红色,初步推测该化合物可能为生物碱。EI-MS m/z: 391 [M]+,结合1H NMR和13C NMR谱数据推定其分子式为C24H25NO4。1H NMR(DMSO-d6, 500 MHz): δ 1.16(3H, d, J=6.5 Hz, CH3-3), 1.99(3H, s, CH3-2'), 2.39(1H, dd, J=17.0, 10.2 Hz, H-4a), 2.58(1H, dd, J=17.0, 5.2 Hz, H-4b), 3.07(3H, s, CH3-1), 3.50 (1H, m, H-3), 3.72(3H, s, OCH3-8), 3.74(3H, s, OCH3-4'), 6.65(1H, d, J=7.5 Hz, H-8'), 6.70(1H, s, H-7), 6.89(1H, d, J=7.5 Hz, H-6'), 6.91(1H, s, H-3'), 7.05(1H, t, J=7.5 Hz, H-7'), 8.20(2H, s, OH-6,4')。13C NMR(DMSO-d6, 125 MHz)。上述波谱数据与文献[34]报道基本一致,故鉴定为5 '-O-Demethylhamatintine。
N-methylphylline(3)无色结晶(氯仿),mp 265~267℃,[α]2D2(c 0.01,甲醇),遇10%的硫酸显浅绿色,改良碘化铋钾喷雾显橘红色,初步推测该化合物可能为生物碱。EI-MS m/z: 191[M]+,结合1H NMR和13C NMR谱数据推定其分子式为C12H7NO。1H NMR(DMSO-d6, 500 MHz): δ 1.03(3H, d, J=6.3 Hz, CH3-3), 1.19(3H, d, J=6.3 Hz, CH3-1), 2.23(1H, m, H-3), 2.24(3H, s, CH3-N), 2.42(2H, d, J=8.0 Hz, H-4), 3.49(1H, m, H-1), 6.42(1H, d, J=7.4 Hz, H-5), 6.52(1H, d, J=7.4 Hz, H-7), 6.81(1H, t, J=7.4 Hz, H-6), 9.26(1H, s, OH)。13C NMR(DMSO-d6, 125 MHz)。上述波谱数据与文献报道基本一致[35],故鉴定为N-methylphylline。
1.2.3 对斜纹夜蛾3龄幼虫的毒杀作用 采用浸虫法[36],每处理重复3次,每重复10头试虫。分别统计处理后第3天和5天的死亡情况,计算死亡率。用毛笔轻触虫体,不动或不能正常爬动者计为死亡。
1.2.4 对斜纹夜蛾初孵幼虫的杀虫活性 采用饲料混毒法[37]测定钩枝藤单体生物碱类化合物(1)~(3)的杀虫活性。先将纯品化合物用丙酮配制成1 mg/mL,个别不溶的样品加少量DMSO(含量在1%以下),配制斜纹夜蛾半人工饲料,趁热在12孔培养板的每孔加入1 mL半人工饲料。待饲料凝固后,每孔加待测样品20 μL,每个样品加入10孔,重复3次。待溶剂挥发后,每孔接入1头孵化后2 h的斜纹夜蛾初孵幼虫,放入温度为(25±1)℃、湿度80%的养虫室内饲养。7 d后换喂正常饲料,直至成虫羽化,以丙酮(丙酮+助溶剂)为溶剂对照,印楝素作为药剂对照,分别于接虫后7、10、14和20 d检查试虫死亡情况,统计试虫幼虫期、蛹期及化蛹情况,称量蛹重,统计羽化虫数量,并计算死亡率、化蛹率和羽化率。
1.3 数据处理
实验结果用SPSS 13.0进行统计分析,将死亡率转化为几率值,浓度转换成对数后进行线性回归,回归方程使用机值分析法计算。采用单因素方差分析DMRT法多重比较,p<0.05为具有差异显著性。
2 结果与分析
2.1 对斜纹夜蛾3龄幼虫的毒杀作用
结果显示,钩枝藤总碱在处理浓度分别为10、5、1、0.5和0.1 mg/mL时,对斜纹夜蛾3龄幼虫具有不同程度的毒杀作用(见表1)。其中以10 mg/mL处理组的杀虫活性最高,其3 d和5 d的校正死亡率分别为70.00%和83.33%;10、5、1 mg/mL 处理组随着时间的延长,5 d较3 d的校正死亡率增长幅度相同,均为13.33%;0.5 mg/mL处理组虽然在处理后第3天的毒杀活性较差(26.67%),但随着处理时间的延长杀虫活性明显增强,其5 d的校正死亡率为36.67%,优于对照;而低浓度(0.1 mg/mL)处理组随着时间的推移,校正死亡率增幅不大,其5 d 较3 d的校正死亡率仅为3.33%。以机率值分析法分别对上述结果进行拟合,得其处理后3 d和5 d的LC50值分别为2.61 mg/mL和0.91 mg/mL,卡方检验证实其卡方值均小于7.81,说明试验结果真实可靠。
2.2 对斜纹夜蛾初孵幼虫的杀虫活性
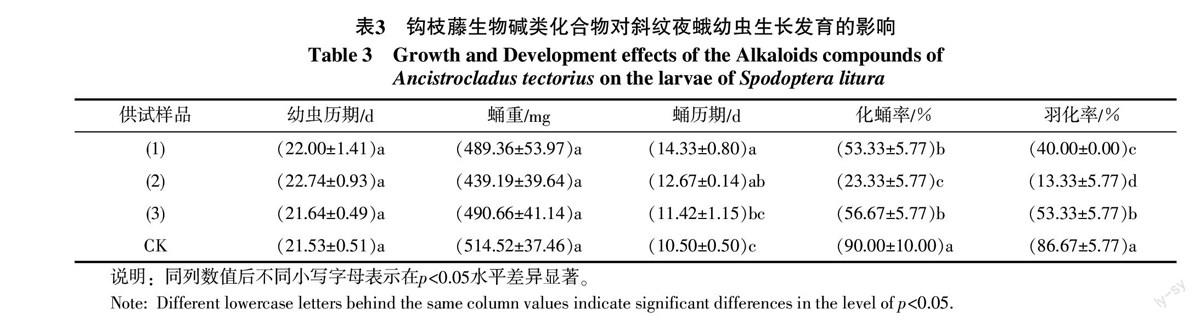
由表2可知,钩枝藤生物碱单体化合物(1)~(3)对斜纹夜蛾初孵幼虫均具有一定的毒杀活性,其中化合物(2)和化合物(3)的毒杀作用较高,第20天的校正死亡率分别为35.93%和37.00%,虽然高于化合物(1),但其活性强度间无显著性差异,说明上述化合物(1)~(3)对斜纹夜蛾幼虫的毒杀活性强度效果相当。
在试虫发育期,对照组约21 d即可正常化蛹,而经钩枝藤单体化合物(1)~(3)处理后的试虫,对幼虫期的影响不大。对斜纹夜蛾幼虫的蛹期有较大影响,其中化合物(1)的蛹期最长,约为14 d,而对照组蛹期只需约10 d。处理组存活幼虫均能正常化蛹和羽化,其化蛹率和羽化率均明显低于对照组,其中化合物(2)的幼虫期所需的时间最长为22.74 d,而对照所需时间为21.53 d;化蛹率(23.33%)、羽化率(13.33%)最低,显著低于对照,对照对应的化蛹率、羽化率分别为:90.00%和86.67%(见表3)。
3 讨论与结论
植物生物碱是植物在与昆虫协同进化过程中形成的一大类具有防御功能的次生代谢物质,种类繁多,并且对昆虫具有毒杀、拒食、忌避、抑制生长发育、不育、抗虫、引诱等多种生物活性[38]。具有杀虫活性的生物碱在环境中容易降解,作用方式独特,对天敌和有益生物安全,不易产生抗药性,符合人们对理想杀虫剂的要求[39]。自第一个烟碱类杀虫剂吡虫啉问世以来,已有苦参碱、百部碱、藜芦碱、雷公藤碱、小檗碱等几十种被开发利用[40-42],且多数现已进入工业化生产。因而,对生物碱类化合物的市场开发前景广阔,结合本研究,有望从钩枝藤生物碱中开发出新型植物源杀虫剂。
本研究发现钩枝藤总生物碱以及3个单体生物碱类化合物(1)~(3)对斜纹夜蛾幼虫具有一定的杀虫活性,化合物(1)~(3)均为异喹啉类生物碱,其中(1)为萘基四氢异喹啉类生物碱,其为钩枝藤的主要成分;(2)为萘基二氢异喹啉类生物碱;(3)为无萘基取代的异喹啉类生物碱。从已报道的异喹啉类生物碱来看,其主要的生物活性表现在抗菌、抗氧化、抗疟、抗肿瘤、抗HIV方面。异喹啉类生物碱的生物活性与其结构有着密切的关系,如N原子的烷基化会使抗菌活性增加;具有萘基异喹啉骨架结构的化合物具有较好的抗疟效果;芳香环上的羟基数目增加以及N的季铵化可明显增加抗肿瘤活性等[43]。然而,对于异喹啉类生物碱的杀虫或抗虫活性则鲜有报道,Bringmann等[44]将从与钩枝藤同属的植物A. congolensis叶中提取到的生物碱Dioncophylline A添加到草地夜蛾(Spodoptera littoralis)幼虫的人工饲料中,结果发现,20 d后幼虫的死亡率明显增高。其结构中OH官能团的变形可能是导致活性明显增强的原因。结合本研究,钩枝藤总碱对斜纹夜蛾幼虫有较强的毒杀活性,随着浓度的升高和时间的延长,幼虫的死亡率也随之增加,其中第3天和第5天的LC50值分别为2.61 mg/mL和0.91 mg/mL。但3个单体化合物对害虫主要表现为抑制生长发育作用,虽然在处理前期对害虫影响不大,但在处理后20 d也表现出较高的活性,明显影响害虫化蛹,大部分幼虫在蛹期死亡,处理组化蛹率和羽化率显著低于对照,这与Breuer等[45]报道植物生长调节剂[(E)-5-(2-bromovinyl)-2'-deoxyuridine]对草地贪夜蛾(Spodoptera frugiperda)的杀虫活性主要表现为抑制生长发育作用,显著影响幼虫化蛹等现象一致。此外,因植物中的活性成分往往存在协同或微量元素未分离获得等原因,本研究也发现所分离获得的3个活性化合物活性较低,可能是化合物间存在协同作用,也可能是含量较少的微量元素未分离获得,故接下来的工作将进一步对其杀虫成分进行进一步的分离,并进一步讨论其构效关系。
《“十二五”生物技术发展规划》中明确指出:“十二五”期间,开展生物农药、生物肥料、绿色植物生长调节剂等绿色农用产品应用的示范试点、普及以及研究和开发。尽管植物源生物碱在农药中所占份额还较小,但生物碱已经成为未来生物农药发展中的一种趋势和方向[46]。此外,钩枝藤在国内以海南分布最为广泛,在广西仅有零星分布,因此充分利用海南丰富的植物资源开发新型植物源农药,将为海南农产品的质量安全提供有力的技术支撑。
参考文献
[1] 华南农学院. 农业昆虫学(下册)[M]. 北京: 农业出版社, 1981: 691-692.
[2] 秦厚国, 叶正襄, 黄水金, 等. 不同寄主植物与斜纹夜蛾喜食程度、 生长发育及存活率的关系研究[J]. 中国生态农业学报, 2004, 12(2): 40-42.
[3] 蒙显标, 陈 强, 陆寿成. 斜纹夜蛾在南宁市郊区暴发[J]. 植物保护, 1988, 14(6): 51.
[4] 方贵平. 苏南地区斜纹夜蛾发生特点及防治对策[J]. 长江蔬菜, 1996(1): 13-14.
[5] 韩新才, 肖国蓉, 龚 进, 等. 几种药剂对甘蓝上斜纹夜蛾的田间防效试验[J]. 植物保护, 2003, 29(4): 53-54.
[6] 周 郑. 烟碱和芸香苷对斜纹夜蛾药剂敏感性及相关酶活性的影响[J]. 农药学学报, 2007, 9(3): 305-308.
[7] 童红云. 雷公藤、 黄杜鹃对菜青虫的毒理效应及防治研究[D]. 广州: 华南农业大学, 1986.
[8] 陈 旭, 王迎儿, 王燕燕, 等. 白前提取物对斜纹夜蛾拒食活性的研究[J]. 中国生物防治, 2009, 25(增1): 36-39.
[9] 陈焕镛. 海南植物志(第一卷)[M]. 北京: 科学出版社, 1964: 515.
[10] Wang Y Z, Gereau R. Ancistrocladaceae[M]// Wu Z Y, Raven P H. Flora of China Vol.13. Beijing: Science Press, 2007: 208.
[11] 钟 坚. 钩枝藤科新分布[J]. 广西林业科技资料, 1980(3): 44.
[12] 莫新礼, 钟业聪. 广西的新植物[J]. 广西植物, 1987, 7(4): 287-291.
[13] 陈伟球. 广东植物志(第三卷)[M]. 广东: 科技出版社, 1998: 157.
[14] Wiart C, Mogana S, Khalifah S, et al. Antimicrobial screening of plants used for traditional medicine in the state of Perak, Pennisular Malaysia[J]. Fitoterapia, 2004, 75: 68-73.
[15] 戴好富等. 黎族药志(第二册)[M]. 北京: 中国科学技术出版社, 2008: 124.
[16] Zheng X L, Wei J H, Sun W, et al. Ethnobotanical study on medicinal plants around Limu Mountains of Hainan Island, China[J]. J Ethnopharmacol, 2013, 148: 964-974.
[17] Ruangrungsi N, Wongpanich V, Tantivatana P, et al. Traditional Medicinal Plants of Thailand, V. Ancistrotectorine, a New Naphthalene Isoquinoline Alkaloid from Ancistrocladus tectorius[J]. J Nat Prod, 1985, 48: 529-535.
[18] 陈政雄, 王保德, 秦国伟, 等. 钩枝藤中生物碱的分离和鉴定[J]. 药学学报, 1981, 16(7): 519-523.
[19] Bringmann G, Kinzinger L. (+)-Ancistrocline, A naphthylisoquinoline alkaloid from Ancistrocladus tectorius[J]. Phytochemistry, 1992, 31(9): 3 297-3 299.
[20] Montagnac A, Hamid A, Hadi A, et al. Isoquinoline Alkaloids from Ancistrocladus tectorius[J]. Phytochemistry, 1995, 39: 701-704.
[21] Manfredi K P, Britton M, Vissieche V, et al. Three new Naphthyldihydroisoquinoline Akaloids from Ancistrocladus tectorius[J]. J Nat Prod, 1996, 59: 854-859.
[22] Tang C P, Yang Y P, Zhong Y, et al. Four new Naphthylisoquinoline Alkaloids from Ancistrocladus tectorius[J]. J Nat Prod, 2000, 63: 1 384-1 387.
[23] Tang C P, Xin Z Q, Li X Q, et al. Two New Naphthylisoquinoline Alkaloids from stems and leaves of Ancistrocladus tectorius[J]. Nat Prod Res, 2010, 24(11): 989-994.
[24] 苏志恒. 钩枝藤化学成分的研究[D]. 沈阳: 沈阳药科大学, 2007: 1-61.
[25] 刘明生, 苏志恒, 张俊清, 等. 钩枝藤茎枝生物碱类成分的研究[J]. 中国药学杂志, 2008, 43(14): 1 060-1 063.
[26] Xu M J, Bruhn T, Hertlein B, et al. Shuangancistrotectorines A-E, Dimeric Naphthylisoquinoline Alkaloids with Three Chiral Biaryl Axes from the Chinese Plant Ancistrocladus tectorius[J]. Chemistry, a European Journal, 2010, 16: 4 206-4 216.
[27] Jiang C, Li Z L, Gong P, et al. Five novel naphthylisoquinoline alkaloids with growth inhibitory activities against human leukemia cells HL-60, K562 and U937 from stems and leaves of Ancistrocladus tectorius[J]. Fitoterapia, 2013, 91: 305-312.
[28] 蔡彩虹. 钩枝藤枝条的生物活性成分研究[D]. 海南: 海南大学, 2013: 1-65.
[29] Bringmann G, Zhang G L, Olschlager T, et al. Highly selective antiplasmodial naphthylisoquinoline alkaloids from Ancistrocladus tectorius[J]. Phytochemistry, 2013, 91: 220-228.
[30] Said I M, Ahmad I B, Yahya M D, et al. Biological Activity Studies of Ancistrocladus tectorius[J]. Pharm Biol, 2001, 39(5): 357-363.
[31] 姜雯婷, 戴好富, 刘守柏, 等. 52种热带药用植物抗烟草青枯菌的体外活性筛选[J]. 微生物学杂志, 2011, 31(6): 15-18.
[32] 蔡彩虹, 梅文莉, 左文健, 等. 钩枝藤枝条中抗菌活性成分研究[J]. 热带亚热带植物学报, 2013, 21(2): 184-188.
[33] 陈政雄, 王保德, 秦伟国, 等. 钩枝藤中生物碱的分离和鉴定[J]. 药学学报, 1981, 16(7): 519-523.
[34] Bringmann G, Spuziak J, Faber J H, et al. Six naphthylisoquinoline alkaloids and a related benzopyranone from a Congolese Ancistrocladus species related to Ancistrocladus cogolensis[J]. Phytochemistry, 2008, 69(4): 1 065-1 075.
[35] Bringmann G. Schneider C. Pfeifer R M. et al. Two atropisomeric N-methyldioncophyllines A and N-methylphylline their naphthalene-free heterocyclic moiety, from Ancistrocladus barteri[J]. Z Naturforsch, 2003, 58b: 577-584.
[36] 于伟丽, 张升国, 刘永强, 等. 5种药剂不同生测方法对甜菜夜蛾幼虫毒力比较[J]. 长江蔬菜, 2010(18): 116-118.
[37] 王洪凤, 孙明清, 刘 顺, 等. 萹蓄干粉及其提取物对棉铃虫生长发育的影响[J]. 草业学报, 2007, 16(8): 94-98.
[38] Kinghom A D. Alkaloids: Chemical and Biological Perspective[M]. Burlington: Burlington House, 1984.
[39] 朱 见, 沈以红. 植物生物碱的杀虫作用及应用[J]. 蚕学通讯, 2007, 27(4): 35-40.
[40] 刘成梅, 游 海. 天然产物有效成分的分离与应用[M]. 北京: 化学工业出版社, 2003.
[41] 罗万春, 慕立义, 李云寿. 植物源生物碱的杀虫作用[J]. 农药, 1997, 36(7): 11-13.
[42] 郝乃斌, 戈巧英. 中国植物源杀虫剂的研制与应用[J]. 植物学通报, 1999, 6(5): 495-503.
[43] 程轩轩, 王冬梅, 杨得坡. 异喹啉类生物碱的生物活性和构效关系研究进展[J]. 中草药, 200, 37(12): 1 900-1 904.
[44] Bringman G, Holenz J, Wiesen B, et al. Dioncophylline A as a growth-regarding agent against the herbivorous insect Spodoptera littoralis: structure-activity relationships[J]. J Nat Prod, 1997, 60(4): 342-347.
[45] 薛广厚, 范海延, 李 航, 等. 生物碱在植物源农药中的应用研究[J]. 北方园艺, 2009(6): 131-134.
[46] Breuer M, Loof A D, Balzarini J, et al. Insecticidal activity of the pyrimidine nucleoside analogue(E)-5-(2-bromovinyl)-2'-deoxyuridine(BVDU)[J]. Pest Manag Sci, 2005, 61: 737-741.
