核酸适体检测赭曲霉毒素A荧光方法的建立
2015-05-30桂海娈金庆日张亚军王晓杜杨永春邵春艳程昌勇卫芳芳杨梦华宋厚辉
桂海娈,金庆日,张亚军,王晓杜,杨永春,邵春艳,程昌勇,卫芳芳,杨 杨,杨梦华 ,宋厚辉
(浙江农林大学动物科技学院,浙江临安311300)
赭曲霉毒素A(Ochratoxin A,OTA)是曲霉属和青霉属产毒菌株的次级代谢产物[1],在被污染的食物和动物饲料中普遍存在,具有诱变性、免疫毒性、肾脏毒性和肝脏毒[2]。在香料、谷物、葡萄酒、动物饲料等农畜产品中都可检测到OTA 的存在[3],并直接威胁人和动物的健康安全[4]。我国食品安全国家标准规定食品中OTA 限量为5 μg/kg,欧盟则规定牛奶、奶粉中OTA 限量为零。
目前我国检测OTA 主要依靠薄层层析法(TLC)、高效液相色谱法(HPLC)[5]、酶联免疫吸附法(ELISA)[6]等。这些方法虽然具有特异性强、灵敏度高等特点,但使用的设备价格昂贵,样品处理繁琐,不适宜用于快速检测[7],其中酶联免疫吸附法基于抗体识别抗原的特异性反应,对抗体试验要求较高,试验周期较长,易出现假阳性结果。
核酸适体(Aptamer)是一条约由20 ~100 个核苷酸组成的单链寡核苷酸片段,可与靶物质特异性结合,可通过指数富集配体系统进化技术,利用连续筛选方法获得[8]。当靶物质存在时,核酸适体在范德华力、碱基堆积力等作用下折叠形成特殊的三级结构与之结合[9]。与传统的抗体相比,核酸适体具有制备方便,易修饰,亲和力高,稳定性好等特点[10],在生物传感器、荧光检测等方面得到广泛应用,如量子点法检测蛋白[11],碳纳米管-核酸适体传感器[12]。现有核酸适体检测OTA 方法主要有:磁性纳米颗粒法[13],电化学法[14]等。
本试验主要利用OTA 特异性核酸适体,利用荧光染料PicoGreen 对双链核酸的特异性结合原理,建立了一种检测OTA 的快速定量方法。PicoGreen 不结合单链核苷酸,仅识别并结合双链DNA 的螺旋沟,继而释放荧光[15]。特异性的核酸适体与OTA特异性结合后,多余、未结合OTA 核酸适体与互补链杂交生成双链 DNA。加入 PicoGreen 时,PicoGreen 识别溶液中的双链DNA。当PicoGreen 浓度一定时,反应体系中加入不同浓度的OTA,则反应液中的荧光强度不同,从而达到快速定量检测OTA 的目的。
1 材料与方法
1.1 仪器与试剂 96 孔板(Costar 2592,Conning 公司);荧光检测仪(SynergyTMH1,BioTek 公司);超纯水仪(D11921,Thermo Fisher Scientific 公 司)。OTA、黄曲霉毒素B1、伏马毒素、桔毒素和玉米赤霉烯酮等真菌毒素(Sigma Aldrich 公司)溶于乙醇,4℃保存备用;PicoGreen(P7581,Life Technologies 公司),初始浓度为200 ×。OTA 核酸适体序列[16],OTA 核酸适体互补链序列DNA1 由生工生物工程上海股份有限公司合成(表1)。

表1 单链寡核苷酸名称与序列
1.2 试验方法
1.2.1 PicoGreen 检测杂交双链 各取50 μL 核酸适体与互补链DNA1(浓度均为10 nmol/L)于95℃加热5 min,冰浴10 min。将核酸适体与DNA1 混匀于25℃反应5 min[17],加入10 μL PicoGreen 10 ×溶液避光反应,检测荧光强度(激发波长为480 nm,发射波长为520 nm)。本试验的缓冲液为:10 mmol/L Tris,120 mmol/L NaCl,5 mmol/L KCl,20 mmol/L CaCl2(pH 8.5)[18]。
1.2.2 PicoGreen 与双链DNA 反应时间优化 取50 μL OTA 核酸适体与等体积浓度DNA1 于25℃反应5 min,再加入10 μL PicoGreen 10 ×,荧光检测仪内连续检测30 min。
1.2.3 OTA 敏感性试验 25 μL 20 nmol/L 核酸适体与50 μL 不同质量浓度的OTA 溶液在96 孔板内混匀,25℃反应20 min[19]。加入25 μL 20 nmol/L DNA1 溶液反应5 min 后,再加入10 μL PicoGreen反应,检测荧光强度。
1.2.4 OTA 核酸适体特异性试验 分别将25 μL 20 nmol/L 核酸适体与50 μL 不同毒素反应于25℃反应20 min,OTA、黄曲霉毒素B1、伏马毒素、桔毒素和玉米赤霉烯酮浓度均为0 ~200 μg/L。步骤同1.2.3。
1.2.5 检测样品试验 同时使用本试验非标记荧光法与ELISA 方法检测样品。在含1%啤酒溶液内添加OTA,其中20份样品内含有OTA,10份样品无OTA,OTA 浓度在两种方法的检测范围内。非标记荧光法:25 μL 20 nmol/L 核酸适体与50 μL 样品混匀反应,步骤同1.2.3。ELISA 操作方法:100 μL BSA-OTA(0.5 mg/L)于微孔板上4℃包被过夜,PBS洗涤3 次,加入200 μL 5%脱脂牛奶,25℃孵育1 h,PBS 洗涤3 次。检测样品溶液时,每孔加入100 μL 样品混合液(24.2 mg/ L 鼠抗-OTA 溶于样品溶液,体积比为1∶1)25℃孵育1 h,每孔再加入100 μL HRP-羊抗鼠IgG 25℃孵育1 h。每孔加入100 μL 显色液TMB 混匀后于37℃恒温箱内显色10 min,每孔加入100 μL H2SO4终止液混匀,检测OD450nm,根据制作的标准曲线计算样品中OTA 含量。计算两种检测法间的Kappa 值[20]。
2 结果与分析
2.1 检测原理 PicoGreen 是一种定量检测双链DNA,灵敏度可达到1 μg/L 级别的荧光染料。结合双链DNA 后,PicoGreen 荧光强度增大1000 倍以上,且不受单链DNA 的干扰。OTA 特异性核酸适体可识别并结合OTA(图1)。结合OTA 后,核酸适体空间构象会随之发生变化,不再与其互补链结合;未与OTA 结合的核酸适体可与其互补链杂交形成双链DNA。反应体系中微量双链DNA 可通过加入PicoGreen 放大荧光信号,检测荧光强度,确定样品中的OTA 浓度。
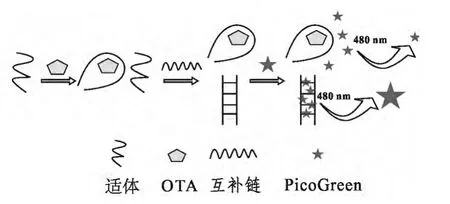
图1 OTA 荧光检测原理图
2.2 PicoGreen 检测核酸适体与互补链杂交产物双链DNA 检测表明,PicoGreen 检测核酸适体与互补链的杂交产物时荧光强度最大,与Tirs 缓冲液的荧光值相比,PicoGreen 本身无荧光;单链DNA(核酸适体、互补链)因自身形成少量二聚体产生微量荧光;PicoGreen 识别双链DNA 致荧光强度增大。因此,可用PicoGreen 检测双链DNA,核酸适体与互补链的杂交产物为双链DNA(图2)。
2.3 PicoGreen 与双链DNA 反应时间优化PicoGreen 被激发产生的荧光强度具有最大值。在核酸适体与其互补链反应体系中加入PicoGreen 后,PicoGreen 瞬间与双链DNA 结合,且在前3 min 随反应时间推移,荧光强度逐渐趋于稳定,说明PicoGreen 与双链DNA 结合已达到饱和(图3)。在特定PicoGreen 浓度下,双链DNA 越多,荧光强度越强,直到PicoGreen 完全结合双链DNA 为止;溶液中无双链DNA 时,荧光强度保持不变。因此,选择荧光值达峰值3 min 时为最适反应时间。

图2 PicoGreen 检测DNA
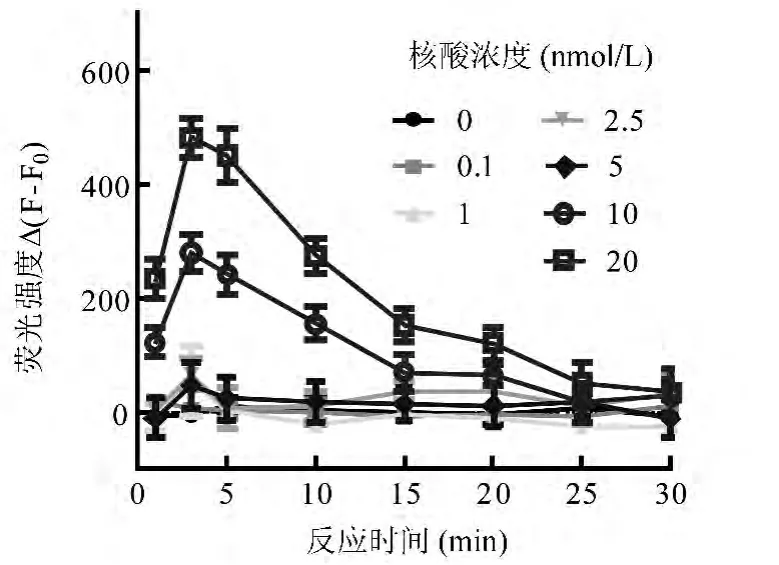
图3 PicoGreen 与双链DNA 反应时间优化
2.4 OTA 敏感性试验 随OTA 浓度增加,与OTA特异性结合的核酸适体越多,则核酸适体与互补链杂交生成的双链DNA 越少,PicoGreen 识别双链DNA 产生的荧光强度越弱(图4)。该法的最低检测限为1 μg/L(1 ppb),线性范围为1 μg/L(1 ppb)~200 μg/L (200 ppb),具有高灵敏度。
2.5 OTA 核酸适体特异性试验 为了确定OTA 核酸适体与PicoGreen 方法检测OTA 的特异性,在相同试验条件下,比较食品及饲料中常见黄曲霉毒素B1(AFB1)、桔毒素(CTN)、伏马毒素B1(FB1)和玉米赤霉烯酮(ZEN)的检测结果(图5)。毒素浓度相同时,OTA 存在的反应体系中释放的荧光强度最弱,表明OTA 核酸适体已与OTA 特异性结合,不再与其互补链结合。因此,溶液内无双链DNA,PicoGreen 激发产生的荧光强度最弱。其他霉菌毒素不能结合OTA 核酸适体,所以反应体系中的核酸适体互补链可以结合核酸适体,产生双链DNA,并结合PicoGreen 释放出荧光。图5说明该核酸适体能够特异性识别OTA,与FB1,AFB1,CTN 或ZEN,且无交叉反应。

图4 OTA 敏感性试验
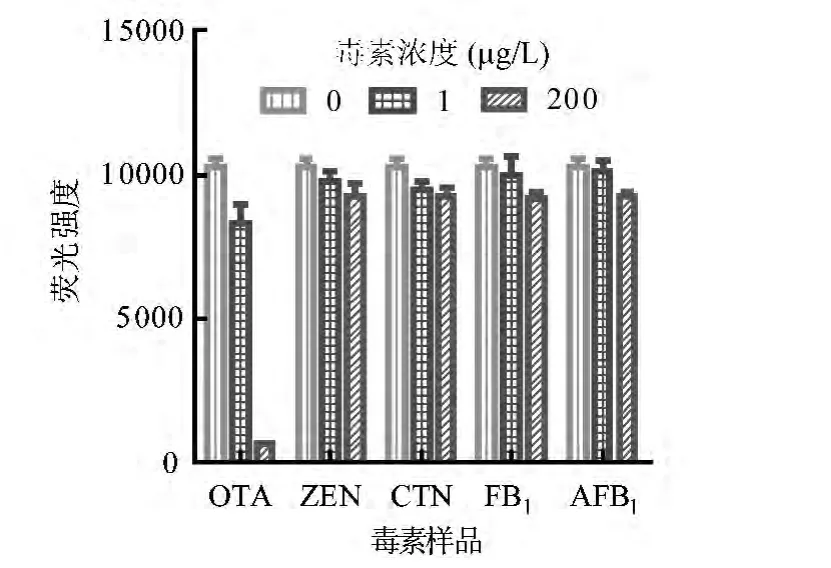
图5 OTA 核酸适体与PicoGreen 方法检测OTA 的特异性分析
2.6 核酸适体荧光检测方法与抗体ELISA 方法比较 为比较核酸适体荧光检测方法与抗体ELISA方法之间的一致性,试验对30份啤酒样品进行了检测(表2)。利用统计方法计算Kappa 值为0.857 >0.8(95%可信度),两种方法的检测结果高度一致,本方法可用于样品检测。

表2 荧光法与ELISA 方法比较(+阳性;-阴性)
3 小结与讨论
OTA 主要污染谷物及其制品、牛奶等,严重危害人体和动物健康[21]。目前OTA 检测主要采用试纸条比色法和色谱分析法[22],对检测样品前期处理要求较高,且抗体制备及保存成本较高。本试验建立的基于核酸适体与荧光染料PicoGreen 检测OTA的新方法,为霉菌毒素检测提供了新思路。
核酸适体是与抗体有相似功能的单链寡核苷酸,依靠特异性碱基识别、通过空间构象变化结合靶分子,已被广泛应用于检测领域。
本试验建立的检测方法,OTA 核酸适体特异性较强,与其他常见霉菌毒素无交叉反应。通过检测PicoGreen 识别双链DNA 激发产生的荧光峰值可减少外因干扰,实时反应溶液OTA 量。检测灵敏度为1 μg/L,与传统常用的ELISA 法相比高度一致,Kappa 值达0.857,可在45 min 内完成检测。检测方法特异性较强,灵敏度较高,具备快速、易操作等特点。
[1]Delage N,D'harlingue A,Colonna Ceccaldi B,et al.Occurrence of mycotoxins in fruit juices and wine[J].Food Control,2003,14(4):225-227.
[2]Scherlach K, Graupner K, Hertweck C.Molecular bacteria-fungi interactions:effects on environment,food,and medicine[J].Annu Rev Microbiol,2013,67:375-397.
[3]Monaci L,Palmisano F.Determination of ochratoxin A in foods:state-of-the-art and analytical challenges[J].Anal Bioanal Chem,2004,378(1):96-103.
[4]Moretti A,Susca A,Mule G,et al.Molecular biodiversity of mycotoxigenic fungi that threaten food safety[J].Int J Food Microbiol,2013,167(1):57-66.
[5]Kralj Cigic' I,Prosen H.An Overview of Conventional and Emerging Analytical Methods for the Determination of Mycotoxins [J].International Journal of Molecular Sciences,2009,10(1):62-115.
[6]Hianik T.Biosensors for Detection of Ochratoxin A[J].International Journal of Molecular Sciences,2012:193-211.
[7]Kaushik A,Arya S K,Vasudev A,et al.Recent Advances in Detection of Ochratoxin-A[J].Open Journal of Applied Biosensor,2013,2(1):1-11.
[8]D.Ellington A,W.Szostak J.Selection in vitro of singlestranded DNA molecules that fold into specific ligandbinding structures[J].Nature,1992,335(27):850-852.
[9]Jayasena S D.Aptamers:An Emerging Class of Molecules That Rival Antibodies in Diagnostics [J].Clinical Chemistry,1999,45(9):1628-1650.
[10]Song S,Wang L,Li J,et al.Aptamer-based biosensors[J].Trends in Analytical Chemistry,2008,27(2):108-117.
[11]Bagalkot V,Zhang L,Levy-Nissenbaum E,et al.Quantum Dot-Aptamer Conjugates for Synchronous Cancer Imaging,Therapy and Sensing of Drug Delivery Based on Bi-Fluorescence Resonance Energy Transfer[J].Nano Lett.,2007,7(10):3065-3070.
[12]Zhu Z,Yang R,You M,et al.Single-walled carbon nanotube as an effective quencher[J].Anal Bioanal Chem,2010,396(1):73-83.
[13]Barthelmebs L, Hayat A, Limiadi A W, et al.Electrochemical DNA aptamer-based biosensor for OTA detection,using superparamagnetic nanoparticles[J].Sensors and Actuators B:Chemical,2011,156(2):932-937.
[14]Lee J,Jeon C H,Ahn S J,et al.Highly stable colorimetric aptamer sensors for detection of ochratoxin A through optimizing the sequence with the covalent conjugation of hemin[J].Analyst,2014,139(7):1622-1627.
[15]Ahn S J,Costa J,Emanuel J R.PicoGreen quantitation of DNA:effective evaluation of samples pre-or post-PCR[J],1996,24(13):2623-2625.
[16]Cruz-Aguado J A,Penner G.Determination of Ochratoxin A with a DNA Aptamer[J].J.Agric.Food Chem.,2008,56(22):10456-10461.
[17]Chen J,Fang Z,Liu J,et al.A simple and rapid biosensor for ochratoxin A based on a structure-switching signaling aptamer[J].Food Control,2012,25(2):555-560.
[18]Zhao Q, Geng X, Wang H.Fluorescent sensing ochratoxin A with single fluorophore-labeled aptamer[J].Anal Bioanal Chem,2013,405(19):6281-6286.
[19]Yang C,Lates V,Prieto-Simon B,et al.Rapid highthroughput analysis of ochratoxin A by the self-assembly of DNAzyme-aptamer conjugates in wine[J].Talanta,2013,116:520-526.
[20]Landis J R,Koch G G.The Measurement of Observer Agreement for Categorical Data[J].Biometrics,1977,33(1):159-174.
[21]Klaric' M Š,Rašic' D,Peraica M.Deleterious Effects of Mycotoxin Combinations Involving Ochratoxin A[J].Toxins,2013,5(11):1965-1987.
[22]Zheng M Z,Richard J L,Binder J.A review of rapid methods for the analysis of mycotoxins [J].Mycopathologia,2006,161(5):261-273.
