Fas途径调控芬太尼与5-氟尿嘧啶联合诱导MCF-7乳腺癌细胞凋亡
2015-05-29王志学张晓侠苏天亮
王志学 张晓侠 雷 燕 李 艳 苏天亮
(承德医学院附属医院麻醉科,河北 承德 067000)
近年来,肿瘤综合治疗的实施使乳腺癌的死亡率逐年下降,癌痛治疗愈显重要。前期研究证实〔1~3〕,一定浓度的吗啡、5-氟尿嘧啶(5-FU)及联合应用48 h对人乳头癌细胞株MCF-7有促进凋亡作用,并显著上调Fas表达和半胱氨酸蛋白酶(Caspase)-8活性,两药联合应用启动外源性凋亡途径具有协同作用,并且与其中吗啡的浓度有一定的剂量依赖关系。报道显示〔4~6〕,芬太尼对MCF-7人乳腺癌细胞剂量依赖性地抑制增殖、促进凋亡,显著减少肿瘤细胞所致的组织破坏。本文旨在探讨芬太尼与5-FU联合应用对乳腺癌细胞的凋亡。
1 材料和方法
1.1 材料
1.1.1 主要试剂和仪器 细胞凋亡检测试剂盒(Annexin VEGFP),南京凯基生物科技发展有限公司;碘化丙啶(PI),美国Sigma公司;RPMI1640培养基,GIBCOBRL公司;胎牛血清,天津血液学研究所;胰蛋白酶,中国医学科学院血研所科技公司;鼠抗人Fas及Caspase-8、Western印迹单克隆抗体,福州迈新生物技术有限公司;β-actin一抗、山羊抗鼠Western印迹二抗,美国Santa Cruz公司。YT-CJ-1N超净工作台,北京亚泰科隆实验科技开发中心;FACSCalibur流式细胞仪,美国B&D公司;CO2电热恒温培养箱,日本SANYO公司;LD5-IA低速离心机,北京雷勃尔离心机有限公司;QL-901振荡器,中国其林贝尔;荧光倒置显微镜,日本尼康;光学显微镜、倒置显微镜,日本OLYMPUS。
1.1.2 实验药物 芬太尼注射液,宜昌人福药业;5-FU注射液,上海旭东海普药业。MCF-7,南京凯基生物科技发展有限公司。
1.2 方法
1.2.1 细胞培养 细胞复苏成功后,调整浓度为1×106/ml接种于培养瓶,静置于37℃、5%CO2、100%湿度的培养箱内,用RPMI1640完全培养液进行培养,隔日换液。观察待贴壁70% ~80%时,用0.25%胰蛋白酶消化传代。
1.2.2 实验分组 共分为8组,分别用含不同药物的RPMI1640完全培养液培养。U组(未处理组)即对照组,LF组为0.1μmol/L,MF组为1μmol/L,HF组为10μmol/L芬太尼处理组,FU组为 500μmol/L 5-FU处理组,LF+FU组为0.1μmol/L芬太尼与500μmol/L 5-FU联合处理组,MF+FU组为1μmol/L芬太尼与500μmol/L 5-FU联合处理组,HF+FU组为10μmol/L芬太尼与500μmol/L 5-FU联合处理组。
1.2.3 流式细胞术(FCM)检测Annexin V-EGFP/PI染色的细胞凋亡情况 取对数生长期的细胞,调整细胞浓度约5×105/ml接种于25 ml细胞培养瓶,其贴壁后更换为含不同药物的培养液(详见1.2.2)5 ml,每组5瓶,孵育48 h。届时吸弃上清,消化、磷酸盐缓冲液(PBS)洗涤,收集细胞(约106/ml以上)于离心管;4℃低速离心缓冲液1 500 r/min、5 min后弃上清,重悬于500μl的 Binding Bufferr溶液,加入 5μl Annexin V-EGFP及5μl PI,混匀,室温避光反应15 min;1 h内流式细胞仪上机检测。
1.2.4 Western印迹检测Fas、Caspase-8表达 另取对数生长期细胞,以5×105/ml接种于25 ml培养瓶内,其贴壁后更换含不同药物的培养液(详见1.2.2),每组5瓶,孵育48 h。充分裂解,4℃高速离心,取上清-80℃保存。二喹啉甲酸(BCA)法行蛋白质浓度测定;煮沸变性、冰浴;蛋白电泳,转膜,封闭。分别加入Fas及Caspase-8一抗、β-actin一抗,4℃孵育过夜。洗膜,加入二抗,室温2 h。曝光、定影、扫描,软件分析目的条带的灰度值及相应β-actin条带的灰度值,以两者比值表示目的蛋白的相对表达量。
1.3 统计学分析 采用SPSS11.5软件进行处理,所有数据资料以x±s表示,进行单因素方差分析与析因设计方差分析,两两比较用LSD-t检验;实验组Fas、Caspase-8变化作Pearson相关分析。
2 结果
2.1 各组凋亡率变化情况 与U组相比,单独应用芬太尼处理时1μmol/L及10μmol/L组均引起凋亡率增加(P<0.05,P<0.01),单独应用500μmol/L 5-FU后凋亡率亦明显增加(P<0.01);芬太尼与5-FU联合应用,各组较单独应用5-FU或该浓度芬太尼单独应用相比,凋亡率均明显增加,且均具有协同作用(P<0.01)。且凋亡率随其中芬太尼浓度增加依次增加。见表1。
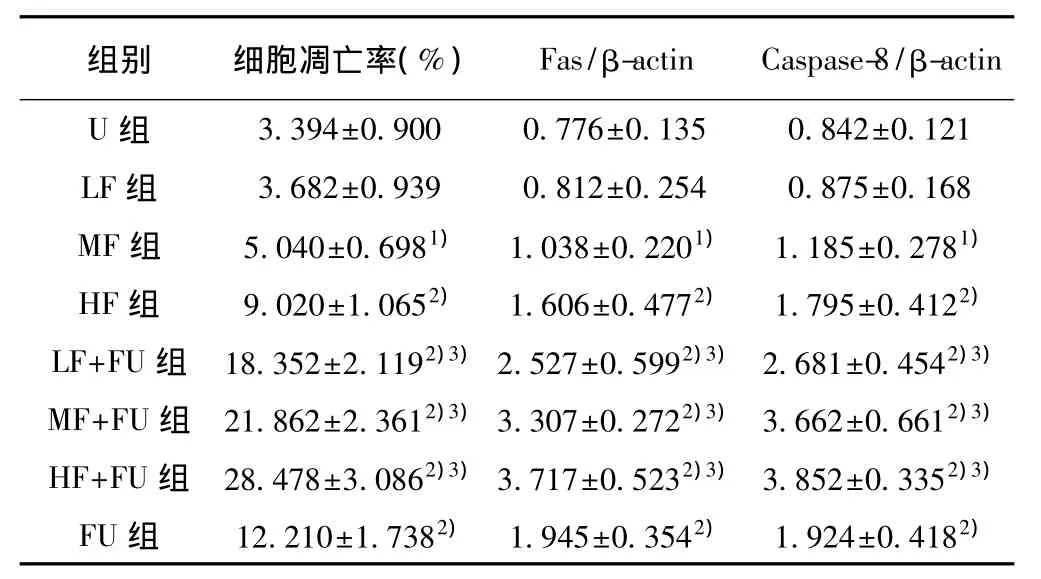
表1 处理48 h各组细胞凋亡率及Fas、Caspase-8蛋白表达情况(x±s,n=5)
2.2 Fas、Caspase-8表达情况 与U组相比,单独应用芬太尼处理1μmol/L及10μmol/L组均引起Fas、Caspase-8表达增强(P<0.05,P<0.01),500 μmol/L 5-FU 单独应用后 Fas、Caspase-8表达增强(P<0.01);芬太尼与5-FU联合应用,各组较单独应用5-FU或该浓度芬太尼单独应用相比,Fas、Caspase-8表达均明显增强,且均具有协同作用(P<0.01)。实验组Caspase-8活性变化与实验组Fas抗原表达变化作Pearson相关分析表明两者之间呈显著正相关(r=0.877,P<0.01)。见表1。
3 讨论
阿片类药物通过多种机制影响肿瘤细胞生长,芬太尼抑制肿瘤生长的机制之一即是诱导凋亡〔4~6〕。化疗中的常用药物5-FU可通过多种途径诱导肿瘤细胞凋亡亦早已证实。
对人类来说,诱导凋亡主要有外源性凋亡途径和内源性凋亡途径。外源性凋亡途径又称死亡受体途径,是通过细胞膜上的死亡受体,最典型的是Fas糖蛋白和肿瘤坏死因子(TNF)受体I激活,一旦细胞受到某些凋亡信号刺激,Fas被Fas-L占据后会导致受体聚合,向Fas表达的细胞内传递死亡信号,通过其死亡相关域蛋白(FADD)DED结构域募集并激活Caspase-8,形成死亡诱导信号复合体(DISC),进而触发Caspase酶系级联反应导致细胞凋亡〔7,8〕。阿片样物质可促进Fas诱导的细胞死亡早在1999 年就被 Yin 等〔9〕提出,Tegeder等〔10〕又检测出吗啡对MCF-7和MDA-MB231乳腺癌细胞处理后均引起Fas表达增加。而后,Yin等〔11〕又证实了吗啡诱导的多种肿瘤细胞株凋亡或坏死,其机制之一可能就是激活Fas/FasL基因家族等一系列信号通路,通过促凋亡的FADD/P53通路和抗凋亡P13K/Art/核转录因子(NF-κB)通路综合作用调控细胞凋亡。本研究发现,单独应用1μmol/L、10μmol/L芬太尼处理时,通过显著上调Fas表达、Caspase-8激活,启动外源性凋亡途径来诱导凋亡。5-FU可能通过激活Caspase、上调Fas受体的表达诱导肿瘤细胞凋亡的治疗机制亦早已证实〔12,13〕,本研究结果中单独应用500μmol/L 5-FU后显著上调Fas表达、Caspase-8激活也正与此吻合。说明两药联合应用可能在通过死亡受体途径发挥协同作用促进细胞凋亡。这无疑为与化疗同时实施的阿片类药物癌痛治疗增加了信心,另外其研究结果也可为乳腺癌患者手术麻醉及术后镇痛制定合理方案提供一定的理论依据。
1 王志学,孙立新,宋有鑫,等.不同浓度吗啡与5-氟尿嘧啶联合应用对MCF-7乳腺癌细胞增殖凋亡的影响〔J〕.广东医学,2012;33(19):2881-4.
2 王志学,孙立新,李汝泓,等.不同浓度的吗啡与5-氟尿嘧啶联合应用MCF-7乳腺癌细胞凋亡与细胞周期的影响〔J〕.中国老年学杂志,2012;32(15):3223-6.
3 王志学,刘新伟,李汝泓,等.不同浓度吗啡与5-氟尿嘧啶联合应用通过Fas途径诱导MCF-7乳腺癌细胞凋亡的体外研究〔J〕.实用医学杂志,2013;29(8):1212-4.
4 张咸伟,丁汉琳,张传汉,等.芬太尼MCF-7细胞增殖和细胞周期影响研究〔J〕.中国医师杂志,2005;7(1):23-5.
5 丁汉琳,张咸伟,张传汉.芬太尼影响MCF-7细胞凋亡的实验研究〔J〕.实用医学杂志,2004;20(12):1351-3.
6 El Mouedden M,Meert TF.The impact of the opioids fentanyl and morphine on nociception and bone destruction in a murine model of bone cancer pain〔J〕.Pharmacol Biochem Behav,2007;87(1):30-40.
7 Gu Q,Wang JD,Xia HH,et al.Activation of the caspase-8/Bid and Bax pathways in aspirin-induced apoptosis in gastric cancer〔J〕.Carcinogenesis,2005;26(3):541-6.
8 Hacker G,Weber A.BH3-only proteins trigger cytochrome c release,but how〔J〕?Arch Biochem Biophys,2007;462(2):150-5.
9 Yin D,Mufson RA,Wang R,et al.Fas-mediated cell death promoted by opioids〔J〕.Natrure,1999;397(6716):218.
10 Tegeder I,Grosch S,Schmidtko A,et al.G protein-independence G1cell cycle block and apoptosis with morphine in adenocarcinoma cell:in-volvement of p53 phosphorylation〔J〕.Cancer Res,2003;63(8):1846-52.
11 Yin D,Woodruff M,Zhang Y,et al.Morphine promotes Jurkat cell apoptosis through pro-apoptotic FADD/P53 and anti-apoptotic P13K/Art/NF-kappaB pathway〔J〕.JNeuroimmunol,2006;174(1-2):101-7.
12 Johnstone R,Ruefli A,Lowe S,et al.Apoptosis:a link between cancer genetics and chemotherapy〔J〕.Cell,2002;108(2):153-64.
13 Eichhorst ST,Muerkoster S,Weigand MA,et al.The chemotherapeutic drug 5-fluorouracil induces apoptosis in mouse thymocytes in vivo via activation of the CD95(APO-1/Fas)system〔J〕.Cancer Res,2001;61(1):243-8.
