因传染性胃肠炎死亡的转基因克隆仔猪的临床病理分析和初步分子鉴定
2015-05-28赵雪艳赵科伟王小鹏王成斌何小芳邱青松程玉柱崔磊磊幸宇云
赵雪艳,洪 渊,赵科伟,王小鹏,杨 强,王成斌,何小芳,邱青松,程玉柱,崔磊磊,任 军,幸宇云
(江西农业大学 动物生物技术国家重点实验室培育基地,江西 南昌 330045)
1997年,世界上第一头体细胞克隆动物——“多莉”羊诞生[1],同年,首次通过体细胞克隆获得的转基因动物——转人凝血因子IX基因的转基因山羊问世[2]。此后以体细胞克隆介导的动物转基因技术获得了迅猛的发展[3],其中转基因克隆猪的研究也收获了诸多成果[4]。然而,克隆动物被认为存在一定的缺陷,如脏器大小异常、健康状况不良等[5];而针对转基因生物安全性的争论在全世界广泛存在。
动物脏器系数是指动物某脏器的质量与其体质量之比值,该指标常用于毒理学实验中,对评估动物组织形态学、脏器质量、动物功能和健康状况具有重要的参考价值[6-7]。因此研究转基因克隆猪的脏器系数水平对评估其功能状态及生物安全性具有重要的意义。迄今为止,有关转基因或克隆动物脏器系数的研究报道有限。SÜVEGOVÁ等的研究结果发现转基因兔与非转基因兔相比除肺外其余6个脏器系数均无显著差异[8]。田小芸的研究表明转EGFP基因雄性和雌性小鼠的肺、脑、肾上腺系数差异极显著(P<0.01),而心、肝、脾、肾脏系数间差异不显著(P>0.05)[9]。Piedrahita 等报道克隆猪与非克隆猪相比其部分器官的重量存在更大的表型变异,并认为这很可能是源于表观遗传的异常[10]。目前未见有关转基因克隆猪脏器系数的报道。
此外,在获得转基因动物之后,对其进行系统的分子鉴定是首当其冲的任务,这些鉴定包括DNA水平的PCR鉴定和外源基因拷贝数检测、RNA和蛋白质水平的外源基因表达水平鉴定等。而在DNA水平上对转基因动物的分子检测是最基本、最初步的检测,也是后续表型研究和基因功能探讨的前提。
骨形态发生蛋白IB(BMPR-IB)基因是在羊中首次被鉴定的影响多羔性状的主效基因,其A746G突变位点被发现会显著影响布鲁拉美利奴绵羊的排卵率[11]。然而到目前为止,在哺乳动物中,该突变位点仅在绵羊和山羊中被发现[12-13]。在前期研究中,我们先构建了pEF-BMPRIB(CDS)-Neo载体(图1),其中的CDS区人为地导入了羊BMPR-IB基因的A746G多羔突变位点;之后通过脂质体法将pEFBMPRIB(CDS)-Neo载体转染入大白猪胎儿成纤维细胞中、经G418筛选后挑选单克隆细胞系、利用传统体细胞克隆方法制备转基因克隆猪[14],最终成功获得了一批转基因克隆猪,其中6头仔公猪因传染性胃肠炎在出生后9 d左右死亡。本研究记录了这些仔猪的临床症状,进行了解剖病理分析,测定了其多个部位的脏器系数,并开展了阳性鉴定、外源载体的完整性和拷贝数检测,以期对该批转基因克隆小猪的生物安全性和外源基因整合情况进行一个初步的评估。
1 材料与方法
1.1 实验材料
6头因病死亡的转BMPR-IB基因克隆仔公猪,供体为美系大白猪,死亡原因经实验室检测诊断为传染性胃肠炎,均为断奶前死亡,平均死亡日龄为9 d;纯种大白仔猪6头均为美系大白公猪,为分娩过程中因窒息或疫苗应激导致死亡的0~5日龄小猪。
1.2 实验方法
1.2.1 因腹泻死亡仔猪的病理观察和脏器系数分析 体细胞克隆转基因小猪出生后由专人24 h轮流护理,详细记录发病个体的发病症状。死亡后的小猪即刻进行体质量称量、解剖、脏器取样和称质量,如若未及时解剖先放入-20℃冰箱保存。解剖时先固定取背卧位,用手术刀打开胸腔和腹腔,分别取出心脏、肺、胃、肝脏、脾、左肾、右肾器官,将胃里的内容物清理干净,对心脏、肺、肝脏、脾、肾脏等器官剔除筋膜和脂肪并将表面的血液或其它液体成分用滤纸吸干;用手术剪和手术刀配合打开头部以取得大脑。用电子秤分别称量这些器官的质量。对于死亡的转基因克隆仔猪,解剖后观察其脏器病理特症并对典型症状拍照。
普通纯种大白仔猪也以同样的方法解剖,称取器官质量。
脏器系数的计算方法为:脏器系数=实验动物某脏器的质量(kg)/实验动物的体质量(kg),脏器系数结果均以平均数±标准误(Mean±SE)的形式表示,采用SAS软件的T-Test进行统计分析。
1.2.2 PCR鉴定 采集转基因仔猪耳组织样品,用酚氯仿法提取猪基因组 DNA,用 Nanodrop 1000测量DNA浓度后,将其调成40~60 ng/μL的工作液。利用Primer 3在线软件(http://frodo.wi.mit.edu/),跨外源载体序列的不同区域设计5对引物,引物位置见图1,引物序列和PCR扩增退火温度见表1。

图1 外源载体pEF-BMPRIB(CDS)-Neo结构图及PCR鉴定引物设计Fig.1 The diagram of exogenous pEF-BMPRIB(CDS)-Neo vector and primers design for PCR detection

表1 转基因仔猪PCR鉴定引物Tab.1 Primers used for PCR detection of tansgenic piglets
1.2.3 构建GAPDH-NEO双基因同质粒载体 利用Primer 3软件,根据GAPDH、NEO的基因序列,设计特异性引物NEO-FP/RP和GAPDH-FP/RP进行PCR反应。然后以2种基因PCR产物1∶1混合物为模板,以扩增GAPDH基因的前引GAPDH-FP和扩增NEO基因的后引NEO-RP分别为前后引物进行PCR扩增,从而将GAPDH基因和NEO基因桥连。PCR扩增均采用25μL体系,10×buffer(含20μmol/Lmg2+)2.5 μL,10 mmol/L dNTP 0.5 μL,10 μmol/L 上、下游引物各1 μL,模板 DNA(40 ~60 ng/μL)2 μL,用超纯水补齐体系。PCR扩增均利用Touchdown程序:94℃ 5 min;94℃ 30 s,68℃ 30 s每个循环降低0.5 ℃,72℃ 1min,循环26次;94℃ 30 s,55℃ 30 s,72℃ 1min,循环14次;72℃ 10min;4℃保存。

表2 构建GAPDH-NEO双基因同质粒载体及检测拷贝数所用的引物和探针Tab.2 Primers and probes used for producing a p lasm id vector containing GAPDH-NEO gene and detecting copy numbers
PCR产物经琼脂糖凝胶电泳,将片段大小在907 bp的PCR产物割胶,使用PCR clean-up Gel extraction试剂盒(MACHEREY-NAGEL)进行DNA的回收纯化。回收后的产物与pGEM-T载体(Promega)进行TA连接,反应条件为16℃,2 h。将连接后的重组子转入Trans-5α感受态细胞,而后加入LB培养基扩繁感受态,将扩繁后的菌液均匀涂布于已加入IPTG、X-Gal和氨苄的固体培养基上进行蓝白斑筛选。挑选白斑菌落,移种在LA液体培养基中,经扩繁后取少量菌液,再以GAPDH-FP和NEO-RP为扩增引物进行PCR反应以证明菌落中含有目的片段GAPDH-NEO,反应体系和反应条件同1.2.3。另将PCR产物测序,以确定双基因质粒中GAPDH和NEO基因皆为单拷贝。经测序验证后,菌液用高纯度质粒小提中量试剂盒(TIANGEN)提取质粒。
1.2.4 Real Time PCR鉴定NEO基因拷贝数 NEO基因拷贝数的鉴定采用绝对定量的方法。先将得到的GAPDH-NEO双基因同质粒载体用Nanodrop 1000测其浓度,并稀释其浓度至0.08 ng/μL。以此浓度为起始浓度,以10倍间距依次级联稀释5个梯度作为标曲样品。以稀释后的标曲样品和待测转基因猪基因组DNA样品为模板扩增目的基因NEO和内参基因GAPDH,每个基因均做3次重复。利用premix EX TaqTM试剂盒(Takara)配制荧光定量PCR反应体系,反应采用20μL体系:DNA 1μL,Premix Ex TaqTM10 μL,10 μmol/L 正、反向引物各0.4 μL,探针 0.2 μL(表2),ROX II 0.4 μL,ddH2O 7.6 μL。上样于ABI 7500 fast定量PCR仪。反应程序为:50℃ 2 min;95℃ 10 min;94℃ 15 s,60℃ 1 min,循环40次。
2 结果与分析
2.1 死亡的转基因克隆仔猪临床症状及病理特征分析
该批仔猪发病时表现出集中爆发、死亡快等特点,发病仔猪均在表现腹泻后的1~3 d内死亡,其临床症状及病理解剖特征见表3。所有发病死亡的小猪均表现出腹泻及大便异常(粪便为乳白色、灰色或黄绿色),其中3头除此外还伴有发烧和咳嗽中的1~2个症状。病理解剖后发现,所有因腹泻死亡的仔猪均表现出小肠肿胀和胃部充有凝乳(图2),另有1头表现出小肠充血,除此外无其它明显眼观病变。

表3 转基因克隆死亡仔猪的临床症状和病理解剖特征Tab.3 Clinic and pathological anatom y sym ptom s of cloned transgenic died piglets
2.2 脏器系数分析
转基因克隆大白仔公猪和非转基因大白仔公猪之间脏器系数的比较结果见表4,除左肾和右肾系数存在显著差异(P<0.05)外,其它脏器系数均没有差异(P>0.05)。但是转基因克隆仔猪的脏器系数表现出了较高的变异系数。
2.3 转基因克隆仔猪的PCR鉴定
为全面分析外源基因导入宿主中的情况,本试验设计了5对跨载体序列不同区域的引物用于PCR扩增(图1,表1)。其中跨载体起始端到终止子区以及跨起始端到启动子区的两个长距离 PCR(Long-PCR),针对该6头转基因小猪均无任何扩增条带,说明外源基因序列部分或全部丢失(3A,3B);跨载体序列起始端到启动子区域前的PCR针对2、4、5个体有扩增结果,且片段大小与质粒的扩增片段一致(3C);扩增包含报告基因NEO的PCR显示所有的个体都有扩增结果且片段大小与阳性对照一致(3D);而跨外源载体关键区域—启动子和CDS区的PCR扩增结果显示只有1和5号个体有扩增结果(3E)。PCR鉴定结果表明虽然所有的6头克隆小猪均为转基因阳性个体,但没有1头小猪导入了完整的外源基因,其中4头个体部分或完整缺失了关键的启动子和CDS区。

图2 因腹泻死亡的转基因克隆仔猪的肠道Fig.2 Intestine of cloned transgenic piglets died of diarrhea
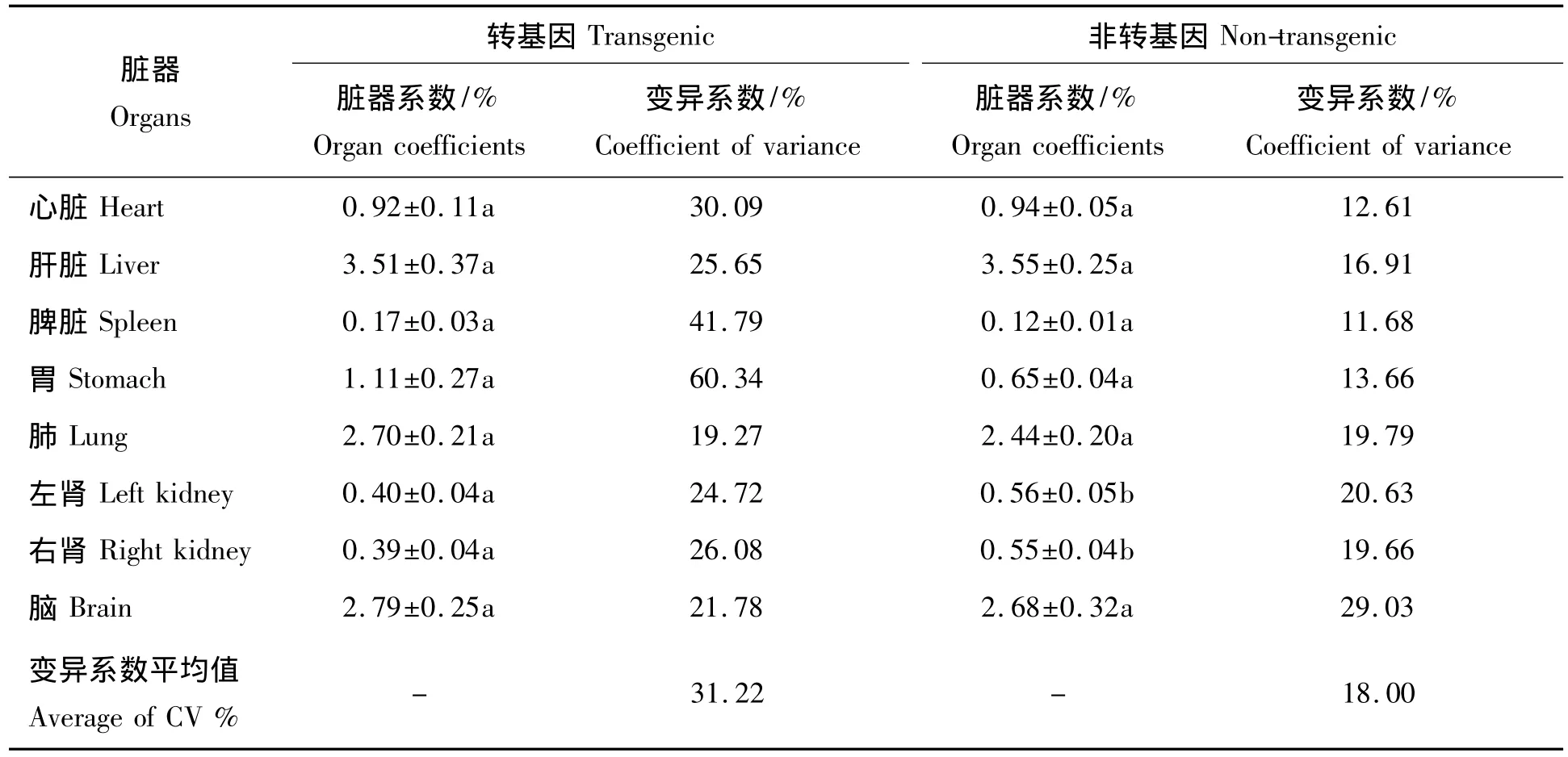
表4 转基因克隆猪与非转基因猪脏器系数的比较Tab.4 Com parison of organ coefficients between cloned transgenic and non-transgenic piglets
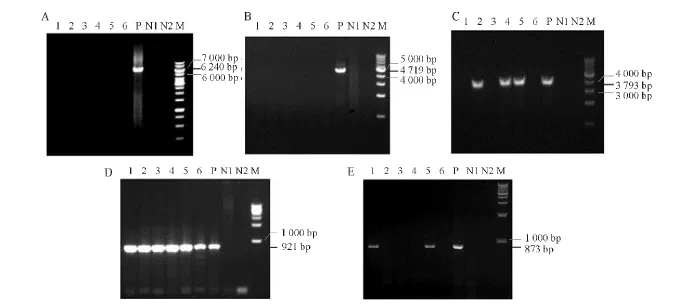
图3 死亡的转基因克隆仔猪阳性鉴定Fig.3 PCR detection of dead cloned trasgenic piglets
2.4 转基因仔猪拷贝数鉴定
以构建的GAPDH-NEO双基因同质粒载体做为标曲扩增模板分别扩增NEO和GAPDH基因,获得了GAPDH和NEO基因的标准曲线(图4A),2条曲线的R2值分别为1和0.999,均符合实验要求。由于在猪基因组中GAPDH基因为单拷贝基因,基因组中存在同源染色体。而NEO基因作为外源基因,在其导入基因组的过程中,只能随机插入同源染色体其中的一条染色体上,所以2倍的Quantity(NEO)与Quantity(GAPDH)的比值为NEO基因的拷贝数。最终得到的6头死亡转基因仔猪NEO基因的拷贝数分别为 3、1、2、2、4、5(图 4B)。
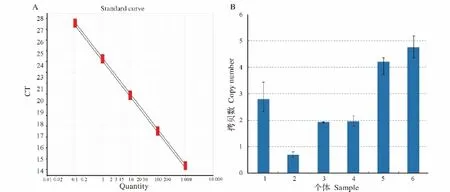
图4 6头死亡转基因仔猪NEO基因拷贝数Fig.4 Copy number of NEO gene in 6 dead transgenic piglets
3 讨论与结论
本研究的转基因克隆猪均因传染性胃肠炎而在断奶前死亡,对照组为分娩后因窒息或疫苗应激而死亡的大白仔猪。这6头转基因克隆小猪发病时表现出集中爆发、死亡快的特点(表现腹泻后的1~3 d内死亡),所有个体均表现出腹泻和大便异常的临床症状,另外部分个体还伴有发烧和咳嗽症状中的1个或2个;病理解剖特征均显示出胃内有凝乳和小肠肿胀,少量个体伴有小肠充血(表3,图2)。这些临床症状和病理解剖症状完全符合传染性胃肠炎的特点[15-16],并未发现其它非典型症状。6头转基因仔公猪与非转基因大白仔公猪的脏器系数比较发现,除肾脏系数(P<0.05)外其余脏器系数均差异不显著(P>0.05);且所有类别仔猪脏器系数均具有较高的变异系数均值(表4),这与部分有关猪脏器系数的研究报道所表现的情况一致[17-18]。转基因或克隆动物的生物安全性备受社会各界的关注,早期有报道显示克隆动物中会出现身体器官或机能异常的现象[19-20];不过在本研究中,没有证据表明单纯的转基因和(或)克隆技术对受体猪产生了显著性的不利影响,这可能也得益于转基因和克隆技术的快速发展和进步。
本研究中6头转基因克隆仔公猪经PCR鉴定均含有外源基因序列,可判定为转基因阳性个体,但在外源载体不同位置设计引物经过长片段PCR和常规PCR扩增发现,6头转基因克隆猪中外源载体序列均不完整,其中4头小猪在关键的启动子和CDS区上发生了断裂或缺失,推测外源基因无法获得正常表达。这种通过体细胞克隆法获得的转基因动物在外源载体插入基因组的过程中发生断裂和缺失的现象鲜见报道。当前已有的报道显示,通过显微注射法获得转基因动物中易发生缺失、重复、重排等转基因异常现象,而通过体细胞克隆技术获得的转基因动物不会出现外源基因缺失和重排的现象[21]。本研究所获得的转基因克隆小猪中存在高频率的外源基因缺失现象,其异常具体是在细胞转染或(和)体细胞克隆阶段造成的,有待进一步的研究。由于转基因猪的外源载体序列发生了不同程度的断裂和缺失,本研究针对未出现缺失的NEO区域利用绝对定量PCR进行拷贝数检测,结果显示6头小猪的外源基因拷贝数分别为3、1、2、2、4、5,说明外源基因以随机拷贝的形式插入了宿主基因组中,这与众多的转基因研究中出现的结果相类似[22]。
本研究所涉及的转基因事件因外源基因缺失或重排而未获得最终的成功,也又一次地验证了传统转基因和克隆工作的难度和低效性。最近几年,最新的基因组编辑技术—转录激活因子样效应蛋白核酸酶(transcription activator-like effector nuclease,TALENs)和聚合定期空间短复发重复相关系统(CRISPR/Cas9)的出现,使得科研工作者对于基因组的任意位点进行高效修饰或改变成为可能。特别是CRISPR/Cas9技术,因其方便、快捷、高效和低价的特点而备受科学工作者的青睐,这类技术的出现也为我们今后开展类似的工作提供了有力的工具[23]。
本研究中因传染性胃肠炎死亡的转基因克隆在发病时表现出传染性胃肠炎典型的临床和病理特征;脏器系数比较发现,转基因克隆猪与普通猪之间只存在微小的差异;经PCR鉴定该批猪均为转基因阳性,但所导入的外源载体发生了不同程度的断裂或缺失;拷贝数检测结果显示这批转基因猪中外源基因以不同拷贝数的形式导入内源基因组中。
[1]Wilmut I,Schnieke A E,McWhir J,et al.Viable offspring derived from fetal and adultmammalian cells[J].Nature,1997,385(6619):810-813.
[2]Schnieke A E,Kind A J,RitchieW A,et al.Human factor IX transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts[J].Science,1997,278(5346):2130-2133.
[3]Ross JW,Prather R S,Whyte J J,et al.CAB reviews:perspectives in agriculture,veterinary science[J].2009,Nutr Nat Resour,4(38):1-13.
[4]Matsunari H,Nugashima H.Application of genetically modified and cloned pigs in translational research[J].JReprod Dev,2009,55(3):225-230.
[5]Sara Shields,Ian JH.Duncan.An HSUS report:welfare issues with genetic engineering and cloning of farm animals[EB/OL].http://www.humansociety.org/assets/pdfs/farm/HSUS-Report-on-Genetic-Engineering-and-Cloning--of-Farm-animals.pdf.2014-10-11.
[6]Bailey SA,Zidell R H,Perry RW.Relationships between organ weightand body/brain weight in the rat:what is the bestanalytical endpoint?[J]Toxicol Pathol,2004,32(4):448-466.
[7]韩芬茹.四种实验动物脏器质量系数的测定[J].畜牧兽医杂志,2006,25(4):1-3.
[8]SÜVEGOVÁK,JURˇCÍK R,CHRENEK P,et al.Comparison of inner organs weight and some hematological and biochemical blood parameters of transgenic and nontransgenic rabbits[J].Proceedings-8thWorld Rabbit Congress,2004,632-638.
[9]田小芸,恽时锋,胡玉红,等.转基因EGFP小鼠的主要脏器重量及脏器系数[J].中国比较医学杂志,2008,18(1):32-33,36.
[10]Piedrahita JA,Walker S,Zaunbrecher G.Organ weight variation in cloned pigs[EB/OL].(2004-1-2)[2013-10-1].http://www.publish.csiro.au/paper/RDv16n1Ab67.htm.
[11]Mulsant P,Lecerf F,Fabre S,etal.Mutation in bonemorphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J].Proc Natl Acad Sci USA,98(9):5104-5109.
[12]Chu M,Jia L,Zhang Y,et al.Polymorphisms of coding region of BMPR-IB gene and their relationship with litter size in sheep[J].Mol Biol Rep,2011,38(6):4071-4076.
[13]Chu M X,Zhao X H,Zhang Y J,et al.Polymorphisms of BMPR-IB gene and their relationship with litter size in goats[J].Mol Biol Rep,2010,37(8):4033-4039.
[14]何小芳.转BMPR-IB基因克隆猪的制备[D].南昌:江西农业大学,2011.
[15]甘孟侯,杨汉春.中国猪病学[M].北京:中国农业出版社,2005:183-187.
[16]Straw B E,Zimmerman JJ,D’Allaire S,等.猪病学[M].赵德明,张仲秋,沈建忠译.9 版.北京:中国农业大学出版社,2009:545-580.
[17]黎立,郭雄明,姚春涛,等.SPF级与普通级小型猪主要脏器形态与脏器系数比较[J].中国比较医学杂志,2009,19(2):43-45.
[18]赵佳福,许厚强,张勇,等.贵州白香猪与3种杂交猪脏器系数及血液指标比较[J].中国畜牧兽医,2011,38(2):56-59.
[19]Wilmut I.Are there any normal clones?[J]Methods Mol Biol,2006,348:307-318.
[20]Lee R S,Peterson A J,Donnison M J,etal.Cloned cattle fetuseswith the same nuclear genetics aremore variable than contemporary half-siblings resulting from artificial insemination and exhibit fetal and placental growth deregulation even in the first trimester[J].Biol Reprod,2004,70(1):1-11.
[21]Atala A,Lanza R,Thomson JA,et al.Principles of regenerativemedicine[M].Second edition.New York:Academic Press,2011:172.
[22]Wolf E,SchemthanerW,Zakhartchenko V,et al.Transgenic technology in farm animals-progress and perspectives[J].Exp Physiol,2000,85(6):615-625.
[23]Hsu PD,Lander E S,Zhang F.Development and applications of CRISPR-Cas9 for genome engineering[J].Cell,2014,157(6):1262-1278.
