山女鳟水霉病病原的分离鉴定及其生物学特性
2015-05-28刘红柏范兆廷
甄 珍,王 荻,刘红柏*,范兆廷
(1.中国水产科学研究院 黑龙江水产研究所,黑龙江 哈尔滨 150070;2.东北农业大学 动物科学技术学院,黑龙江哈尔滨 150030)
山女鳟(Oncorhynchusmasou masou)原产于日本,属鲑形目(Salmoniformes)、鲑科(Salmonidae)、大麻哈鱼属(Oncorhynchus),是日本樱鳟(马苏大麻哈)(Oncorhynchusmasou)的遗传型陆封种[1]。我国于1996年由日本引进山女鳟鱼卵[2],姜作发等[1]对山女鳟在人工养殖条件下生长特性进行研究。
水霉属(Saprolegnia)隶属于茸鞭生物界(Stramenopila)中的卵菌门(Oomveota),而非传统上认为的真菌界(Fungi)[3]。水霉菌是导致水霉病的常见病原菌,其分布广泛,在国内外的养殖场中均有发生,几乎感染所有淡水鱼类[4]。水霉病是水产动物病害中最为严重的疾病之一,水霉菌大多生长在鱼体的伤口处和鱼卵上,形成白色棉絮状菌丝,破坏鱼体的健康,特别是在养殖密度大,生长环境恶劣的情况下[4-5],水霉病极易爆发,从而影响水产养殖业的经济效益,给水产养殖业的发展带来了阻碍。
水霉病的严重危害促使国内外众多真菌学家和水产学家对其进行了研究,并取得了一定进展[4],但仍缺乏深入系统的研究。例如,Willoughby等[6]报道了鳗鱼致病性水霉菌的生长与温度的关系;张书俊等[5]初步研究了施氏鲟水霉病病原;李爱华等[7]对花鲈水霉病及其病原进行初步研究。但至今未见冷水性鱼类水霉病相关的研究报道。近年来,山女鳟人工繁殖和人工养殖技术不断发展完善,其养殖产业在我国快速发展,而频发的各种病害给产业发展带来了极大困扰,水霉病作为山女鳟养殖过程中常见的病害之一,为养殖业者造成了巨大经济损失。本实验通过从山女鳟体表分离纯化一株致病菌株,并探寻温度、pH和盐度对其生理特性的影响,以期为冷水性鱼类水霉病的防治提供理论基础和科学数据。
1 材料与方法
1.1 材料与仪器
患病山女鳟采自中国水产科学研究院黑龙江水产研究所渤海冷水鱼类实验站,体表病灶部位覆有白色棉絮状菌丝。
试验用PDA培养基和真菌基因组DNA提取试剂盒(Fungal DNA Kit(50))分别购自青岛高科园海博生物技术公司和Omega Bio-tek。
试验用倒置显微镜(OLYMPUS(IX50/IX70))产自日本,用于水霉菌株的菌丝和孢子的形态学观察;PCR仪BIO-RAD(S1000 Thermal Cycler)产自新加坡,用于菌株ITS rDNA序列的扩增。
1.2 菌株SN的分离与纯化
用解剖刀刮取山女鳟病灶部位的菌丝,用体积分数75%的酒精浸洗2~3 s后用无菌水冲洗数次,接种于含有100 mg/mL双抗(Penicillin-streptomycin)的马铃薯琼脂糖培养基(PDA)平板上,25℃恒温培养至贴壁生长,在菌落边缘放入无菌油菜籽,继续恒温培养,至油菜籽上布满菌丝。挑取带有菌丝的油菜籽放入灭菌河水中,于25℃培养至菌丝释放出孢子。无菌吸取100μL孢子悬液于加有双抗的PDA平板上,均匀涂布,放入25℃培养箱培养,切取单菌落琼脂块到PDA平板上进行纯化培养,直至菌丝布满整个平板,置于4℃备用。
1.3 菌株SN的鉴定
1.3.1 形态的显微观察 将纯化培养的PDA平板上放置灭菌油菜籽,于25℃恒温培养,用镊子无菌挑取布满菌丝的油菜籽,转至装有灭菌河水的的6孔板中,置于25℃的恒温培养箱中继续培养,并在倒置显微镜下观察菌丝的的形态,孢子囊、游动孢子、藏卵器、厚垣孢子的形成及其形态特征。
1.3.2 菌株的分子鉴定 用试剂盒Fungal DNA Kit(50)提取分离菌株SN的DNA并参照可小丽等[3]的方法对其ITS rDNA序列进行PCR扩增。PCR产物测序由上海英潍捷基有限公司完成。
1.3.3 实验数据处理方法 将测得的序列用DNAMAN软件编辑后,在NCBI中进行BLAST比较,选取同源性较高的序列,利用软件BioEdit 7.0和MEGA 5.0进行多重比较后通过邻接(Neighbour-Joinin,NJ)法构建系统发育树。
1.4 不同生长条件对菌株SN生理特性的影响
1.4.1 温度对菌株生长的影响 实验采用打孔法,参照Hussein等[8]用打孔器无菌制备直径为5mm的菌饼,接种至含有双抗的PDA 平板中心,分别置于5,10,15,20,25,30,35℃恒温培养72 h,每24 h用十字交叉法测量不同温度下菌落直径(mm)并记录数据,每组设置3个平行试验。
1.4.2 pH对菌株生长的影响 配制PDA培养基,用1 mol/L HCl和1 mol/L NaOH调节pH值分别为5、6、7、8、9、10、11,常规灭菌后倒板备用。参照 Hussein 等[8]用打孔器无菌制备直径为 5 mm 的菌饼,接种至事先准备好的PDA平板中心,25℃下恒温培养72 h,每24 h用十字交叉法测量不同温度下菌落直径(mm)并记录数据,每组设置3个平行试验。
1.4.3 盐度对菌株生长的影响 参照Hussein等[8]用打孔器无菌制备直径为5mm的菌饼,将其分别置于含 NaCl质量分数为0.5%、1.0%、1.5%、2.0%的PDA 平板中心,置于25 ℃恒温培养72 h,每24 h 用十字交叉法测量菌落直径(mm)并记录数据,每组设置3个平行试验。
2 结果与分析
2.1 菌株SN的鉴定
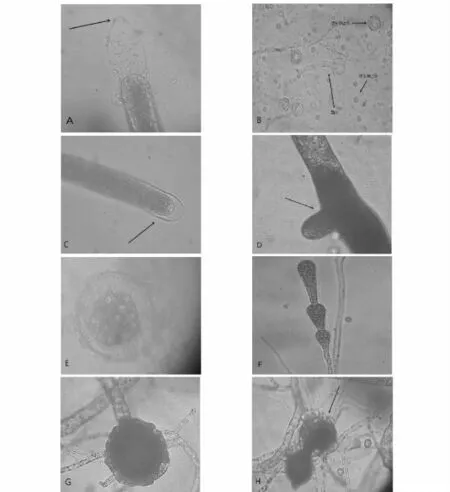
图1 水霉SN菌株的形态观察Fig.1 Morphological observation of Saprolegnia SN
2.1.1 形态学鉴定 通过倒置显微镜观察油菜籽上SN菌株形态,可见其菌丝纤细柔软,无横隔,有适当的分支。随着培养时间的延长,菌丝顶端出现棍棒状孢子囊,游动孢子成熟后从孢子囊前端的排放颈(Discharge neck)[4]释放出(图1A),游动孢子经过2次游动后形成静止体,然后萌发成菌丝(图1B)。新孢子囊以内层出的方式产生或是从空孢子囊基部侧生出一个新孢子囊(图1C、D)。在生长条件恶劣,营养状况较差的情况下,菌丝上出现了厚垣孢子,其单独存在或若干个连成串珠状(图1E、F)。水霉SN菌株的藏卵器呈球形,与雄器同枝或异枝(图1G、H)。
2.1.2 分子鉴定 将ITS rDNA序列(图2)通过NCBI网站与GenBank中的已知序列进行同源性比较,发现其与水霉属菌株自然聚类。通过邻接法构建的系统发育树结果(图3)进一步表明,菌株SN与鲑水霉(NO:EU551152)的亲缘关系最近。结合形态特征与ITS序列鉴定的结果,推测菌株SN为鲑水霉菌(Saprolegnia salmonis)。

图2 菌株SN的ITS rDNA序列Fig.2 ITS rDNA sequence of Saprolegnia SN
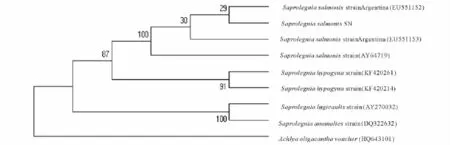
图3 基于菌株SN ITS rDNA序列分析用邻接法(Neighbour-Joinin)法所构建的系统进化树Fig.3 The constructed NJ phylogenetic tree based on ITS rDNA sequence of Saprolegnia SN
2.2 菌株SN的生长特性
2.2.1 温度对菌株生长的影响 水霉SN菌株在10~30℃内均可生长,而在5℃和35℃时菌株停止生长。由图4可见,水霉SN菌株在适宜的生长温度范围内,温度越高菌株生长的越旺盛,在25℃时生长速度达到最大值,培养72 h后水霉菌落几乎铺满整个PDA平板,由此表明25℃是水霉SN的最适生长温度。
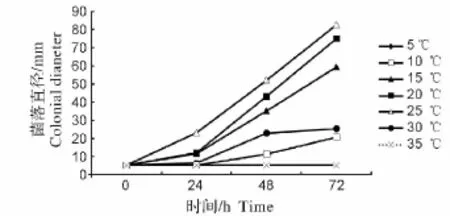
图4 温度对水霉SN生长的影响Fig.4 Effect of temperature on the growth of Saprolegnia SN
2.2.2 pH对菌株生长的影响 水霉SN菌株在pH 5~11内恒温培养72 h菌株均能生长,pH为10和11时,培养时间不足24 h水霉生长差异不显著,超过24 h后菌株显著生长。pH在5~9时,随着pH的增大菌株生长得越显著(图5),当pH为8恒温培养72 h后水霉菌落几乎铺满整个PDA平板,由此表明水霉SN的最适生长pH为8。
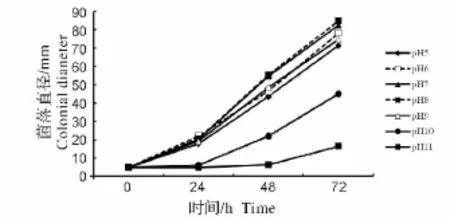
图5 pH对水霉SN生长的影响Fig.5 Effect of pH on the growth of Saprolegnia SN

图6 盐度对菌株SN生长的影响Fig.6 Effect of NaCl on the growth of Saprolegnia SN
2.2.3 盐度对菌株生长的影响 NaCl对水霉SN菌株的生长影响显著,在NaCl浓度为0.5%~2.0%时均可生长,但对其具有明显的抑制作用。通过实验数据显示(图6),菌株SN在NaCl钠为0.5%~2.0%培养时,随着初始NaCl浓度的升高而生长显著降低,恒温培养72 h后水霉菌落均未铺满整个PDA平板。
3 讨论
目前,通过以形态特征为依据的传统分类鉴定方法很难对性状相似的菌株进行鉴定和命名[9],对于属内种类的鉴定是根据卵原细胞、雄器及卵孢子分化位置及数目等[10],但是有些菌株往往没有有性结构[11],或这些结构需要较长的时间发育成熟[12-13]。因此,利用ITS rDNA序列分析的方法[14]弥补了水霉菌在传统分类学上的不足,由于ITS区域在不同菌株间存在丰富的变异,且具有序列片段小,易分析的优点[15],为水霉菌的分类鉴定和系统发育等研究提供了重要依据。本实验从山女鳟体表病灶部位分离了一株致病性菌株SN,通过传统的形态鉴定和ITS rDNA序列分析相结合的方法,推测此菌株为水霉属中的鲑水霉(Saprolegnia salmonis),并进一步讨论了其生理特性以期为水霉菌的研究提供理论依据。
温度及pH是水产养殖中重要的环境影响因子,同时也是水霉生长的重要理化因子。如Hatai等[11]分离了异株水霉(Saprolegnia diclina),发现其生长温度为15~20℃,超过30℃菌丝停止生长;Koeypudsa等[16]分离的8株水霉菌在5~30℃、pH 4~11内均可生长,最适生长温度和pH分别为25℃和7~10;夏文伟等[17]通过研究发现其分离的水霉菌株能够生长温度为5~30℃,pH 4~11,最适生长温度为25℃~30℃,最适生长pH为6~9。本实验研究发现菌株SN的生长温度为10~30℃,最适生长温度为25℃;pH为5~11,最适生长pH为8。这与国内外学者研究结果基本一致。由于水霉菌具有很强的环境适应能力,在鱼体生长的正常温度和pH范围内依旧能够生存及产生孢子,使鱼体患病。因此,只有防止养殖密度过大及在产孵期避免鱼体造成机械损伤,才能有效预防山女鳟水霉病的发生。
研究显示,水霉菌对NaCl同样也具有敏感性,Hussein等[5]通过分离的水霉菌株,发现NaCl在含量为3.5%条件下菌株不生长;张书俊等[4]从施氏鲟体表病灶部位分离的水霉菌在NaCl含量为1%~2%时生长被显著抑制,含量为3%时水霉菌完全不生长;夏文伟等[17]发现2%的NaCl即可完全抑制菌株的生长。本实验从患病山女鳟病灶部分离的SN菌株在NaCl含量0.5%~2%时,随着浓度的升高菌株的生长被显著抑制,这些研究结果证实了水产动物很少在咸水中爆发水霉病,同时也说明了合理利用NaCl是防治水霉病的有效措施[18]。因此,在养殖过程中,由于水霉菌株的种类或生长条件不同,要根据水霉菌株对NaCl的敏感程度合理选择用量。
[1]姜作发,贾钟贺,白庆利,等.人工养殖山女鳟幼鱼的生长特性[J].中国水产科学,2007,14(1):160-164.
[2]夏文伟.鲫卵源致病性水霉的分离与鉴定及其生物学特性研究[D].上海:上海海洋大学,2011.
[3]可小丽,汪建国,顾泽茂,等.水霉菌的形态及ITS区分子鉴定[J].水生生物学报,2010,34(2):293-301.
[4]张书俊,杨先乐,李聃.施氏鲟水霉病病原的初步研究[J].中国水产科学,2009,16(1):89-96.
[5]Hussein M M A,Hatai K.Pathogenicity of Saprolegnia species associated with outbreak of salmonid saprolegniosis in Japan[J].Fish Sci,2002,68:1067-1072.
[6]Willoughby L G,Copland JW.Temperature growth relationships of Saprolegnia pathogenic to fish,especially eels cultivated in warm water[J].Nova Hedwig,1984,39:35-55.
[7]李爱华,聂品,卢全章.花鲈水霉病及其病原的初步研究[J].水生生物学报,1999,23(4):388-390.
[8]Hussein M M A,Hatai K.Saprolegnia salmonis sp.nov.isolated from sockeye salmon OnchrhYnchus nerka[J].Mycoscience,1999,40(5):387-391.
[9]Diéguez-Uribeondo J,Fregeneda Grandes JM,Cerenius L,et al.Re-evaluation of the enigmatic species complex Saprolegnia diclina-Saprolegnia parasitica based on morphological,physiological and molecular data[J].Fungal Genetics and Biology,2007,44(7):585-601.
[10]Willoughby L G.Sprolegnias of salmonid fish in windermere:a critical analysis[J].Journal of Fish Diseases,1978,1(2):51-67.
[11]HataiK,Willoughby L G,Beakes GW.Some characteristics of Saprolegnia obtained from fish hatcheries in Japan[J].Mycological Research,1990,94(2):182-190.
[12]Leclerc M C,Guillot J,Devile M.Taxonomic and phylogenetic analysis of Saprolegniaceae(Oomycetes)inferred from LSU rDNA and ITS sequence comparisons[J].Antonievan Leeuwenhoek,2000,77(4):369-377.
[13]Seymour R L.The genus Saprolegnia[J].Nova Hedwigia,1970,19(3):1-124.
[14]叶航,韦维,吴波,等.油茶炭疽病病原菌的分离和初步鉴定[J].江西农业大学学报,2014,36(2):314-318.
[15]Ke X L,Wang JG,Gu ZM,et al.Morphological and molecular phylogenetic analysis of two Saprolegnia sp.(Oomycetes)isolated from silver crucian carp and zebra fish[J].Mycological Research,2009,113(5):637-644.
[16]KoeypudseW,Phadee P,Tangtrongpiros J,et al.Influence of pH,temperature and sodium chloride concentration on growth rate of Saprolegnia sp.[J].Journal of Scientific Research Chulalongkorn University,2005,30(2):123-130.
[17]夏文伟,曹海鹏.彭泽鲫卵源致病性水霉的鉴定及其生物学特性[J].微生物学通报,2011,38(1):57-62.
[18]Wood SE,Willoughby L G,Beakes GW.Preliminary evidence for inhibition of Saprolegnia fungus in themucus of brown trout,Salmo trutta L.,following experimental challenge[J].Journal of Fish Diseases,1986,9(6):557-560.
