光照时间对兴国灰鹅产蛋和PRL、FSHβ、LH m RNA 表达的影响
2015-05-28黄江南刘林秀武艳平康昭风韦启鹏周泉勇季华员陈受金谢金防
黄江南,刘林秀,武艳平,康昭风,韦启鹏,周泉勇,季华员,曾 文,陈受金,谢金防*
(1.江西省农业科学院 畜牧兽医研究所,江西 南昌 330200;2.江西省兴国县灰鹅生产办公室,江西 兴国 342400)
鹅的繁殖活动具有明显的季节性,而光照是调控鹅季节性繁殖的重要因子。光照通过家禽视网膜上的感受器刺激下丘脑,促使下丘脑分泌促性腺激素释放激素(gonadotrophin,GnRH)和血管活性肠肽(vasoactive intestinal peptide,VIP),GnRH通过脑垂体门脉系统传至垂体前叶和后叶引起卵泡刺激素(FSH)和黄体生成素(LH)的分泌,最终促进卵巢中卵泡的发育和排卵[1]。同时,在下丘脑-垂体-性腺轴中,VIP可促进促乳素(PRL)分泌,PRL的分泌量最终在升高到一定阈值时,会反馈性地抑制下丘脑GnRH的分泌,从而终止繁殖活动和繁殖季节[2]。
兴国灰鹅是我国著名的优良中型灰鹅品种资源之一,它的形成已有1 700多年历史,具有耐粗饲、生长快、肉质鲜嫩、抗逆性强等特性,是我国家禽品种资源基因库中的宝贵鹅遗传资源,已列入我国畜禽遗传资源国家级保护名录。兴国灰鹅的繁殖同样具有明显的季节性,在自然条件下,每年从9月份开始进入繁殖期,至次年的4月份左右停产,为短日照繁殖类型鹅种[3-4]。
在兴国灰鹅前期的相关研究中发现,当兴国灰鹅处于停产期时,通过缩短光照可促使其重新产蛋,且PRL基因在短光照处理组的垂体和输卵管中表达量均显著低于自然光照组[1,5]。因此,本试验在此基础上,进一步开展了长光照对兴国灰鹅产蛋量及产蛋性状相关基因在下丘脑-垂体-性腺轴表达水平的影响,以期进一步增进对光照调控兴国灰鹅季节性繁殖内分泌机制的认识。
1 材料与方法
1.1 试验设计与样品采集
1.1.1 试验地点 饲养试验在江西省兴国灰鹅原种场进行。
1.1.2 试验分组 选择健康、体重均匀且同年龄的兴国灰鹅84只,分为对照组和实验组,试验组35只母鹅,对照组 35 只母鹅,公∶母=1∶5。
1.1.3 试验时间 试验时间从2013年10月3号开始,至2013年12月3日结束。
1.1.4 光照控制 试验组的鹅接受递增式长光照处理,每周增加 1~2 h光照,第1周每天18:00将鹅驱赶入蔽光的鹅舍,次日06:00将鹅从鹅舍放出,控制鹅群每天接受13 h的自然光照。第2周光照15 h,即每天18:00时将鹅驱赶入蔽光的鹅舍,次日04:00开白炽灯(30~50 lx)补光至天亮,将鹅从鹅舍放出。第3周光照17 h,即每天天黑前时将鹅驱赶入鹅舍,开白炽灯(30~50 lx)至21:00,次日05:00开白炽灯(30~50 lx)补光至天亮,将鹅从鹅舍放出。第4周开始光照18 h,持续到第8周,即每天天黑前时将鹅驱赶入鹅舍,开白炽灯(30~50 lx)至22:00,次日04:00开白炽灯(30~50 lx)补光至天亮,将鹅从鹅舍放出。整个试验阶段,对照组的鹅接受自然光照,第1个月接受自然光照的平均时间为12.89 h,第2个月接受自然光照的平均时间为11.78 h。
1.1.5 数据记录 试验组和对照组其他环境条件一致。每天定时收集蛋,记录各组每天总产蛋数并计算产蛋率。每3~4 d检查1次就巢,并观察换羽情况,被确认就巢的母鹅被隔离限饲7~10 d以强制终止就巢,然后重新归群。
1.1.6 样品采集 当试验结束,分别挑选试验组处于停产期和对照组处于产蛋期的3只鹅进行屠宰,收集下丘脑、垂体、卵巢和输卵管组织,放入液氮中速冻,-70℃冷冻保存。
1.2 所用试剂及仪器
1.2.1 主要试剂 Trizol总RNA提取试剂购自Invitrogen公司,凝胶电泳用琼脂糖为西班牙生产,引物合成和基因序列测序服务均由上海Invitrogen公司提供,M-MLV反转录酶试剂盒和荧光定量试剂盒试剂盒均购自Toyobo公司。
1.2.2 主要仪器设备 梯度PCR仪(德国Eppendorf公司),Nano Drop2000核酸/蛋白质浓度测定仪(美国Thermo scientific公司),荧光定量PCR仪器(美国ABI公司)。
1.3 组织总RNA的提取和第一链cDNA的合成
采用Trizol法提取组织中的总RNA,提取的RNA用Thermo scientific公司的NanoDrop 2000核酸蛋白测定仪测定总RNA浓度。
cDNA的合成利用Toyobo公司的cDNA的合成试剂盒(ReverTra AceⒸ qPCR RT Master Mix with gDNA Remover)完成,先在65℃温育5 min将RNA变性后,置于冰上,加入DNaseI混合液,37℃温育5 min去除基因组DNA,再加入5×RTMaster Mix II,37℃温育15 min,在98℃温育5 min以灭活反转录酶。反转录后的cDNA可于-20℃ 保存。
1.4 荧光定量PCR检测引物的设计
根据GenBank登录的FSHβ(EU563911)、LHβ(DQ023159)、管家基因β-actin(M26111)基因序列,应用Premier 5.0软件设计定量检测引物。PRL基因的引物序列引用张旭(2010)等的研究[6]。通过PCR扩增,筛选扩增特异性较好的引物作为荧光定量检测的引物,引物序列如表1所示。

表1 用于荧光定量检测的引物Tab.1 The primers for qPCR
1.5 荧光定量PCR检测
反应体系为 20 μL,其中 cDNA 0.8 μL,SYBR green IMix 10 μL,ROX 0.4 μL,正反向引物各0.4μmol/L,其余用灭菌纯净水补足。样品在96孔板混合均匀后直接放入ABI 7300实时定量PCR仪上进行扩增反应,反应程序为95℃ 10 s,1个循环,95℃ 15 s,60℃ 30 s,40个循环,95℃ 15 s,60℃30 s,95℃ 15 s,60℃ 1 min,1个循环。每个基因的各个样品都与内参基因的引物同时扩增,反应的相对量以目标基因与内参基因的Ct值(取3个重复的平均值)的差值△Ct计算,再选取△Ct最大作为参照,用其它样品的△Ct减去参照△Ct得到△△Ct,Ct值大于35的视为无效数据。
1.6 数据分析
产蛋曲线为日产蛋率曲线,日产蛋率=日产蛋总数/母鹅总数(包括就巢鹅)×100%。应用Excel软件对荧光定量PCR数据进行分析,根据所测得的内参基因和目的基因的Ct值计算目的基因的相对表达量,根据Ct值推导得出目的基因的量=2-△△Ct。Ct是热循环仪检测到反应体系中荧光信号的强度值,△△Ct=△Ct目的基因-Ct管家基因,△Ct=Ct目的基因-Ct管家基因[7],计算出样品中目的基因 mRNA 与内参基因 βactin相对表达量。
2 结果与分析
2.1 产蛋情况
试验组在30 d达到产蛋高峰,产蛋率达17%,到38 d就开始下降,于50 d停产 (图1A)。对照组在整个试验期间持续产蛋,到15 d达到一个产蛋高峰,产蛋率达到21%(图1B)。整个试验期间,试验组的平均日产蛋率为8.2%,对照组的平均日产蛋率为8.8%。
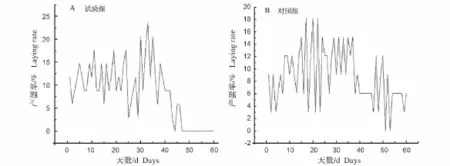
图1 不同光照对兴国灰鹅日产蛋率的影响Fig.1 Effects of light exposure on egg production
2.2 组织RNA的提取与检测
收集了试验组和对照组鹅的下丘脑、垂体、输卵管、卵巢组织各3份,共24个组织样品。在利用Trizol法提取RNA后用1.5%的琼脂糖胶检测完整性,得到的结果如图2,由图2可以看出,28S比18S亮,说明RNA完整性很好。进一步利用核酸浓度测定仪对所提取的总RNA进行检测,结果显示总RNA浓度在400~1 800 ng/μL之间,A260/A280在1.9~2.1之间,RNA的纯度和浓度均达到实验要求。
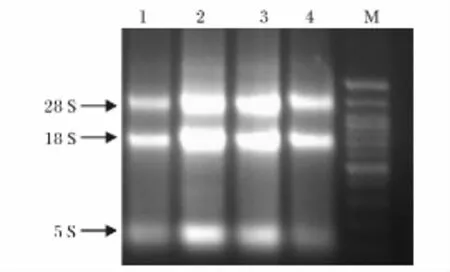
图2 鹅4个组织的RNA琼脂糖胶检测Fig.2 Agarose gel(1.2%)showing RNA from tissues of goose
2.3 β-actin、PRL、FSHβ和LH基因的扩增曲线和溶解曲线
β-actin、PRL、FSHβ、LH 基因的扩增曲线走势正常,呈典型的S型曲线(图3)。且 β-actin、PRL、FSHβ、LH 基因的融解曲线均呈单一尖峰(图4),表明设计的引物特异性好,无引物二聚体和非特异产物,可用于基因表达量的检测。

图3 β-actin、PRL、FSHβ和LH基因的扩增曲线Fig.3 The amplification curves ofβ-actin、PRL、FSHβ and LH gene
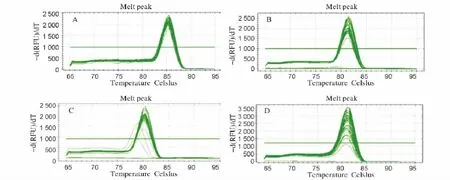
图4 β-actin、PRL、FSHβ和LH基因的溶解曲线Fig.4 Themelt curves ofβ-actin、PRL、FSHβ and LH gene
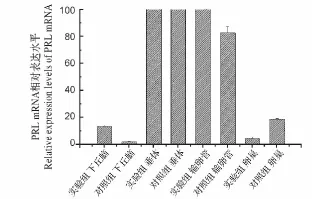
图5 光照对兴国灰鹅下丘脑-垂体-性腺轴中PRL基因mRNA表达水平变化影响Fig.5 Effects of light exposure on the expression of PRL gene in hypothalamus-pituitary-gonad axis of Xingguo grey geese
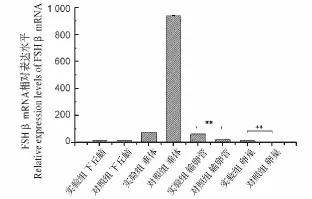
图6 长光照对兴国灰鹅下丘脑-垂体-性腺轴中FSHβ基因mRNA表达水平变化影响Fig.6 Effects of light exposure on the expression of FSHβ gene in hypothalamus-pituitary-gonad axis of Xingguo grey geese
2.4 PRL基因的表达量检测
PRL基因在试验组和对照组的垂体、输卵管和卵巢组织中不存在显著的表达差异(图5),但在下丘脑组织中,试验组的表达量显著的高于对照组(FC=10.3,P=0.03)。
2.5 FSHβ基因的表达量检测
FSHβ基因在试验组和对照组的下丘脑组织中不存在表达差异,在垂体组织中存在差异表达,但是差异不显著(图6)。在输卵管和卵巢组织中,试验组的表达量极显著的高于对照组(FC=4.3,P=0.001 2 和 FC=2.5,P=0.007)。
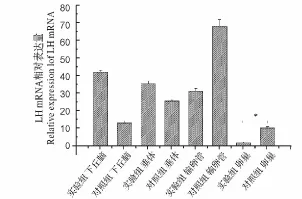
图7 长光照对兴国灰鹅下丘脑-垂体-性腺轴中LHβ基因mRNA表达水平变化影响Fig.7 Effects of light exposure on the expression of LHβ gene in hypothalamus-pituitary-gonad axis of Xingguo grey geese
2.6 LH基因的表达量检测
LH基因在试验组和对照组的下丘脑、垂体、输卵管组织中不存在显著的表达差异(图7)。但在卵巢组织中,试验组的表达量显著的低于对照组(FC=0.22,P=0.04)。
3 讨论与结论
光照时间对鹅的产蛋性能存在着显著的调节作用。施振旦等报道,短光照可促进广东灰鹅的繁殖活动,而长光照则抑制广东灰鹅的繁殖活动,同时,冬季延长光照可降低其饲料报酬[8-9]。且通过人工补照12~13.5 h,可使鹅产蛋高峰期提前,提高产蛋量[10]。在本实验室的前期研究中,4月至9月期间,在短光照处理下(11 h)的兴国灰鹅日产蛋率,显著高于自然光照组(14~15 h)[11]。本研究中,在江西省气候条件下,冬季10月份开始,通过光递增方式的光照调控程序可以使种鹅很快停产,提前进入休产期。这说明通过控制光照时间,可以调节兴国灰鹅的繁殖性能,与其它鹅种中的相关研究结果一致。通过这些研究,可为探讨兴国灰鹅的可操作性的光照程序和均衡繁殖技术推广应用提供科学依据。
禽类的繁殖季节调控理论认为这种原先促进繁殖活动的长日照最后抑制繁殖活动使繁殖季节终止的现象,一般被称为“光不应”或“光钝化”现象。这一“光钝化”现象应该与PRL的分泌有很大关系[12-13]。在本试验中,经过递增式长光照处理,鹅下丘脑PRL基因表达量显著的高于对照组,长光照对PRL分泌的促进结果与已报道在马岗鹅的PRL季节性分泌的结果相一致[14]。黄运茂等研究发现,延长光照能使PRL质量浓度上升、LH下降,母鹅进入休产期并完成换羽[14-15]。本研究中,长光照处理下鹅卵巢中LH基因表达水平显著低于自然光照组,可能是由于长光照处理导致的鹅下丘脑中PRL基因表达量的上升,通过下丘脑-垂体-性腺轴作用,最终抑制LH基因的表达。在杜晓东的研究报道中,自然光照周期下,产蛋期鹅卵巢FSHβ基因的表达量低于休产期[16]。本试验中发现对照组的产蛋鹅输卵管和卵巢中FSHβ基因的表达水平都显著高于长光照处理的休产的兴国灰鹅,这与自然光照周期下的表达规律不一致,说明长光照处理可能导致鹅的内分泌出现紊乱,使输卵管和卵巢中FSHβ基因的表达快速上升。
综上所述,光照时间长短影响了兴国灰鹅下丘脑-垂体-性腺轴中激素的合成代谢。通过延长光照,可促使兴国灰鹅生殖轴中PRL基因的表达水平上升,并通过旁分泌的方式,促进FSHβ基因的表达,抑制LH基因的表达[14,17],从而导致卵巢、输卵管等组织中FSHβ和LH表达比例失调,最终影响FSHβ和LH的协同作用,致使兴国灰鹅很快停产。
[1]周丽,杨海明,王志跃,等.鹅季节性繁殖的生理特点及调节措施[J].水禽世界,2010,15(5):40-43.
[2]黄运茂.马岗鹅繁殖活动的调控研究[D].广州:华南农业大学,2005.
[3]谢金防,刘林秀,武艳平,等.兴国灰鹅季节性繁殖控制技术研究初报[J].江西农业学报,2011,23(12):137-139.
[4]朱勇文.光照对家禽生产的影响[J].饲料博览,2011(2):8-10.
[5]施振旦,孙爱东,黄运茂,等.广东鹅种的反季节繁殖光照调控原理和技术[J].中国家禽,2007,29(19):40-42.
[6]张旭,康波,宿甲子,等.性成熟前籽鹅 PRL及PRLR mRNA表达量的动态变化[J].黑龙江八一农垦大学学报,2010,22(1):49-52.
[7]张响英,卞有庆,唐现文,等.VIP基因在狮头鹅繁殖周期下丘脑-垂体-性腺轴中的表达变化[J].河南农业科学,2013,42(3):121-124.
[8]施振旦,黄运茂,孙爱东,等.光照对广东灰鹅繁殖季节性的影响研究[J].广东农业科学,2005(3):72-75.
[9]王利刚,王健,狄和双,等.光照周期对鹅产蛋和血清中相关生殖激素水平的影响[J].江苏农业科学,2013,41(5):178-179.
[10]Wang CM,Chen L R,Lee SR,etal.Supplementary artificiallight to increase egg production of geese under natural lightingconditions[J].Anim Reprod Sci,2009,113(1/4):317-321.
[11]武艳平,霍俊宏,熊兴华,等.光照对兴国灰鹅 PRL基因表达的影响[J].福建农业科学,2013,28(10):943-946.
[12]Sharp P J.Strategies in avian breeding cycles[J].Animal Reproduction Science,1996,42(1):505-513.
[13]Sharp P J,Blache D A.Neuroendocrinemodel for prolactin as the keymediator of seasonal breeding in birds under long-and short-day photoperiods[J].Cannadian Journal of Physiology and Pharmacology,2003,81(4):350-358.
[14]黄运茂,施振旦,李孝伟,等.光周期对马岗鹅产蛋 PRL和LH分泌季节性变化的影响[J].华南农业大学学报,2007,28(3):94-96,104.
[15]陈永华,蔡凤仙,杨海明,等.自然光周期条件下种鹅血清生化指标和生殖激素水平变化规律的研究[J].中国家禽,2012,34(12):34-37.
[16]杜晓东.鹅生殖周期FSHβ基因mRNA表达规律的研究[D].合肥:安徽农业大学,2009.
[17]施振旦,黄运茂,吴伟.鹅产蛋周期及其生理学调控机制研究的回顾[J].中国家禽,2008,30(9):1-5.
