钼镉联合胁迫对山羊肾脏细胞凋亡相关基因表达的影响
2015-05-28曹华斌胡国良罗军荣顾小龙
王 琦,庄 煜,曹华斌,胡国良,罗军荣,顾小龙
(江西农业大学 动物科学技术学院/动物群发性疾病监测和防治研究所,江西 南昌 330045)
钼和镉是环境中两种污染较重的重金属元素,随着工业的快速发展,钼和镉及其化合物对人类和环境造成的威胁也日趋严重[1-2]。钼是动、植物生长所必需的微量元素之一,广泛存在于土壤、空气、水、植物及动物组织中[3]。镉是人体不必需的元素,含镉的污染物能通过多种途径进入土壤,大气和水环境,导致环境的进一步恶化,甚至通过食物链进入体内危害人体健康[4]。肾脏是机体新陈代谢过程中所产生的各种代谢终产物和过剩物质的主要排泄器官之一,同时也是体内药物及毒物代谢和排泄的重要器官。前人的试验主要集中在钼、镉单独作用对动植物生长的影响,而较少对钼镉互作条件下肾脏细胞凋亡等进行研究。本试验通过灌服不同浓度七钼酸铵和不同浓度的氯化镉溶液,观察钼、镉联合胁迫对山羊肾脏细胞凋亡相关基因表达的影响,以期进一步探讨钼、镉联合对山羊肾脏细胞凋亡相关基因表达情况的影响是协同还是拮抗的作用,从而为动植物钼、镉联合中毒的病理学研究提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物分组及日粮 本实验选用63头健康波尔山羊均购自南昌郊区某山羊养殖场,随机分成7组,每组3个重复,选用七钼酸铵([(NH4)6Mo7O24·4H2O])作为实验钼源,氯化镉(CdCl2)作为实验镉源,采用(NH4)6Mo7O24·4H2O和氯化镉水溶液对实验山羊进行灌服。钼、镉剂量按每kg山羊体质量计,对照组(Mo 0 mg/kg+Cd 0 mg/kg),低镉低钼组(Mo 15 mg/kg+Cd 0.5 mg/kg),低镉中钼组(Mo 30 mg/kg+Cd 0.5 mg/kg),低镉高钼组(Mo 45 mg/kg+Cd 0.5 mg/kg),高镉低钼组(Mo 15 mg/kg+Cd 1.0 mg/kg),高镉中钼组(Mo 30 mg/kg+Cd 1.0mg/kg),高镉高钼组(Mo 45 mg/kg+Cd 1.0 mg/kg),对照组灌服相应剂量去离子水,实验期50 d。试验山羊基础日粮参照NRC(1998)饲养标准山羊营养需要量配制。
1.1.2 样品采集 实验开始分别于当天、第25天、第50天每组剖杀3头山羊,每只山羊迅速取肾脏组织约10 g,分装于10 mL离心管,液氮速冻后于-80℃保存,用于分子生物学测定。
1.2 实验方法
1.2.1 总RNA的提取和RNA电泳 总RNA提取按北京全式金生物技术有限公司的TransZol试剂盒进行。用核酸蛋白仪测定总RNA浓度和纯度。
1.2.2 PCR引物设计 从 GenBank中检索获得羊的 Bcl-2、Bax、CytC、Caspase-3和肌动蛋白(β-Actin)基因序列。用Primer Express3.0软件自行设计,分别在相对保守的区域设计引物和探针,其中探针5′端标记FAM,3′端标记TEMRA,委托上海英骏技术公司合成,引物序列见表1。
1.2.3 反转录 按北京全式金生物技术有限公司的试剂盒操作进行。
1.2.4 Real Time(qPCR)反应 采用TaqMan探针法进行Real Time(qPCR)反应,按宝生物工程(大连)有限公司的TaKaRa Premix Ex Taq TM(Probe qPCR)试剂盒操作进行。

表1 引物和探针序列Tab.1 Prime and Probe sequence
1.3 数据分析与统计
使用Excel 2003对实验数据进行初步整理,然后应用SPSS17.0统计分析软件对整理后的数据进行单因素方差分析(ANOVA),记录各组间的差异显著性并进行多重比较。所有结果均用平均数±标准差(¯x±SD)表示。
2 结果分析
2.1 肾脏总RNA提取结果
RNA完整性的检测结果见图1,结果显示总RNA分子完整,28 s、18 s和5 s条带清晰,28 s大约是18 s的两倍宽,说明用该RNA提取试剂盒所获得的RNA是完整的,降解比较低。使用核酸蛋白仪测得该RNA 的 A260/A280值2.0左右,在1.80~2.10之间,说明所提取的 RNA 纯度较好。
2.2 钼镉联合胁迫对山羊肾脏凋亡相关基因表达的影响
2.2.1 钼镉联合胁迫下对山羊肾脏bcl-2mRNA表达的影响
钼镉联合胁迫下对山羊肾脏bcl-2 mRNA表达的影响见表2。组内比较,低镉低钼组第25天、50天与第0天比较降低,差异极显著(P<0.01),低镉中钼组、低镉高钼组、高镉低钼组和高镉中钼组在实验期内,肾脏bcl-2mRNA表达随实验天数的增加呈降低趋势,其中低镉中钼组第50天与第0天、25天比较差异极显著(P<0.01),低镉高钼组第50天与第0天比较差异显著(P<0.05),高镉低钼组和高镉中钼组第25天、50天与第0天比较差异极显著(P<0.01),高镉中钼组第50天与第25天比较差异显著(P<0.05),高镉高钼组第25天、50天与第0天比较呈降低趋势,差异极显著(P<0.01)。组间比较,第25天低镉低钼组、高镉低钼组、高镉中钼组和高镉高钼组与对照组比较极显著降低(P<0.01),低镉高钼组与对照组比较显著降低(P<0.05),第50天低镉低钼组、低镉中钼组、高镉低钼组、高镉中钼组和高镉高钼组与对照组比较极显著降低(P<0.01),低镉高钼组与对照组比较显著降低(P<0.05)。

图1 肾总RNA电泳图Fig.1 Electrophoresis picture of total RNA in kidney from goat

表2 钼镉联合胁迫下对山羊肾脏bcl-2mRNA表达的影响Tab.2 Effect of different concentration of M o on the bcl-2m RNA expressions in kidney from goat under Cd stress
2.2.2 钼镉联合胁迫下对山羊肾脏baxmRNA表达的影响 钼镉联合胁迫下对山羊肾脏baxmRNA表达的影响见表3。组内比较低镉中钼组和低镉高钼组第25天与第0天比较呈上升趋势,差异极显著(P<0.01),低镉高钼组第50天与第0天比较呈上升趋势,差异显著(P<0.05),高镉低钼组和高镉高钼组在实验期内,肾脏baxmRNA表达随实验天数的增加呈上升趋势,其中高镉低钼组第25天、50天与第0天比较差异极显著(P<0.01),第50天与第25天比较差异显著(P<0.05),高镉高钼组第50天与第0天比较差异显著(P<0.05)。组间比较,第25天低镉中钼组、低镉高钼组和高镉低钼组与对照组比较极显著升高(P<0.01),第50天低镉高钼组和高镉高钼组与对照组比较显著升高(P<0.05),高镉低钼组与对照组比较极显著升高(P<0.01)。

表3 钼镉联合胁迫下对山羊肾脏bax mRNA表达的影响Tab.3 Effect of different concentration of M o on the expressions of bax mRNA in kidney from goat under Cd stress
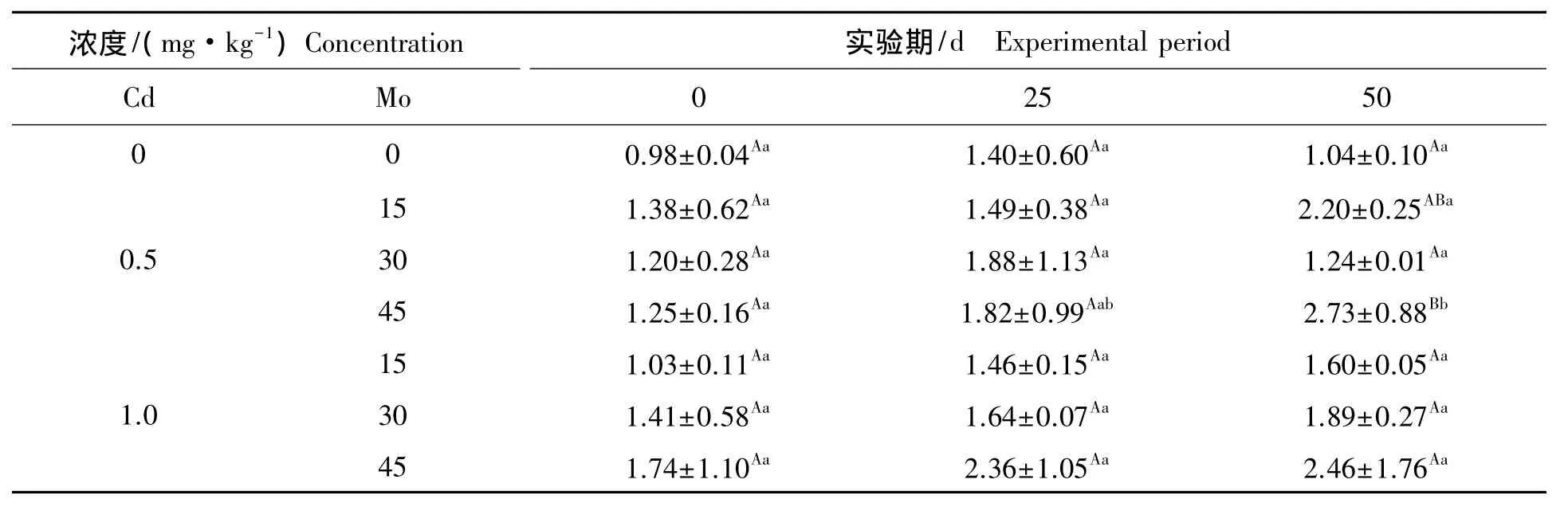
表4 钼镉联合胁迫下对山羊肾脏caspase-3m RNA表达的影响Tab.4 Effect of different concentration of M o on the expressions of caspase-3mRNA in kidney from goat under Cd stress
2.2.3 钼镉联合胁迫下对山羊肾脏caspase-3mRNA表达的影响 钼镉联合胁迫下对山羊肾脏caspase-3mRNA表达的影响见表4。组内比较,低镉高钼组在实验期内,肾脏caspase-3 mRNA表达随实验天数的增加呈上升趋势,其中第50天与第0天比较差异显著(P<0.05)。组间比较,第25天低镉低钼组、低镉中钼组、低镉高钼组、高镉低钼组、高镉中钼组和高镉高钼组与对照组比较升高,差异不显著(P>0.05),第 50 天低镉高钼组与对照组比较显著升高(P<0.05)。
2.2.4 钼镉联合胁迫下对山羊肾脏cytc mRNA表达的影响 钼镉联合胁迫下对山羊肾脏cytc mRNA表达的影响见表5。组内比较,低镉低钼组、低镉中钼组、高镉中钼组和高镉高钼组在实验期内,肾脏cytcmRNA表达随实验天数的增加呈上升趋势,其中低镉低钼组、低镉中钼组和高镉高钼组第25天、50天与第0天比较差异极显著(P<0.01),低镉低钼组第50天与第25天比较差异显著(P<0.05),高镉中钼组第25天与第0天比较差异显著(P<0.05),第50天与第0天比较差异极显著(P<0.01),第50天与第25天比较差异显著(P<0.05),低镉高钼组第25天、50天与第0天比较呈上升趋势,差异极显著(P<0.01),高镉低钼组第25天、50天与第0天比较呈上升趋势,差异显著(P<0.05)。组间比较,第25天低镉中钼组、低镉高钼组、高镉低钼组、高镉中钼组和高镉高钼组与对照组比较极显著升高(P<0.01),低镉低钼组与对照组比较显著升高(P<0.05),第50天低镉中钼组、低镉高钼组、高镉低钼组、高镉中钼组和高镉高钼组与对照组比较极显著升高(P<0.01),低镉低钼组与对照组比较显著升高(P<0.05)。
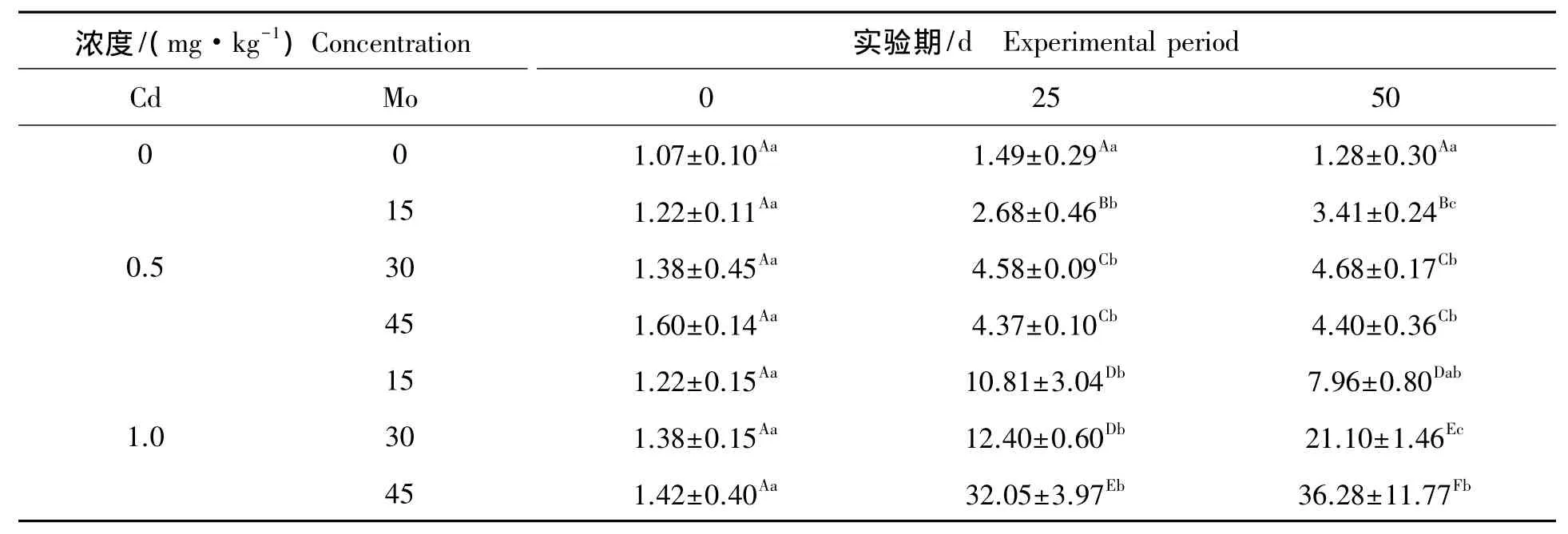
表5 钼对镉胁迫下对山羊肾脏cytc mRNA表达的影响Tab.5 Effect of different concentration of M o on the expressions of cytc m RNA in kidney from goat under Cd stress
3 讨论与结论
细胞凋亡(apoptosis)又称程序性细胞死亡(programmed cell death,PCD),是细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程。细胞凋亡可由物理、化学和生物等因素诱导产生[5]。在众多的凋亡诱导因子中,重金属是较早被认识的典型诱导因子之一。高浓度重金属对机体的重要组织器官如肝、肾及生殖系统等均会造成严重损伤,影响机体正常的生理生化代谢、遗传发育,严重时甚至会造成癌变[6]。
Bcl-2是一个多基因家族,是目前研究的最深入、最广泛的凋亡调控基因之一。在细胞凋亡过程中,Bcl-2基因家族成员通过相互竞争形成同型或异型二聚体,调控线粒体变化,间接调节蛋白酶和核酸酶活性,从而双相调节细胞凋亡[7]。Bcl-2家族可以分为两大类:一是抗凋亡基因,主要包括Bcl-2、Bcl-W、Bcl-XL、CED9、Mcl-1(myeloid cell leukemia-1)等,能保护细胞在受到外界刺激时免于凋亡;二是促凋亡基因,主要有 Bax、Bcl-XS、Bad、Bak、Bid、Bik 等[8]。在本试验中,山羊肾脏 bcl-2 的表达,钼、镉水平与bcl-2的表达有一定的剂量效应关系,高镉高钼组山羊肾脏bcl-2的表达极显著低于对照组,说明钼、镉可以抑制山羊肾脏bcl-2的表达,从而促进细胞凋亡。有研究表明bcl-2表达产物可阻止许多刺激物诱发的细胞凋亡,它抑制的可能是细胞凋亡的共同通路[9]。
Bax是Bcl-2家族中参与细胞凋亡的一个成员,Bax是一个促进凋亡的基因,过度表达时会导致细胞凋亡增多[10]。本试验结果表明,山羊肾脏bax的表达随钼、镉水平提高和攻毒时间的延长而升高,说明钼、镉可以促进山羊肾脏bax的表达,引起细胞凋亡。促进凋亡蛋白Bax可能通过与抗凋亡类Bcl-2蛋白形成异源二聚体从而拮抗Bcl-2蛋白的作用,达到促进凋亡的目的[11]。
Caspase是一个半胱氨酸蛋白酶家族,被认为在细胞凋亡过程中起着关键性的作用。在已发现的Caspase家族中,Caspase-3是哺乳类动物细胞凋亡中的一种关键蛋白酶。在正常情况下,胞质中的Caspase-3以无活性的酶原形式存在,只有当细胞凋亡时,才从无活性的酶原形式变为有活性的Caspase-3[6]。本试验结果显示,山羊肾脏caspase-3的表达随钼、镉水平剂量的增加和攻毒时间的延长而升高,说明各剂量组的组织细胞凋亡的发生与caspase-3mRNA基因表达密切相关。Caspase-3家族是直接导致凋亡细胞解体的蛋白酶系统,在细胞凋亡机制网络中居中心地位[12]。
细胞色素C(cytochrome C,Cytc)是线粒体呼吸链的重要组成部分,由两个无活性的前体分子合成的:前细胞色素C和亚铁血红素[13-14]。1996年王晓东等在细胞凋亡的研究中,首次发现细胞色素C(CytC)就是与细胞凋亡密切相关的凋亡蛋白酶激活因子Apaf-2(apoptotic protease activating factor-2),随后又发现细胞色素C(CytC)是一个来源于线粒体的细胞凋亡信号[15]。本试验结果显示,山羊肾脏cytc的表达随钼、镉水平提高和攻毒时间的延长而升高,钼、镉水平与cytc的表达有明显的剂量效应关系,特别是高镉高钼组山羊肾脏cytc的表达明显升高,说明钼、镉可以导致山羊肾脏cytc的表达升高,引起细胞凋亡。在哺乳动物细胞中,线粒体通路是最普遍的凋亡途径,而细胞色素C正是这条凋亡途径上的关键因子,细胞色素C的释放是细胞凋亡的关键步骤之一[16]。
钼镉联合胁迫导致山羊肾脏促凋亡基因baxmRNA、caspase-3mRNA及cytc mRNA的表达量升高,抗凋亡基因bcl-2mRNA的表达量下降,从而引起肾脏的损伤,且随着钼和镉浓度的增加,促凋亡基因的表达越高,抗凋亡基因的表达越低。说明钼镉联合对山羊肾脏细胞凋亡基因的表达呈现协同毒性效应。
[1]王荣梅,庄煜,曹华斌,等.钼对镉胁迫下山羊肝功能和病理损伤的研究[J].江西农业大学学报,2014,36(2):371-377.
[2]肖春文,罗秀云,田云,等.重金属镉污染生物修复的研究进展[J].化学与生物工程,2013(8):1-4.
[3]郭小权,胡国良,刘姝.动物必需的微量元素-钼[J].郑州牧业工程高等专科学校学报,2001,21(1):26-28.
[4]杨自军.镉的污染及对动物的危害与防治[J].中国动物保健,2008(5):55-60.
[5]刘欣梅,项黎新,邵健忠,等.重金属诱导细胞凋亡的分子机制[J].细胞生物学杂志,2004,26(4):235-240.
[6]李晋,曹枫.铅对小鼠睾丸生精细胞凋亡及caspase-3,bcl-2和bax基因表达的影响[J].安徽师范大学学报,2011,34(6):559-564.
[7]蓝荣芳,李志刚,刘正湘.人参皂甙Rb1对大鼠缺血再灌注心肌细胞 Bcl-2、Bax、Bad、Fas基因表达的影响[J].中国组织化学与细胞化学杂志,2002,11(2):149-152.
[8]李超,伏圣博,刘华玲,等.细胞凋亡研究进展[J].世界科技研究与发展,2007,29(3):45-53.
[9]彭洪涛,刘淑萍.Bcl-2基因与细胞凋亡关系的研究进展[J].内蒙古医学杂志,2006,38(4):348-351.
[10]Oltval Z N,Milliman C L,Korsmeyer S J.Bcl-2 heterodin erizes invivo with a conserved homologbax that accelerates programmed cell death[J].Cell,1993,74(4):609.
[11]路艳艳.二甲基甲酰胺致人肝细胞凋亡及对bcl-2、bax和caspase-3表达影响的研究[D].杭州:浙江大学,2007.
[12]赵瑞杰,李引乾,王会,等.Caspase 家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):73-78.
[13]Shi Y.Mechanism of caspase activation and inhibition during apoptosis[J].Mol Cel1,2002(9):459-470.
[14]吴兰芳,杨爱珍,刘和,等.线粒体调控细胞凋亡的研究进展[J].中国农学通报,2010,26(8):63-68.
[15]李宏,冯有胜.线粒体cytc的释放机制及其在细胞凋亡中的作用[J].生物信息学,2010,8(3):210-213.
[16]潘敏慧,陈默,黄淑静,等.家蚕细胞色素C基因的克隆及其蛋白在家蚕凋亡细胞中的释放[J].中国农业科学,2009,42(7):2546-2551.
