黑暗条件下木薯叶绿体比较蛋白质组学初步研究
2015-05-28徐兵强贺庭琪王力敏王旭初郭安平
徐兵强,贺庭琪,王力敏,王 丹,孙 勇,王旭初*,郭安平*
(1.海南大学 农学院,海南 海口 570228;2.中国热带农业科学院 热带生物技术研究所,海南 海口 571101)
木薯(Manihot esculenta Crantz)为大戟科(Euphorbiaceae)木薯属(Manihot Miller)植物,原产于热带南美洲地区,是世界3大薯类作物之一,为世界7亿多人口提供基本食物,也是淀粉工业和生产燃料乙醇的主要来源[1]。木薯具有独特的理化性能、重要经济价值和相对较少的基因组,现逐渐成为热带作物研究的模式作物,其光合理化性质明显优于其他热带作物,具有较高的净光合速率、高光不饱和以及介于C3和C4结构之间的结构特征[2]。因此,研究其高光效机理是木薯基础研究的重要目标之一。
由于木薯基因型高度杂合且光合作用过程极其复杂,目前木薯光合作用研究主要集中在各种光合生理指标的测定等方面,对于木薯光合作用特性及其高光效机理方面的研究相对较少。张杨等[3]从光合生理、叶片解剖结构、光合作用转录组比较及部分关键基因表达分析探讨栽培木薯高光效的机制及其与淀粉高效累积的关系。左应梅等[4]从生理生态角度探讨了木薯的光合特性及其对环境因子的响应,初步认为光饱和点(LSP)、胞间CO2浓度(Ci)、光补偿点(LCP)等因子可作为木薯耐荫性的评价指标。另外,不同木薯品种光合产物分配、净光合速率与Ci间关系以及叶绿素含量、叶绿素荧光参数及参与光合作用中光系统Ⅱ相关蛋白差异表达等方面的研究也有相关报道[5-6]。蛋白质组水平上,一方面,研究人员开展了低温、干旱、光照等胁迫下木薯叶片蛋白质组研究,获得了大量差异蛋白质的数据,其中在持续光照和黑暗条件下从木薯叶片中成功鉴定了差异蛋白质点129个(对应104种蛋白质),涉及10个功能类[7-10];另一方面,进行了木薯生长发育过程中叶片蛋白质组学分析,如分析了木薯从纤维根到块根过程中叶片蛋白质组的变化,成功鉴定了39个蛋白质点,涉及6个功能类[11];同时,对二倍体和四倍体木薯叶片,木薯接穗和砧木叶片以及块根也进行了比较蛋白质组学分析[12-13]。
光照既是绿色植物唯一的能量来源,又是调节其生长发育不可或缺的一种环境因子,如光照能够调控叶绿体发育等。叶绿体是植物进行光合作用的器官,对叶绿体内的各种生物过程人们已积累了许多知识,但对叶绿体蛋白质的表达还所知相对不多[14-15]。目前,仅见贺庭琪等[16]采用改进酚抽提法提取蛋白,通过双向SDS-PAGE电泳,利用基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF MS),比较了不同木薯品种叶绿体的蛋白表达谱,并对已鉴定蛋白进行了功能分类,为从“组学”方法大规模、系统性研究木薯叶绿体提供了借鉴。本研究以代表性种质SC8木薯为试验材料,通过对木薯幼苗进行1,3,5 d暗处理,应用比较蛋白质组学技术,旨在研究在黑暗条件下木薯叶绿体中受光调控蛋白的变化,以期在蛋白质水平筛选受光调控的基因,为后期深入研究提供数据支持和理论参考。
1 材料与方法
1.1 材料种植与处理
SC8木薯种茎由中国热带农业科学院热带作物品种资源研究所提供。当年3月下旬扦插种植,正常生长约3个月,植株高度约100 cm,选取生长健壮和健康植株,置于相同人工气候箱内进行不同光照处理。分为2个处理组:正常光照处理(16 h光照,1.0×105lx/8 h黑暗,28℃/25℃;CK);黑暗处理(24 h黑暗,25℃;D,dark),相对湿度均为70%。分别于处理后1,3,5 d取成熟叶片作为实验材料。采集的木薯叶片液氮速冻,-80℃保存备用。
1.2 试剂
叶绿体提取缓冲液:1 mmol/L氯化镁,0.3 mol/L山梨醇,50 mmol/L 4-羟乙基哌嗪乙磺酸/氢氧化钾(pH 7.8),2 mmol/L乙二胺四乙酸,体积分数0.04% β-巯基乙醇和1 g/L交联聚维酮。
叶绿体分离缓冲液:1 mmol/L氯化镁,0.3 mol/L山梨醇,50 mmol/L4-羟乙基哌嗪乙磺酸/氢氧化钾(pH 7.8),2 mmol/L 乙二胺四乙酸。
BPP法蛋白提取缓冲液:100 mmol/L Tris,100 mmol/L乙二胺四乙酸,50 mmol/L硼砂,50 mmol/L维生素C,10 g/L交联聚维酮,体积分数1%Triton X-100,体积分数2% β-巯基乙醇和300 g/L蔗糖,pH 8.0。
蛋白裂解液:7 mol/L尿素,2 mol/L硫脲,20 g/L 3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐,13 mmol/L二硫苏糖醇,体积分数1%IPG buffer。
标准Laemmli buffer:62.5 mmol/L Tris-HCl,20 g/L十二烷基磺酸钠,体积分数10%甘油,体积分数5% β-巯基乙醇,0.01 g/L 溴酚蓝。
胶条平衡液:50 mmol/L Tris-HCl,6 mol/L尿素,体积分数30%甘油,20 g/L十二烷基磺酸钠,0.02 g/L溴酚蓝。
GAP凝胶染色液:1.25 g/L考马斯亮蓝G-250,100 g/L硫酸铵,体积分数5%磷酸,体积分数30%乙醇,体积分数10%甲醇;
凝胶脱色液:体积分数30%乙醇,体积分数5%乙酸。
酶缓冲液:1 mmol/L氯化钙,25 mmol/L碳酸氢铵,pH 8.5。
1.3 方法
1.3.1 叶绿体分离 木薯叶绿体的分离方法采用Percoll梯度密度离心法[16-17]。
1.3.2 叶绿体蛋白提取 基于酚抽法[18]改进的BPP(Borax/PVPP/Phenol)法,具体操作步骤参考Wang 等[19]的方法。
1.3.3 蛋白定量 主要参考Bradford方法[20],每个样品至少重复3次。
1.3.4 SDS-PAGE凝胶电泳 一维凝胶电泳(1-DE):采用不连续胶SDS-PAGE法[21],浓缩胶浓度为4%,分离胶浓度为12.5%,每孔蛋白上样量约为30μg,与2倍标准 Laemmli buffer等体积混匀后上样。在Hoefer SE600X标准垂直板电泳仪上进行,电泳条件为16℃恒温电泳3 h左右,电泳参数设置为3W/gel 50 min,6 W/gel 2 h。
二维凝胶电泳(2-DE):2-DE蛋白上样量约为1 200μg,上样总体积为455μL。蛋白样品在水化盘内使24 cm的pH 4-7线性IPG干胶条被动吸胀,水化16 h左右,胶条上覆盖矿物油防止样品挥发。第一向等电聚焦程序设定为:250 V,3 h;500 V,2 h;1 000 V,1 h;1 000 V升至10 000 V,3 h;10 000 V,130 000 Volt hour(Vhr),每根胶条限流50μA。聚焦结束后,用含1%DTT的平衡液和含4%碘乙酰胺的平衡液各平衡胶条15 min,平衡结束后在Ettan Daltsix电泳仪(GE Healthcare)中进行第二向SDSPAGE,电泳条件为 16 ℃恒温电泳约 4.5 h,电泳参数设置为 1.5W/gel 1 h,8W/gel 3.5 h。
1.3.5 凝胶染色及图像采集分析 凝胶染色主要采用Wang等[22]改进的考马斯亮蓝染色法。凝胶染色后用ImageScanner III扫描仪(GE Healthcare)进行扫描和图像采集。用ImageMaster 2D Platinum软件(Amersham Bioscience)进行分析,包括蛋白点检测、凝胶匹配和统计分析等,获得差异表达蛋白点。
1.3.6 蛋白点胶内酶解 具体步骤参考王旭初等[23]的简化胶内酶解方法。挖取的蛋白点酶解后收集上清液,可直接用于质谱鉴定。
1.3.7 酶解产物质谱鉴定及数据库搜索 酶解产物质谱鉴定采用Bruker公司的基质辅助激光解析电离飞行时间质谱仪(MALDI-TOF MS/MS II,Bruker),具体操作参考Shen等[24]的方法。所得数据通过Mascot Distiller软件分析,分析结果利用Matrix science网站(http://www.matrixscience.com)的搜索引擎进行数据搜索和匹配。检索参数设置为:
Databases为 NCBInr、Taxonomy为 Viridiplantae(Green plants)、Enzyme为 Trypsin、Fixed modifications为 Carbamidomethyl(C)、Missed cleavages为 1、肽质量性质为单电荷和[MH+]、variable modifications为Oxidation(M)、Peptide tol.为±300 μg/mL。软件设定检索蛋白匹配达到大于95%的可信度(P<0.05),鉴定得到蛋白具体信息。
2 结果与分析
2.1 木薯叶绿体蛋白质组2-DE图谱分析
利用ImageMaster 2D Platinum软件对黑暗条件下木薯叶绿体差异表达蛋白质组图谱进行分析,自动检测结合人工去除,分别检测出(439±19)个、(501±22)个和(415±17)个高清晰且重复性强的蛋白点,经对这些蛋白质点的表达丰度进行差异检测,共获得差异蛋白点186个(表达丰度变化1.5倍以上),包括46个时间特异性蛋白点和140个丰度表达蛋白点(图1),具体分布情况如图2,与对照样品相比,仅在处理后1天表达的差异蛋白质点12个(下调表达的5个)、处理后3天表达的差异蛋白质点15个(下调表达的14个)、处理后5天表达的差异蛋白质点19个(下调表达的9个)。

图1 木薯叶绿体总蛋白质双向电泳结果Fig.1 2-DE maps of cassava chloroplast proteins
2.2 质谱鉴定及生物信息学分析
分别选取不同处理时间下15个重复性好且分离性好的代表性差异蛋白点进行胶内酶解,随后进行一级质谱和二级质谱鉴定,获得了比较好的PFF和PMF图谱(图3-A)。由于热带作物木薯没有专用蛋白数据库,因此将质谱结果通过Mascot Distiller软件分析后,利用Matrix Science搜索引擎(http://www.matrixscience.com/search)在 NCBInr(NCBI-National center for biotechnology information non-redundant database)绿色植物总库中进行搜索,经一级质谱和二级质谱,共鉴定差异蛋白质点28个,最终有8个蛋白点的一级质谱搜库得分值超过了72分可信值(P<0.05%),有20个蛋白点的二级质谱搜库得分超过43分可信度(P<0.05%)。结果见表1和图1。
对搜库得到的可信蛋白理论等电点和分子质量与实验测得等电点和分子质量进行比较,发现实验值和理论值基本一致,在雷达示意图中比值都集中在1附近(图3-B)。只有少数蛋白的等电点和分子质量出现偏差,例如C1,鉴定结果发现这些蛋白是某些蛋白的亚基,而执行生物学功能的蛋白通常是由多亚基组成,在进行变性胶电泳时可以将其各个亚基分离。因此,等电点和分子质量会出现偏移现象。
参照拟南芥蛋白质数据信息,利用KABOS2.0系统进行了参与的生物途径分类,结合文献相关信息,根据鉴定的28个差异蛋白功能,可将蛋白质分为9类(图3-C):捕光复合体/叶绿素结合蛋白(7%)、光系统Ⅱ(11%)、光合电子传递(7%)、光系统Ⅰ(7%)、能量代谢(14%)、Calvin循环(21%)、氨基酸代谢(4%)、胁迫防御(11%)和未知功能(18%)。
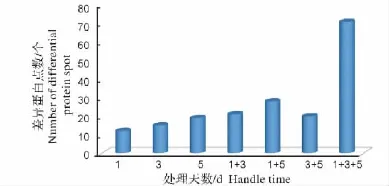
图2 差异蛋白质点在各处理时间中的分布情况Fig.2 Distribution of differentially expressed proteins in the processing time
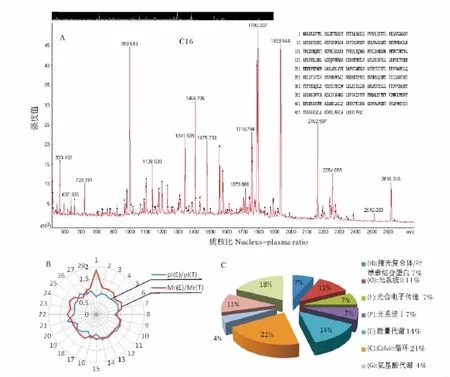
图3 暗处理下木薯叶绿体中典型差异蛋白点MALDI-TOFMS质谱鉴定分析Fig.3 MALDI-TOFMSanalysis of typical variable protein spots from cassava chloroplast under dark treatment
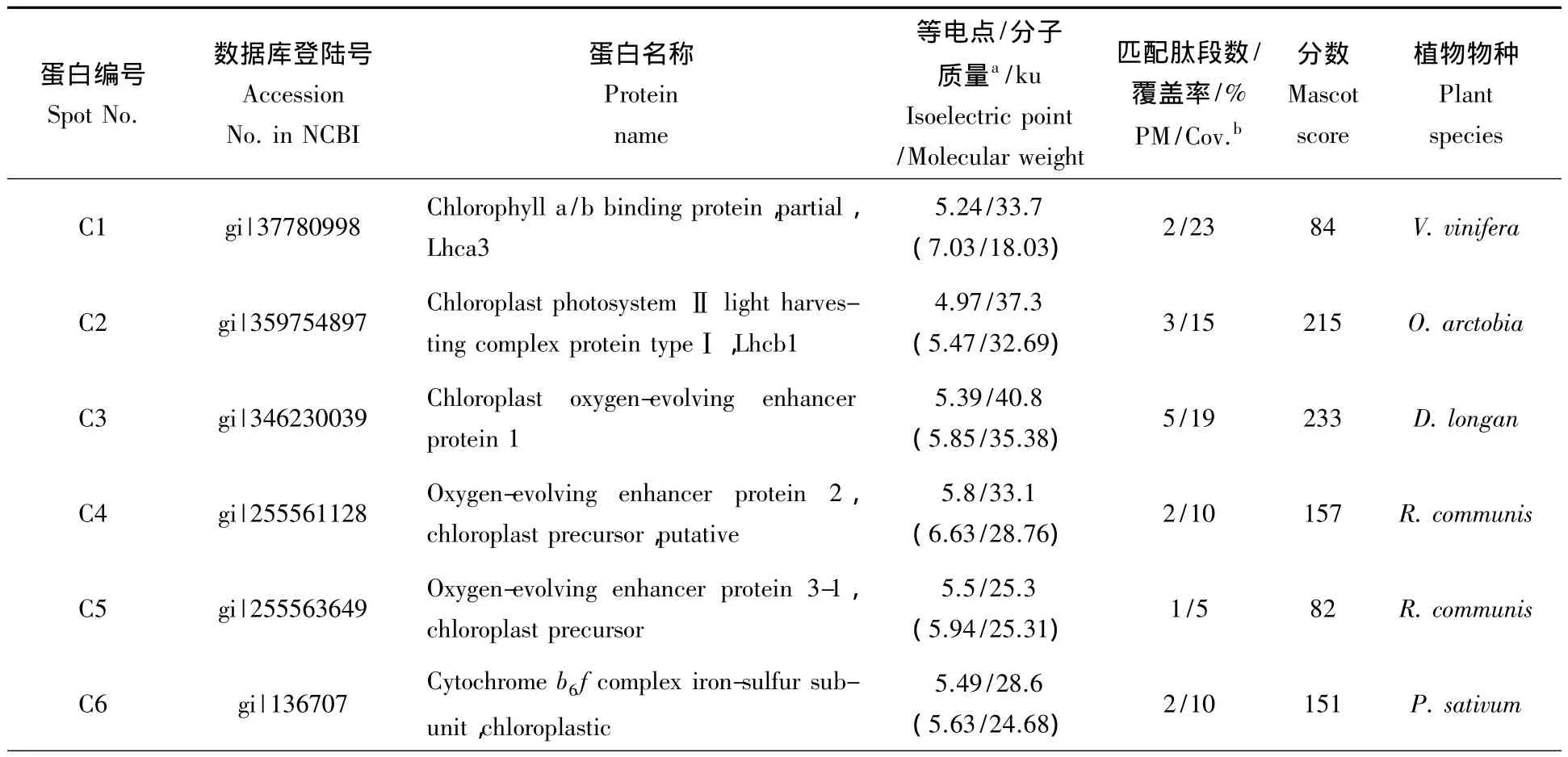
表1 差异蛋白点质谱鉴定结果Tab.1 Putative identities of the MALDI-TOF-MS identified proteins

续表1
3 结论与讨论
本研究鉴定结果表明,差异蛋白质几乎涵盖了如碳同化和光合作用等主要的叶绿体代谢调控途径中所涉及的蛋白质。
3.1 光反应相关蛋白质
笔者鉴定得到了光反应相关蛋白质13个:光系统Ⅱ(PSⅡ)蛋白4个、光系统Ⅰ(PSⅠ)蛋白4个、Cyt b6f复合体蛋白1个和ATP合酶复合体蛋白4个(表1)。其中,(1)捕光复合体相关蛋白质。PSⅠ中的叶绿素a/b结合蛋白Lhca3(C1)在暗处理后,表达量为先下调后上调,PSⅡ中的捕光复合物蛋白Lhcb1(C2)表达量逐渐上升。有研究[25-27]表明,作为捕光复合体的重要组成部分,捕光色素结合蛋白的降解受光调控。这与在不同光照强度下玉米和小黑杨类囊体膜上捕光色素结合蛋白变化趋势相同。(2)PSⅡ中放氧复合体的外周蛋白质。放氧增强蛋白(oxygen-evolving enhancer protein,OEE)主要功能是催化水裂解而放出氧气,还原质体醌,产生跨膜质子梯度。研究[28-29]表明,当植物受到严重胁迫时与光合作用相关蛋白会发生降解,而OEE就是光合相关蛋白的降解产物,且OEE2表达量的升高可以修复因降解造成的蛋白结构破坏,保证氧循环正常。OEE1(C3)、OEE2(C4)和OEE3(C5)在暗处理后表达量均先上调后下调。这初步说明,暗处理后光合相关蛋白降解发生到一定程度,OEE2表达水平虽有所提高,但最终仍抑制了水的分解,减少了分子氧的积累。在拟南芥响应光照胁迫过程中OEE蛋白的表达也发生了变化[30]。(3)细胞色素 b6f(Cyt b6f)相关蛋白质。Cyt b6f含有 Cyt f、Cyt b6和铁-硫蛋白(RfeS),在PSⅡ和PSⅠ光反应复合体间执行电子传递功能,氧化质醌,形成跨膜质子梯度为ATP合成提供原动力[31]。RfeS(C6)表达量呈先下调后升高。推测可能是暗处理后光合电子传递链相关组分的合成受到了抑制,导致PSⅡ电子传递速率下降,进而影响色素的正常合成。(4)PSⅠ反应中心相关蛋白质。PSⅠ在光反应中的主要功能是驱动质体兰素(Pc)与氧铁硫蛋白(Fd)之间的氧化还原反应,促使电子从Pc传递到Fd。本实验鉴定了PSⅠ蛋白3个(C7-C9),表达量呈先下调后升高,其中铁氧还蛋白-烟酰胺腺嘌呤二核苷磷酸还原酶(FNR)的催化产生还原力NADPH是叶绿体中光反应电子链的最后一步。暗处理后FNR蛋白(C9)表达量呈先下调后升高,可能抑制了NADPH的产生,从而阻碍了同化作用。(5)ATP合酶亚基蛋白质。叶绿体ATP合酶属于F型ATP合酶家族,是能量代谢的关键酶,其主要功能是控制类囊体腔内质子流出,其表达量变化会影响叶绿体光能转化能力[32]。ATP合酶蛋白(C10-C13)表达量在暗条件下表达量先升高后降低,光照环境的变化可能是抑制ATP合酶的正常表达,减少ATP能量的释放,并与FNR共同作用产生了光合逆境。
类囊体膜是植物光合作用中光能转化成化学能的主要部位,以上4种复合体都定位在类囊体膜上,绝大多数蛋白在暗处理后表达量上升,这说明木薯中定位于类囊体膜上的部分蛋白含量受光调控,且木薯会通过调控类囊体膜类蛋白质以适应光照不足的环境,这与很多文献报道的结果相同[10,26-27,33-34]。4种多亚基的复合物通过联合作用,共同参与光能吸收、传递与转化、电子传递、H+输送和ATP合成等反应,最终产生ATP和NADPH。但NADPH和ATP并不是同时产生的,ATP的产生对于NADPH的生成,相互之间是怎样的作用关系和促进作用,仍有待进一步研究[35]。
3.2 Calvin循环相关蛋白质
黑暗处理影响了碳固定关键酶的表达。笔者鉴定出Calvin循环相关蛋白质4个,包括核酮糖1,5二磷酸羧化酶/加氧酶大亚基(RuBisCO LSU)、RuBisCO小亚基(RuBisCO SSU)、磷酸甘油酸激酶(phosphoglycerate kinase,PGK)、磷酸丙糖异构酶(triosephosphate isomerase,TPI)、磷酸核酮糖激酶(phosphoribulokinase,PRK)。其中,RuBisCO是植物C3途径中催化Calvin循环中碳固定的第一步反应,由大小两种亚基组成。笔者鉴定了RuBisCO大亚基和小亚基各1个(C14-C15),暗处理后表达量均呈下降趋势。PGK是糖酵解的关键酶,其自身及其催化的产物3-磷酸甘油酸,在呼吸代谢途径中与能量的产生有密切的关系。PGK(C16)在暗处理后表达量下调。TPI是糖酵解重要酶,催化磷酸二羟丙酮和甘油醛-3-磷酸之间的可逆反应。TPI(C17)在暗处理后表达量先下调后上调,且1天显著下调。PRK是Calvin循环特有的酶,是其第3个阶段的最后一步,即受体的再生,它催化5-磷酸核酮糖再生RuBP,是不可逆反应。PRK(C18)暗处理后表达量呈先下降后上调。Calvin循环中碳固定相关4种关键酶的表达模式几乎相同,即佐证了它们处于同一循环中的功能相关性及其前后衔接关系,也清楚地表明了碳固定发生的组织部位,这些蛋白质同时出现、协同配合、共同完成碳代谢过程[10,27,36]。
此外,碳酸酐酶是一种重要的适应胁迫条件的光合碳代谢调节酶,主要参与C4途径的碳同化过程,主要作用是通过催化CO2的可逆水合反应来促进CO2向RuBisCO扩散,提高RuBisCO的羧化速率[37]。本研究中,碳酸酐酶(C19)暗处理后表达量先下调后显著上调,推测这既提高光能转化为化学能效率,也说明木薯可能启动C4途径的碳同化过程,而为满足木薯生长需要提供更多能量。
3.3 脯氨酸代谢相关蛋白质
谷氨酰胺合成酶(glutamine synthetase,GS)是植物体内氮元素代谢关键酶,它催化由氨基酸转化的谷氨酸与NH4+同化成谷氨酰胺,起到转氨作用,而给植物供给营养,其表达受环境(光、氮、CO2)和发育因子的影响[38]。本研究中,GS(C20)在暗处理后表达量呈下降趋势。初步说明木薯叶绿体中GS表达受光调控,与拟南芥和木薯叶片中的研究报道一致[10,39],推测GS通过影响叶绿体中氮的积累,使叶绿素合成受阻,而影响光合速率。
3.4 胁迫防御相关蛋白质
本研究中,笔者鉴定出3个参与调节氧化还原过程的蛋白质,其中Fe-超氧化物歧化酶(C21)、过氧化物氧化还原酶(C22)和硫氧还蛋白(C23)在暗处理后表达量均上升,但幅度不一,前两种酶是酶促防御系统的关键酶,能够清除植物体内的过多的活性氧和自由基以提高植物的抗逆性;后一种酶是通过保护叶绿体的结构来对抗暗处理下引起的氧化胁迫,说明暗处理可能引起木薯细胞内反应性氧化物水平升高,抗性蛋白表达量上升起到抵抗氧化压力的保护作用,使细胞免于过早死亡[10,36,40]。
叶绿体是植物光合作用的场所,光合作用是木薯产量和品质的基础,深入研究木薯光合作用对于了解和发现木薯高光合效率具有重要意义。尽管木薯基因组测序已经完成,但绝大多数基因的功能是未知的。本研究中,通过阐述木薯叶绿体在黑暗条件下的蛋白质组变化,在蛋白质水平上鉴定出部分蛋白质的表达可能受光调控,为后续深入研究搭建了数据和技术平台,但是由于蛋白质组学的研究是以基因组学产生的大量数据为基础,尤其是基因组序列,所以仍有许多差异蛋白未鉴定,这些蛋白中可能也存在着许多有价值的关键蛋白,需要在今后的研究中进一步做功能鉴定分析。
致谢:仝征、庄盈婷、周承、常丽丽和王红岩给予了实验指导和帮助,谨致谢意!
[1]El-sharkawy M A.Cassava biology and physiology[J].PlantMolecular Biology,2004,56(4):481-501.
[2]张鹏,安冬,马秋香,等.木薯分子育种中若干基本科学问题的思考与研究进展[J].中国科学,2013,43(12):1082-1089.
[3]张杨,卢诚,王文泉.木薯栽培种与野生种叶片光合器官结构和酶学差异[J].中国农学通报,2012,28(25):144-149.
[4]左应梅,陈惠娟,杨重法,等.华南8号木薯光响应参数日变化及其主要影响因子[J].中国农学通报,2010,26(13):371-375.
[5]苏爱娟,周凤珏,许鸿源,等.IBA和CC单独及配合使用对木薯光合作用等生理生化指标的影响[J].作物杂志,2006(3):20-23.
[6]陈霆,李开绵,安飞飞,等.华南系列木薯叶绿素荧光参数及光系统Ⅱ相关蛋白表达水平分析[J].江西农业大学学报,2014,36(3):514-519.
[7]徐娟.木薯抗旱生理生化指标筛选与蛋白质组学研究[D].海口:海南大学,2013.
[8]安飞飞,李庚虎,陈霆,等.低温胁迫对木薯叶片叶绿素荧光参数及PSП相关蛋白表达水平的影响[J].湖南农业大学学报:自然科学版,2014,40(2):148-152.
[9]王力敏,王东阳,王丹,等.木薯块根膨大期韧皮部和木质部比较蛋白组学初步研究[J].热带作物学报,2014,35(3):525-533.
[10]贺庭琪.木薯叶片应答不同光照处理的比较蛋白质组学初步研究[D].海口:海南大学,2013.
[11]Mashamon M,Sittiruk R,Jiemsup S,etal.Leaf proteomic analysis in cassava(Manihotesculenta,Crantz)during plant development,from planting of stem cutting to storage root formation[J].Planta,2011,233(6):1209-1221.
[12]安飞飞,凡杰,李庚虎,等.华南8号木薯及其四倍体诱导株系叶片蛋白质组及叶绿素荧光差异分析[J].中国农业科学,2013,46(19):3978-3987.
[13]安飞飞.嫁接木薯代谢途径交互应答的蛋白质组学研究[D].海口:海南大学,2013.
[14]Deng XW,Quail PH.Signalling in light-controlled development[J].Seminars in Cell Developmental Biology,1999,10:121-129.
[15]Wang H,Deng XW.Dissecting the phytochrome a-dependent signaling network in higher plants[J].Trends Plant Science,2003,8:172-178.
[16]贺庭琪,徐兵强,郭安平,等.不同品种木薯叶绿体比较蛋白质组学初步研究[J].热带作物学报,2013,34(6):1090-1097.
[17]Fan P X,Wang X Ch,Kuang TY,etal.An efficientmethod for the extraction of chloroplastproteins compatible for 2-DE and MS analysis[J].Electrophoresis,2009,30(17):3024-3033.
[18]Saravanan R S,Rose JC.A criticalevaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J].Proteomics,2004,4:2522-2532.
[19]Wang X C,Li X F,Han H P,et al.A protein extractionmethod compatible with proteomic analysis for euhalophyte Salicornia europaea L[J].Electrophoresis,2007,28(21):3976-3987.
[20]Bradford M M.A rapid and sensitivemethod for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[21]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[22]Wang X C,Wang D Y,Wang D,et al.Systematic comparison of technical details in CBBmethods and development of a sensitive GAP stain for comparative proteomic analysis[J].Electrophoresis,2012,33(2):296-306.
[23]王旭初,范鹏祥,李银心.一种适用于质谱分析的简化胶内酶解方法[J].植物生理与分子生物学报,2007,33:449-455.
[24]Shen SH,Jing Y X,Kuang T Y.Proteomics approach to identify wound-response related proteins from rice leaf sheath[J].Proteomics,2003,3(4):527-535.
[25]Caffarri S,Frigerio S,Olivieri E,et al.Different accumulation of Lhcb gene products in thylakoid membranes of Zea mays plants grown under contrasting light and temperature conditions[J].Proteomics,2005,5:758-768.
[26]Lindahl M,Yang D H,Anderson B.Regulatory proteolysis of themajor light-harvesting Chlorophyll a/b protein of photosystem П by a light-induced membrane-associated enzymic system[J].European Journal of Biochemistry,1995,231(2):503-509.
[27]李华华.不同暗处理的小黑杨叶片蛋白质组学研究[D].哈尔滨:东北林业大学,2011.
[28]Wassim A,Ichrak B R,Saida A.Putative role of proteins involved in detoxification of reactive oxygen species in the early response to gravitropic stimulation of poplar stems[J].Plant Signaling & Behavior,2013,8(1):e22411.
[29]Yanga,Lim J.Empirical analysis of transcritional activity in the Arabidopsis genome[J].Science,2003,302(5646):842-846.
[30]GranlundI,Hall M,Kieselbach T,etal.Light induced changes in protein expression and uniform regulation of transcription in the thylakoid lumen of Arabiclopsis thaliana[J].PLoSOne,2009,4(5):e5649.
[31]Baniulis D,Yamashita E,Zhang H,et al.Structure-function of the cytochrome b6f complex[J].Photochem Photobiol,2008,84:1349-1358.
[32]He F,Sam ra H S,Johnson E A,et al.C-Terminalmutations in the chloroplast ATP synthase gamma subunit impair ATP synthesis and stimulate ATP hydrolysis[J].Biochemistry,2008,47(2):836-844.
[33]兰金苹,李莉云,贾霖,等.叶绿体基因编码蛋白质在水稻叶片生长过程中的表达研究[J].生物化学与生物物理进展,2011,38(7):652-660.
[34]贺庭琪,郭安平,杜伟,等.植物叶绿体蛋白质组学研究进展[J].热带作物学报,2011,32(11):2196-2203.
[35]叶济宇,王颖君.铁氧还蛋白-NADP还原酶参与的循环电子传递[J].生物化学与生物物理学报,1997,29(1):40-46.
[36]赫卫,姜振峰,赵琳,等.不同光长条件下大豆蛋白质组比较研究[J].大豆科学,2009,28(3):388-393.
[37]蒋春云,马秀灵,沈晓艳,等.植物碳酸酐酶的研究进展[J].植物生理学报,2013,49(6):545-550.
[38]Brugière N,Dubois F,Limami A M,et al.Glutamine synthetase in the phloem plays amajor role in controlling proline production[J].The Plant Cell Online,1999,11(10):1995-2011.
[39]Oliveria IC,Brears T,Knight T J,etal.Overexpression of cytosolic glutamine synthetase,relation to nitrogen,light,and photorespiration[J].Plant Physiology,2002,129:1170-1180.
[40]Bowler C,Alliotte T,DeLoose M,et al.The induction ofmanganese superoxide dismutase in response to stress in nicotiana plumbaginifolia[J].The European Molecular Biology Organization Journal,1989,8(1):31-38.
