日本囊对虾金属硫蛋白基因cDNA的克隆及组织表达分析
2015-05-25石壮壮
石壮壮,毛 勇,乔 莹,王 军*
(厦门大学海洋与地球学院,福建厦门361102)
日本囊对虾金属硫蛋白基因cDNA的克隆及组织表达分析
石壮壮,毛 勇,乔 莹,王 军*
(厦门大学海洋与地球学院,福建厦门361102)
根据日本囊对虾(Marsupenaeus japonicus)转录组中的金属硫蛋白(metallothionein,MT)基因片段,使用RACE基因快速测序法,获得日本囊对虾MT(Mj MT)c DNA全长.Mj MT cDNA序列全长549 bp,包含177 bp的开放阅读框(ORF),68 bp的5′非编码区(UTR)及304 bp 3′UTR,编码58个氨基酸.在其编码的氨基酸中半胱氨酸含量丰富,占氨基酸总量的31.0%,不含芳香族氨基酸,富含MT典型的Cys-X(1~3)-Cys结构.多序列对比表明,Mj MT cDNA序列与斑节对虾(Penaeus monodon)的MT cDNA序列相似度最高,为76%.Real-time PCR结果表明,Mj MT表达存在组织差异,其表达量在鳃组织中最高,其次是胃和肝胰腺.
金属硫蛋白;日本囊对虾;克隆;组织表达
金属硫蛋白(metallothionein,MT)是一类广泛存在于生物体中的低分子质量金属结合蛋白,富含半胱氨酸残基[1],Cys-X-Cys(X为除Cys以外的其他氨基酸)三肤序列是MT的特征序列.MT一般有2个独立的结构域,整个分子呈哑铃状,氨基末端的β结构域有9个半胱氨酸残基,梭基末端的α结构域有11个半胱氨酸残基[2].MT具有重金属解毒、维持微量元素平衡、清除体内自由基等生物学功能[3],能够与MT结合并诱导其表达的金属主要有Cd、Zn、Pb、Hg、Cu、Bi等,其金属诱导的能力顺序为:Cd>Zn>Cu>Hg[4].
随着社会经济的发展和人类活动的加剧,大量重金属污染物进入近海海域,引起海水质量恶化,严重破坏海洋生态系统的结构和功能[5].重金属可以沿着海洋食物链传递、富集、浓缩,最终进入处于食物链顶端的人类体内,危害人体健康[6].20世纪70年代末即有学者提出以生物组织中的MT含量作为水环境监测重金属暴露的一个分子生态毒理学指标,以期为确定水环境污染程度提供综合和客观的指标[].
对虾MT的研究目前尚处于起步阶段,已有凡纳滨对虾(Litopenaeus vannamei)[8]、斑节对虾(Penaeus monodon)[9]和中国明对虾(Fenneropenaeus chinensis)[10]的MT cDNA序列测定的报道,但日本囊对虾(Marsupenaeus japonicus)MT(Mj MT)cDNA的序列尚且未知.本研究获得了Mj MT cDNA序列,以及Mj MT在日本囊对虾不同组织中的表达量,为开展将MjMT作为日本囊对虾养殖环境污染监测的生物指标的研究,提供了理论基础.
1 材料和方法
1.1 实验材料
实验采用的日本囊对虾来源于福建省漳州市东山县赤山茂鑫水产有限公司的对虾养殖池塘,从养殖池中随机选取健康对虾5尾(体质量为(4.77±0.90)g),提取对虾肝胰腺、鳃、肌肉、胃、肠、眼柄、心等7种组织,于RNA保存液中, ̄80℃保存,用于RNA的提取.
1.2 Mj MT cDNA克隆
根据日本囊对虾转录组中的MT cDNA片段,设计5′和3′端特异性引物(表1中F1、R1、F2、R2),采用cDNA末端快速扩增技术(RACE)扩增Mj MT c DNA的5′和3′末端.

表1 Mj MT c DNA克隆测序及real-time PCR中所用的引物Tab.1 Primers used to amplify the Mj MT cDNA full length and real-time PCR
在3′RACE中,利用巢式PCR方法,首先用F1和RA进行PCR反应,所得的产物稀释10~50倍后,取1 μL作为模板,利用F2和RA再进行PCR扩增.PCR反应体系为:10×Buffer 2.5μL,d NTP(2.5 mmol/L)2 μL,引物10 nmol/m L各0.5μL,模板0.5μL,2.5 U/ μL的Taq酶0.5μL,使用蒸馏水将反应体系补充至25 μL.反应条件为:95℃变性5 min;95℃30 s,57℃30 s,72℃30 s,30个循环;72℃延伸10 min.
在5′RACE中,利用末端转移酶和d ATP在cDNA末端加上poly(A)尾巴,以加尾后的cDNA为模板,进行如下PCR反应:10×Buffer 5μL,d NTP(2.5 mmol/L)5μL,引物Oligo d T-RA(10 nmol/m L)各1 μL,引物RA和R1(10 nmol/m L)各1.5μL,模板(100μg/m L)2μL,2.5 U/μL的Taq酶0.5μL,使用蒸馏水将反应体系补充至50μL.反应条件为:95℃5 min;57℃5 min;72℃60 min;95℃45 s,57℃45 s,72℃60 s,30个循环;72℃延伸10 min.
所得的产物经1%(质量分数)琼脂糖凝胶电泳后,用凝胶回收试剂盒对目的片段进行纯化回收,纯产物与p MD18-T载体连接,转化于大肠杆菌(Escherichia coli)DH5α,将PCR检测为阳性的克隆送上海生工生物工程股份有限公司测序.利用VecScreen去除测序结果中的载体序列.利用DNAStar中的Edit-Seq对所得的片段以及5′和3′序列进行拼接和重叠序列的去除,最终获得Mj MT cDNA基因序列,并于序列首尾设计引物(F4/R4)进行PCR检验.
1.3 Mj MT cDNA序列分析
利用BLAST对所得的cDNA序列与GenBank中的核酸数据库及蛋白质数据库进行比对分析,寻求与Mj MT c DNA高度同源的序列.利用Expasy中的Prot Param程序统计MT中各种氨基酸含量并预测其理论分子质量和等电点.在Gen Bank中获得不同物种MT的蛋白序列,使用MEGA5.0软件中基于距离的邻接法(N-J法)构建系统进化树,分支置信度采用自展法(BP法)重复检验1 000次.
1.4 Real-time PCR分析Mj MT组织表达量
提取日本囊对虾各组织的总RNA,用ND2000检测RNA溶液的浓度后,采用Ta KaRa公司的Prime-ScriptTMRT Reagent Kit with gDNA Eraser试剂盒进行反转录.根据已得的Mj MT cDNA序列,利用引物设计软件Primer设计特异性荧光定量引物F3/R3,以及已知的日本囊对虾内参基因(翻译延伸因子)引物EFS20/EFA20(表1),由上海生工生物工程股份有限公司合成.制作标准曲线,确定目的基因与内参基因的扩增效率相等,再使用2 ̄ΔΔCt法进行相对定量.
荧光定量采用20μL体系,包括10μL的SYBR Premix Ex TaqTMⅡ(2×),0.4μL的ROX Reference DyeⅡ(50×),2μL的cDNA模板,引物各0.6μL,6.4μL的d H2O.PCR扩增程序为两步法:95℃10 min;95℃15 s,60℃1 min,40个循环;溶解温度:95℃15 min,60℃1 min,95℃15 s.然后用2 ̄ΔΔCt法对荧光定量结果进行分析.
2 结 果
2.1 Mj MT cDNA序列
Mj MT cDNA(Gen Bank登录号:KP226136)序列全长549 bp,包含177 bp的开放阅读框(ORF),68 bp的5′非编码区(UTR)及304 bp 3′UTR,编码58个氨基酸(图1).序列对比结果显示,Mj MT cDNA序列与斑节对虾的MT cDNA序列相似度最高,为76%.通过软件Prot Param分析得出该蛋白的理论分子质量为6 180.3 u,等电点8.28,不稳定指数(Ⅱ)为51.66,脂肪族指数为3.45.亲水性总平均值(GRAVY)为 ̄0.719,表明MT是亲水性蛋白.推测氨基酸分子式为C234H395N75O82S19.

图1 日本囊对虾MT基因cDNA全长及氨基酸序列Fig.1 The cDNA sequence and amino acid sequence of MT gene from M·japonicus
从MT系统进化树分析可以看出,日本囊对虾与凡纳滨对虾、斑节对虾和中国明对虾聚集在一起,然后与锯缘青蟹(Scylla serrata),中华绒赘蟹(Eriocheir sinensis),美洲赘龙虾(Homarus americanus)等甲壳类汇集,与斑马鱼(Danio rerio)和人类(Homo sapiens)等高等脊椎动物,及拟南芥(Arabidopsis thaliana)等相距较远,充分体现了物种之间的进化地位,与日本囊对虾的实际生物学分类地位基本一致(图2).
2.2 Mj MT氨基酸特征序列
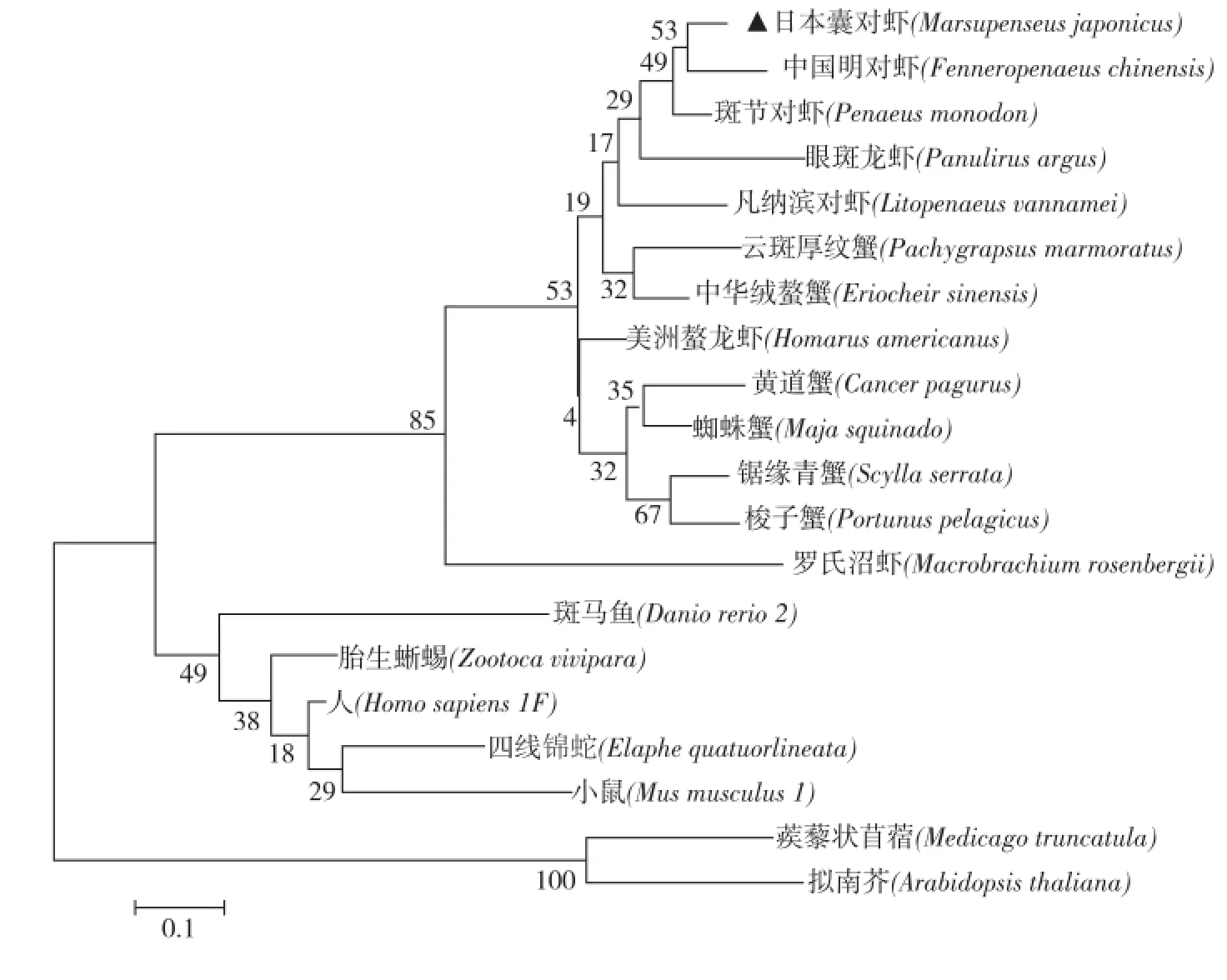
图2 基于MT蛋白序列构建的NJ系统进化树Fig.2 Phylogenetic tree of MT by Neighbor-Joining
Mj MT富含MT典型的Cys-X(1~3)-Cys结构,其中有5个Cys-X-Cys结构,分别是CEC、CQC、CRC、CSC、CKC;3个Cys-X2-Cys结构,分别是CKSC、CSPC、CEKC;5个Cys-X3-Cys结构,分别是CKDRC、CKKGC、CTSGC、CAKTC、CQKPC;2个Cys-Cys结构.具有与其他甲壳类动物相同的特征序列CEKCXXXCXCX(CEKCTSGCSCP)(X为除半胱氨酸以外的其他氨基酸).
2.3 Mj MT组织表达
Mj MT基因表达广泛存在于日本囊对虾各组织中,肝胰腺、鳃、胃、肠、肌肉、心脏、眼柄中均有表达,但表达量存在差异,其表达量在鳃组织中最高,其次是胃和肝胰腺(图3).ANOVA单因素方差分析显示,鳃、胃和肝胰腺的表达量之间存在显著差异(p<0.05).肌肉、心脏、眼柄、肠的表达量都较低,并且相互之间差异不显著.

图3 MT m RNA在日本囊对虾不同组织中表达量的相对值Fig.3 The expression of M·japonicus MT m RNA in different tissues
3 讨 论
MT被定义为一个超家族,现MT超家族共分为脊椎动物MTs、软体动物MTs、甲壳动物MTs、棘皮动物MTs、昆虫动物MTs、线虫MTs、原核生物MTs、植物MTs等15个家族.同一家族的MT共同拥有特有的序列特征并在进化上相关[11].由系统进化树可知,实验所得MT与甲壳动物的同源性最高,并含有MT共有的特征序列,因此Mj MT蛋白属于甲壳动物MTs.
在甲壳动物中,蟹类普遍存在CACC串联重复序列[12],串联重复的CACC被认为是MT翻译的结合位点[13],但在Mj MT cDNA的3′UTR发现串联重复序列为GAGG(图1单下划线标注).对虾属中已知MT cDNA序列的凡纳滨对虾、斑节对虾和中国明对虾中均不存在串联重复的CACC,但都含有GAGG的串联重复.对虾此串联重复序列在位置上和蟹类的CACC相似,是否起同样的功能,有待进一步研究. Mj MT cDNA还含有被认为是核酸降解信号的ATTTA[14](图1双下划线标注),以及典型的多聚腺昔酸加尾信号序列:AATAAA[12](图1波浪线标注).
关于MT在甲壳动物组织中的分布情况,不同的研究者得到的结果有所差异.Chavez-Cooker等[15]研究美洲鳌龙虾得到的结果显示,肝胰腺MT的表达量大于鳃.Ren等[16]研究中华绒赘蟹MT在组织中分布的结果显示,MT在肝胰腺的表达量显著高于鳃、胃等其他组织.郑丽明等[9]在斑节对虾中的研究结果显示,MT在卵巢中的表达量最高,其次是胃,而肝胰腺表达量最低.Wu等[17]在重金属诱导凡纳滨对虾MT表达量变化的实验中发现,鳃和肝胰腺中的MT表达量相近.
本研究中,Mj MT的表达量在鳃中最高,其次是胃和肝胰腺,与Amiard等[]的研究结果相似.Amiard等[]认为,在甲壳动物中,鳃为重金属的摄取组织,胃、肝胰腺和肠等消化腺是重金属的储藏和排泄组织,这些组织中具有较高的MT表达量.肝胰腺MT的表达量虽然相对鳃和胃较低,但是高于肌肉、心脏等其他组织.在正常生理条件下,肝胰腺的MT表达量不高,但是在重金属胁迫下,肝胰腺的MT表达量有明显上升,并且有剂量效应[19].
本研究从日本囊对虾中获得了Mj MT cDNA序列,以及Mj MT的组织分布情况,为开展研究以MT作为监测日本囊对虾受重金属污染的生物指标,提供了理论基础.
[1] Kojima Y.Definitions and nomenclature of metallothioneins[J].Methods in Enzymology,1990,205:8-10.
[2] Haq F,Mahoney M,Koropatnick J.Signaling events for metallothionein induction[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2003,533(1/2):211-226.
[3] 赵之伟,曹冠华,李涛.金属硫蛋白的研究进展[J].云南大学学报:自然科学版,2013,35(3):390-398.
[4] Klaassen C D,Lehman-Mc Keeman L D.Regulation of the isoforms of metallothionein[J].Biological Trace Element Research,1989,21(1):119-129.
[5] 谷河泉,陈庆强.中国近海持久性毒害污染物研究进展[J].生态学报,2008,28(12):6243-6251.
[6] 常晋娜,瞿建国.水体重金属污染的生态效应及生物监测[J].四川环境,2005,24(4):29-33.
[7] Livingstone D R.Biotechnology and pollution monitoring:use of molecular biomarkers in the aquatic environment[J].Journal of Chemical Technology and Biotechnology,1993,57(3):195-211.
[8] 彭金霞,房振峰,韦缤媛,等.凡纳滨对虾MT基因序列及其在卵巢发育和低温胁迫中的表达分析[J]水生生物学报,2013,37(4):678-683.
[9] 郑丽明,周发林,杨其彬,等.斑节对虾金属硫蛋白基因c DNA克隆与表达分析[J].水生生物学报,2011,35(6):913-919
[10] 田丽萍.中国明对虾(Fenneropenaeus chinensis)金属硫蛋白基因和启动子的克隆与鉴定[D].青岛:中国科学院海洋研究所,2005.
[11] Binz P A,Kägi J H R.Metallothionein:molecular evolution and classification[M]∥Metallothionein IV.Struttgart:Birkhäuser,1999:7-13.
[12] Leignel V,Marchand J,Moreau B,et al.Metallothionein genes from hydrothermal crabs(Bythograeidae,Decapoda):characterization,sequence analysis,gene expression and comparison with coastal crabs[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2008,148(1):6-13.
[13] Chabanon H,Nury D,Mickleburgh I,et al.Characterization of the cis-acting element directing perinuclear localization of the metallothionein-1 m RNA[J].Biochemical Society Transactions,2004,32(5):702-704.
[14] Díaz S,Amaro F,Rico D,et al.Tetrahymena metallothioneins fall into two discrete subfamilies[J].PLoS One,2007,2(3):e291.
[15] Chavez-Crooker P,Pozo P,Castro H,et al.Cellular localization of calcium,heavy metals,and metallothionein in lobster(Homarus americanus)hepatopancreas[J]. Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2003,136(3):213-224.
[16] Ren F,Jiang H,Sun J,et al.Cloning,characterization,expression,and copper sensitivity of the metallothionein-1 gene in the Chinese mitten crab,Eriocheir sinensis[J]. Molecular Biology Reports,2011,38(4):2383-2393.
[17] Wu J P,Chen H C.Metallothionein induction and heavy metal accumulation in white shrimp(Litopenaeus vannamei)exposed to cadmium and zinc[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2005,140(3):383-394.
[18] Amiard J C,Amiard-Triquet C,Barka S,et al.Metallothioneins in aquatic invertebrates:their role in metal detoxification and their use as biomarkers[J].Aquatic Toxicology,2006,76(2):160-202.
[19] Gao A B,Wang L,Yuan H.Expression of metallothionein cDNA in a freshwater crab,(Sinopotamon yangtsekiense),exposed to cadmium[J].Experimental and Toxicologic Pathology,2012,64(3):253-258.
Clone and Gene Expression Analysis of Metallothionein from Marsupenaeus japonicus
SHI Zhuang-zhuang,MAO Yong,QIAO Ying,WANG Jun*
(College of Ocean&Earth Sciences,Xiamen University,Xiamen 361102,China)
Based on the partial sequences of the metallothionein(MT)gene fragment in Marsupenaeus japonicus transcriptome,the complete cDNA sequence of MT of the shrimp was obtained by using RT-PCR and RACE.The full length of MT c DNA was 549 bp,encoded 58 amino acids with a 5′-untranslated region 68 bp and a 3′-untranslated region 304 bp.In the encoded protein,not any aromatic amino acid was found and the cysteines accounted for 31.0%of the total amino acid demonstrating the typical structure with Cys-X(1-3)-Cys type.Additionally,the M·japonicus MT gene shared a high identity up to 76%with the MT sequences of Penaeus monodon.Moreover,real-time PCR results showed the differential expression of MT cDNA in M·japonicus,with the highest expression in gill,followed in stomach and then in the hepatopancreas.
metallothionein;Marsupenaeus japonicus;clone;tissue expression
Q 781
A
0438-0479(2015)04-0464-05
10.6043/j.issn.0438-0479.2015.04.004
2014-11-03 录用日期:2015-01-13
国家高技术研究发展计划(863计划)(2012AA10A409-03);国家现代农业“虾产业技术体系”(CARS-47)
*通信作者:junw@xmu.edu.cn
石壮壮,毛勇,乔莹,等.日本囊对虾金属硫蛋白基因cDNA的克隆及组织表达分析[J].厦门大学学报:自然科学版,2015,54(4):464-468.
:Shi Zhuangzhuang,Mao Yong,Qiao Ying,et al.Clone and gene expression analysis of metallothionein from Marsupenaeus japonicus[J].Journal of Xiamen University:Natural Science,2015,54(4):464-468.(in Chinese)
