RNAi靶向抑制p65基因对大鼠骨髓间充质干细胞向神经元分化的影响*
2015-05-24赵二义贾延吉力王带媚文国强关文娟景黎君邓益东
赵二义,贾延吉力,王带媚,文国强,关文娟,景黎君,邓益东△
(1.海南省人民医院神经内科,海口 570311;2.郑州大学第一附属医院神经内科,河南 郑州 450052)
骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)可向多种细胞分化,在细胞转向分化的过程中可能存在多条信号通路,如Notch、Sox、Wnt等通路通过信号联系网络,启动信号重组、整合后,引领分化方向。核因子-κB(nuclear factor-kappa B)是细胞增殖与凋亡的重要调控因子,通过结合特异性序列调控多种基因的表达。p65蛋白是其重要的亚单位,由p65基因在细胞核内表达后转移至胞浆内,与另一个核因子-κB亚单位p50结合成p50/p65异源二聚体,胞浆内的 NF-κB抑制蛋白(IκB)与p50/p65结合,而抑制NF-κB活性。研究表明,NF-κB信号参与调控神经干细胞(neural stem Cell,NSCs)增殖、分化及凋亡等命运[1],在 MSCs向神经元分化过程中,NF-κB 核移位受抑制[2],而 MSCs与NSCs具有许多相似性,因此,理论上NF-κB信号也可能参与MSCs增殖、分化及凋亡调控。然而,目前采用RNAi技术下调NF-κB信号通路中的p65亚单位来研究其对MSCs增殖、分化的影响尚无相关报道。本研究初步探讨RNAi靶向抑制p65基因,对MSCs的增殖、分化及凋亡的影响,并研究MSCs向神经元分化的机制。
1 材料与方法
1.1 实验动物
由海南省中国热带农业科学院实验动物中心提供2~3月龄健康的Wistar大鼠,雌雄不限,体重150~250g,饲养条件符合清洁级标准,实验对动物的处理方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》标准。
1.2 主要试剂
DMEM培养基及胎牛血清(美国Gibco公司);兔抗大鼠p65、神经元特异性烯醇化酶(NSE)、神经元微管结合蛋白(MAP-2)和胶质细胞原纤维酸性蛋白(GFAP)等多克隆抗体(美国Santa Cruz公司);FITC荧光标记的山羊抗兔IgG(H+L)(上海碧云天公司);自 Qiagen公司采购大鼠的 Rn-p65-siRNA、Cy3标记的阴性对照Negative Control siRNA、转染试剂HiPerFect;RNeasy Mini试剂盒及QIAGEN OneStep RT-PCR试剂盒;四甲基偶氮唑盐(MTT)(美国Sigma公司);法舒地尔(天津红日药业股份有限公司);胰蛋白酶等实验试剂均为进口分装或国产分析纯。由上海生物工程公司根据设计合成大鼠的p65及β-actin引物,序列见表1。

Tab.1 Sequences for primer
1.3 MSCs培养及分组
取Wistar大鼠,颈椎脱臼处死后,75%乙醇浸泡5 min,在无菌条件环境中分离大鼠两侧股骨,剪开股骨两端,以含10%胎牛血清的DMEM培养基反复冲洗骨髓腔,用1 ml无菌注射器反复吹打,制成细胞悬液,以2×106cells/ml的细胞密度直接种于25 cm2的塑料培养瓶中,放置在37°C、50ml/L的CO2恒温培养箱内培养,待贴壁细胞完全融合后,以含0.04%EDTA/0.25%胰蛋白酶消化传代,按1×105cells/ml的密度接种。每隔72 h换液,连续传代培养至少6代以上,随后将MSCs细胞悬液冻存在液氮中备用。取培养第6代以上的MSCs复苏后,用完全培养基(DMEM+15%胎牛血清+谷氨酰胺0.5 mol/L)充分沉淀混匀MSCs后,按每孔接种2×106个细胞至12孔培养板,放置在37°C、50ml/L的CO2恒温培养箱内培养2~3 d,选择细胞融合度达50%~70%时进行转染,效果最佳。将培养的骨髓间充质干细胞分为未转染组、转染组及阴性对照组3组,6孔/组。
1.4 siRNA转染MSCs
参照本室的实验方法[3],MSCs的融合度达50% ~70%,参照Qiagen公司的细胞转染实验操作步骤,转染细胞。具体操作方法如下:吸取培养基1100μl(DMEM培养基+10%胎牛血清+双抗)加入培养板中,置于37°C、50ml/L的CO2恒温培养箱内孵育。同时,分别吸取 DMEM培养基100μl溶解300ng Rn-p65-siRNA 和 negative control siRNA,再吸取HiPerFect转染试剂6μl,充分混匀;置于室温孵育10min;再将转染复合物均匀加入含MSCs孔中,每孔中的siRNA的浓度要达到20nmol/L,放置在37°C、50ml/L的CO2恒温培养箱内孵育24~72 h。未转染组不转染siRNA,其培养条件与转染组及阴性对照组相同。Cy3标记的阴性对照Negative Control siRNA转染24h、48 h、72 h后在倒置荧光显微镜下观察MSCs的荧光表达,评价细胞转染效率。
1.5 siRNA转染MSCs后检测
1.5.1 四甲基偶氮唑盐(MTT)比色法 采用MTT比色检测法,将各组的MSCs根据转染前、后各个相同时间点,均匀移入96孔板,每孔加入50μl MTT(5.0mg/ml),置于37°C、50ml/L 的 CO2恒温培养箱内孵育 4h,每孔再加入 200μl二甲基亚砜(DSMO),继续孵育至结晶崩解,取空白孔调零,利用酶标仪测定每个孔的吸光度值(波长490nm),细胞存活率=细胞组A均值/空白组 A均值 ×100%。
1.5.2 RT-PCR法 利用RNeasy Mini试剂盒提取各实验组的MSCs的RNA,运用RT-PCR检测实验组MSCs内p65 mRNA表达变化情况。按照QIAGEN®OneStep RT-PCR试剂盒的操作步骤行RTPCR,50μl反应体系,10μl 5 × Buffer,2μl dNTP Mix,2μl QIAGEN OneStep RT-PCR Enzyme Mix,10μl 5 × Q-Solution,10U RNase inhibitor,1.0μg RNA,0.6μmol/L引物。扩增参数:50℃逆转录30min,95℃生成15 min,94℃变性1 min,58℃ 退火1 min,72℃ 延伸1 min,总共进行30~35个循环,再72℃延伸10min。吸取10μl RT-PCR 产物 +2.0μl样缓冲液,滴入2%琼脂糖凝胶上行电泳,通过自动凝胶成像系统,将电泳结果拍摄保存,分析各目的基因与β-actin基因条带光度值。
1.5.3 Western blot印迹 取各组的MSCs,用100μl细胞裂解液裂解、变性、离心,留取上清蛋白质标本,利用分光光度法对蛋白质进行定量分析。取蛋白裂解液加凝胶缓冲液进行SDS-PAGE胶电泳,电泳之后,将蛋白质转至硝酸纤维素膜。取出膜后在室温条件下用封闭液(山羊血清)封闭3 h,然后加入一抗p65蛋白兔抗多克隆抗体(工作浓度分别为1∶200~300),4℃孵育过夜,二抗(工作浓度为1∶10000),37℃孵育60~120min,DAB 显色检测棕黄色条带。结果转膜后丽春红染色进行校正,照相记录结果,Quantity One软件分析图片灰度值。
1.6 体外诱导MSCs分化为神经元
1.6.1 诱导方法 按照前期实验的细胞诱导法[4],将各实验组培养72 h后的MSCs行诱导实验。用D-Hank’s液清洗 MSCs 3遍,加诱导液(由DMEM液体培养基+10%胎牛血清+200μmol/l法舒地尔混匀调制),置于37°C、50ml/L的CO2的条件下诱导6 h。将MSCs置于倒置显微镜下观察诱导前后细胞形态学演变。采取细胞免疫组化法检测诱导前后神经元特异蛋白NSE、MAP-2、GFAP的变化。
1.6.2 细胞形态学观察 倒置显微镜下动态观察MSCs诱导分化前后形态学变化
1.6.3 细胞免疫组化染色法 用PBS清洗各组细胞,随后取4%多聚甲醛的固定液在4℃环境中固定20min,0.2%Triton X-100处理 10min,封闭液(10%胎牛血清)封闭1 h。分别使用一抗兔抗p65多克隆抗体(2μg/ml)、兔抗 NSE多克隆抗体(1μg/ml)、兔抗 MAP-2多克隆抗体(1μg/ml)及兔抗GFAP 多克隆抗体(1μg/ml),4℃ 孵育 24h。取PBS清洗3次后,在室温条件下用FITC标记的山羊抗兔IgG(1∶500)行染色标记、观察。利用倒置荧光显微镜拍摄(×200)细胞图像。各组均采集≥30个区域的细胞。尽量保证明视野下所采集的每张图像都含相同的细胞数。采取双人双盲法随机统计阳性细胞百分比例。
1.7 统计学处理
2 结果
2.1 siRNA转染MSCs
2.1.1 荧光观察 Cy3标记的negative control siRNA对照组MSCs荧光表达,随着转染时间延长,荧光表达逐渐增强。转染MSCs 24h开始出现部分红色荧光,转染率为28.2% ±4.3%;48 h后荧光表达明显增多,转染率为63.5% ±3.4%;72 h后荧光表达最强,转染率可达83.3% ±3.8%(图1A、B及C)。
2.1.2 各组MSCs存活率变化 MTT结果表明,转染前各组细胞存活率无统计学意义,转染后24h,Rn-p65-siRNA转染组MSCs的存活率显著下降,与未转染组及阴性对照组MSCs比较有统计学差异(P<0.05)。转染48 h和72 h后存活率虽然较24h有所上升(P<0.05),但仍明显低于未转染组及阴性对照组MSCs,与未转染组及阴性对照组的MSCs的MTT比较仍有统计学意义(P<0.05,表2)。
2.1.3 各组MSCs的p65 mRNA的表达变化 RTPCR结果显示,各组的MSCs转染前均可见p65 mRNA表达;转染24h后,Rn-p65-siRNA转染组的MSCs表达p65 mRNA开始显著减少,持续至72 h;与此同时,未转染组及阴性对照组p65 mRNA表达无明显变化(表3)。
2.1.4 各组MSCs的p65蛋白表达的变化 Western blot印迹检测显示,转染前各组均可见p65蛋白表达,转染24h p65蛋白下降,以转染72 h最显著;未转染组和阴性对照组中无此现象(表4)。
2.2 体外诱导MSCs分化为神经元
2.2.1 细胞形态观察 未转染组及阴性对照组MSCs向神经元分化速度较慢,诱导2~3 h细胞胞体开始收缩,呈锥形,折光性差,诱导4~5 h后部分细胞胞体收缩成圆形或多角形,部分胞体可观察到光晕,突起细长,部分细胞的突起交织成网络。Rnp65-siRNA转染组MSCs向神经元分化速度快,诱导1 h后胞体开始收缩,细胞间隙拉大,可见粗大突起,少部分交织成网,诱导2~3 h后,绝大多数细胞胞体收缩成圆形或锥形,立体感强,可见细长的细胞突起,部分交织成网络结构,可见少许细胞脱落、死亡。诱导6 h后,可见神经元样细胞明显增多,形成典型神经网络(图2A)。
2.2.2 各组神经元蛋白表达的变化 细胞免疫组化染色法诱导6 h后各组神经元蛋白表达结果显示,与未转染组及阴性对照组比较,转染组蛋白表达显著的增高(P<0.05);未转染组、阴性对照组及转染组的GFAP表达率均小于1%,无显著性差异。与未转染组及阴性对照组比较,转染组P65的表达 显著下降(P<0.01,表5,图2B、C、D、E)。
Tab.2 Values of MTT in each set of MSCs(%,,n=10)

Tab.2 Values of MTT in each set of MSCs(%,,n=10)
*P<0.05 vs non-transfected group;#P<0.05 vs negative control group
?
Tab.3 Values of p65 mRNA in each set of MSCs(,n=10)

Tab.3 Values of p65 mRNA in each set of MSCs(,n=10)
*P<0.05 vs non-transfected group;#P<0.05 vs negative control group
?
Tab.4 The values of p65 protein in each set of MSCs(,n=10)

Tab.4 The values of p65 protein in each set of MSCs(,n=10)
*P<0.05 vs non-transfected group;#P<0.05 vs negative control group
?
Tab.5 Results of immunocytochemistry staining in each group 6 h after induction(%,,n=10)

Tab.5 Results of immunocytochemistry staining in each group 6 h after induction(%,,n=10)
NSE:Neuron-specific enolase;MAP-2:Neuronal microtubule-associated protein-2;GFAP:Glial cells fibrillar acidic protein*P<0.05 vs non-transfected group;#P<0.05,##P<0.01 vs negative control group
Group NSE MAP-2 GFAP P65 Non-transfected 62.0±1.3 60.2±2.5 <1 61.2±2.3 Negative control 61.3±0.5 60.6±1.8 <1 60.5±1.8 Transfected 83.5±1.2*#81.2±2.2*# <1 32.8±4.2**##

Fig.1 Fluorescence expressed on MSCS tranfected by Cy3 labeled negative control siRNA(bar=100μm)
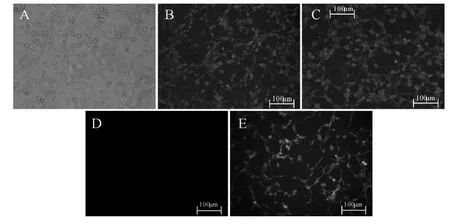
Fig.2 Induce MSCs of transfected group into neurons expression of NSE and MAP-2(6 h after induction,bar=100μm)
3 讨论
MSCs是一种具多种分化潜能的细胞,可向成骨细胞、脂肪细胞、胰岛细胞及神经元等细胞分化。研究发现骨髓间充质干细胞在神经损伤、修复过程具有保护作用,可能机制包括可向神经元分化,分泌相关神经营养因子,促进血管再生及抑制免疫反应[5]。Notch、Rho 和 mTOR 信号通路参与调节MSCs向神经元分化进程,适度调节信号通路活性,可提高 MSCs向神经元分化效率[4,6],在 MSCs向神经元分化中可能牵涉多条信号重组、整合及引导分化方向,反映MSCs分化机制的复杂性。有研究发现MSCs向神经细胞分化过程中,伴随NF-κB核转位受抑制[2],据此,推测 NF-κB 信号可能在 MSCs增殖、凋亡、分化等生命活动中起着重要作用。本研究发现,转染Rn-p65-siRNA,MSCs的p65 mRNA表达逐渐减少,当转染72 h,p65基因沉默率最高,p65蛋白表达最弱,与转染Cy3标志negative control siRNA转染72 h荧光表达最强基本一致,这提示转染72 h后,NF-κB信号最弱,是MSCs诱导分化最理想时机。因此,本研究选择在转染72 h后,选取各组细胞进行诱导分化,研究NF-κB信号在调控细胞分化的作用。转染Rn-p65-siRNA后,p65蛋白表达减弱,提示 NF-κB信号抑制,且 MTT检测发现 MSCs的凋亡率逐渐增加,72 h后凋亡率最高,与其它实验组比较有显著统计学意义,结果与NF-κB受抑制后神经干细胞凋亡增加现象类似[7]。MSCs凋亡率增高的可能机制:(1)NF-kB信号受抑制后抗凋亡基因表达下调,细胞抗凋亡作用减弱。(2)NF-κB信号受抑制导致细胞周期蛋白D1表达减少,引起细胞增殖能力下降。因此,推测 NF-κB信号在MSCs增殖、凋亡等命运其中重要作用。
神经干细胞分化涉及到信号级联反应,不同的转录因子的活化,决定细胞分化的方向,已有研究发现白介素-6(IL-6)及睫状神经营养因子介导激活NF-κB通路,可促进神经干细胞向星形胶质细胞分化[8]。相反,在成神经瘤细胞诱导分化的研究中发现,胞核内的NF-κB信号传导受抑制可抑制神经分化[9]。在脑室下层神经干细胞研究中发现,骨形成蛋白可促进神经干细胞向神经元分化,骨形成蛋白信号介导的神经干细胞分化具有剂量依赖性,而NF-κB可以正向调节骨形成蛋白[10],提示神经干细胞向神经元分化过程非常复杂,可能牵涉到多种细胞因子共同作用,但对NF-κB信号在MSCs向神经元分化的机制了解较少。本研究采取小RNA干扰技术,转染Rn-p65-siRNA,阻断NF-κB信号通路,并采用法舒地尔诱导细胞分化,观察细胞分化效率。本研究发现,转染组MSCs诱导后细胞可高表达NSE、MAP-2,但表达 GFAP很少。结果表明阻断NF-κB信号后,MSCs向神经元分化效率显著增高,而未转染组及阴性对照组MSCs未观察到此现象,因此,推测MSCs分化过程中也可能涉及多种转录因子作用,多个信号级联反应,启动MSCs分化方向,而其中抑制NF-κB信号可能更有利MSCs向神经元方向分化,可能存在以下原因:(1)法舒地尔可能通过抑制Rho/ROCK通路,启动间充质干细胞分化进程,调节细胞骨架形成[11];阻断NF-κB 信号,抑制细胞向胶质细胞分化[8]。因此,联合抑制 Rho/ROCK和NF-κB信号,可从不同信号级联反应途径促进MSCs向神经元方向分化。(2)NF-κB信号与Rho/ROCK信号可能存在协同作用(cross-talk):1)本实验中发现抑制NF-κB信号并没有引起MSCs向神经元样细胞分化,但加入法舒地尔诱导后,MSCs可以向神经元样细胞高效分化;2)在小鼠单核巨噬细胞实验中,显示NF-κB与RhoA GTP酶存在协同作用[12];3)卵巢肿瘤细胞实验中发现Rho激酶抑制剂可抑制NF-κB信号[13]。据此推测这两条不同的信号途径之间可能存在协同作用,通过抑制Rho/ROCK信号传导,可能从旁侧途径调节NF-κB信号,从而更有利于MSCs向神经元分化。
综上所述,本研究发现NF-κB信号参与大鼠MSCs的增殖、凋亡及分化等生命活动,抑制p65基因转录,调节p65蛋白表达,阻断NF-κB信号传导,有利于提高MSCs向神经元样细胞分化效率。
[1]Widera D,Mikenberg I,Kaltschmidt B,et al.Potential role of NF-kB in adult neural stem cells:the underrated steersman[J].Int J Dev Neurosci,2006,24(2-3):91-102.
[2]杨 琴,贾延吉力,杨 军,等.核因子-kB在黄芩甙诱导大鼠骨髓基质细胞分化为神经细胞中的作用[J].中国中西医结合杂志,2005,25(3):248-251.
[3]王留东,赵二义,贾延吉力,等.Caveolin-1在大鼠骨髓间质干细胞分化为神经细胞中的作用[J].中国病理生理杂志,2010,26(7):1385-1389
[4]赵二义,王留东,贾延吉力,等.Notch信号在盐酸法舒地尔诱导大鼠骨髓间充质干细胞向神经元分化过程中的作用[J].中国应用生理学杂志,2010,26(4):248-251.
[5]王昌铭,滕军放,王景周,等.颈内动脉输注骨髓间充质干细胞对血管性痴呆大鼠血清NSE和S-100蛋白含量的影响及意义[J].中华神经医学杂志,2014,13(2):125-130.
[6]张广宇,王翠琴,贾延吉力,等.自噬在大鼠骨髓间质干细胞神经分化过程中的作用[J].中国应用生理学杂志,2013,29(5):389-394.
[7]Mincheva-Tasheva S,Soler RM.NF-κB signaling pathways:role in nervous system physiology and pathology[J].Neuroscientist,2013,19(2):175-194.
[8]Mondal D,Pradhan L,LaRussa VF.Signal transduction pathways involved in the lineage differentiation of NSCs:can the knowledge gained from blood be used in the brain[J].Cancer Invest,2004,22(6):925-943.
[9]Fan Z,Bau B,Yang H,et al.IL-1β induction of IL-6 and LIF in normal articular human chondrocytes involves the ERK,p38 and NF-κB signaling pathways[J].Cytokine,2004,28(1):17-24.
[10]Feng Z,Porter AG.NF-κB/Rel proteins are required for neuronal differentiation of SH-SY5Y neuroblastoma cells[J].J Biol Chem,1999,274(43):30341-30344.
[11]Lim HS,Joe YA.A ROCK inhibitor blocks the inhibitory effect of chondroitin sulfate proteoglycan on morphological changes of mesenchymal stromal/stem cells into neuron-like cells[J].Biomol Ther(Seoul),2013,21(6):447-453.
[12]Kim HJ,Kim JG,Moon MY,et al.IκB kinase γ/nuclear factor-κB-essential modulator(IKKγ/NEMO)facilitates RhoA GTPase activation,which,in turn,activates Rho-associated KINASE(ROCK)to phosphorylate IKKβ in response to transforming growth factor(TGF)-β1 [J].J Biol Chem,2014,289(3):1429-1440.
[13]Jeong KJ,Park SY,Cho KH,et al.The Rho/ROCK pathway for lysophosphatidic acid-induced proteolytic enzyme expression and ovarian cancer cell invasion [J].Oncogene,2012,31(39):4279-4289.
